甲磺酸阿帕替尼通过p53抑制结肠癌细胞HCT116增殖的作用及机制
2020-09-22杨瀚林汤弘婷杨娟刘虹麟李梦醒李琴山
杨瀚林,汤弘婷,杨娟,刘虹麟,李梦醒,李琴山,4△
结肠癌是消化系统常见的恶性肿瘤之一,主要表现为肠道侵袭性恶变,是全球范围内第4 高发的恶性肿瘤,我国每年约有16万患者死于结肠癌[1-2]。其常用治疗手段为手术辅以放疗或化疗,但目前常用化疗药物容易产生耐药,且药物对肿瘤细胞的杀伤作用缺乏靶向性。因此,寻找新的结肠癌化疗药物具有重要临床意义。甲磺酸阿帕替尼(以下简称阿帕替尼)是一类靶向血管内皮生长因子受体2(vascular endothelial growth factors receptor 2,VEGFR2)的口服小分子受体酪氨酸激酶抑制剂,已在包括消化系统肿瘤在内的多种恶性肿瘤及对其他化疗药物产生耐药的肿瘤中展现出较好疗效[3-5],有临床应用前景。但最近研究发现肿瘤细胞可通过多种机制对阿帕替尼产生耐药性,为阿帕替尼的应用提出了挑战[6-7]。野生型p53基因是一类重要抑癌基因,在60%的结肠癌中可观察到p53基因突变,突变型p53促进了结肠癌发生发展[8]。然而研究发现野生型p53基因对肿瘤发生、肿瘤细胞获得干性、肿瘤对化疗药物产生耐药有促进作用[9-11]。但野生型p53是否参与了结肠癌细胞对阿帕替尼产生耐药,目前报道较少。本研究旨在通过体外实验观察敲除结肠癌细胞HCT116 的野生型p53后,阿帕替尼对HCT116杀伤作用的变化,从而为阿帕替尼治疗结肠癌提供新的思路。
1 材料与方法
1.1 材料
1.1.1 细胞株 人结肠癌HCT116 p53+/+细胞株购自中国医学科学院基础医学研究所细胞中心;以CRISPR-Cas9法构建的敲除野生型p53的人结肠癌HCT116 p53-/-细胞株由中日友好医院刘虹麟副教授馈赠。
1.1.2 药品、试剂及仪器 DMEM 培养基、青霉素/链霉素混合液购自美国sigma 公司。胎牛血清、胰蛋白酶购自美国Gibco 公司。RIPA 蛋白裂解液、5 倍浓缩的蛋白上样缓冲液购自北京普利莱基因技术有限公司。PMSF购自北京索莱宝科技有限公司。甲磺酸阿帕替尼片购自江苏恒瑞医药股份有限公司。CCK-8 细胞增殖毒性检测试剂盒购自日本同仁化学研究所。BCA蛋白定量试剂盒、ECL发光液、Annexin V/PI 流式细胞凋亡试剂盒、RNA 逆转录试剂盒购自美国Thermo Fisher 公司。鼠抗人 P53 抗体、兔抗人 NF-κB p65 抗体、兔抗人Caspase-3 抗体购自美国CST 公司。鼠抗人GAPDH 抗体购自美国Proteintech 公司。山羊抗兔IgG 二抗抗体、兔抗鼠IgG 二抗抗体均购自美国sigma 公司。0.22 μm PVDF 膜购自美国Merck Millipore 公司。RNA 提取试剂盒、实时荧光定量PCR 试剂盒均购自德国Qiagen 公司。Quantinovo Q5 实时荧光定量PCR 仪购自美国Thermo Fisher公司。FACSCantoⅡ流式细胞仪购自美国BD公司。Western blot电泳仪、ChemiDoc成像仪均购自美国Bio-Rad公司。
1.2 方法
1.2.1 细胞培养 HCT116 p53+/+、HCT116 p53-/-细胞培养于含10%胎牛血清、1%青霉素/链霉素混合液的DMEM完全培养基,在37 ℃、5%CO2培养箱中进行培养。待细胞长满培养瓶底面积80%~90%时进行传代。细胞传代时,弃去旧培养基,以D-Hanks 洗细胞3 次,0.1%胰蛋白酶消化。随后加入含胎牛血清的培养基终止消化,离心收集细胞。以新鲜的DMEM完全培养基重悬细胞,将细胞传至2个新的培养瓶中,加入适量DMEM 完全培养基继续培养细胞。选取对数生长期细胞用于实验。
1.2.2 CCK-8法检测细胞增殖 取对数生长期的HCT116p53+/+、HCT116 p53-/-细胞,按常规胰酶消化方法制备细胞悬液,随后按照5×103细胞/孔将细胞接种于96孔板,接种24 h后加入药物处理。实验共设计4组,阿帕替尼浓度分别为0、15、30、60 μmol/L,并设置仅有等体积DMEM 完全培养基的空白孔排除培养基干扰。实验共设置2个检测时间点:24 h和48 h,每组设置3个复孔。药物处理24、48 h后,每孔加入10 μL的CCK-8 试剂,继续培育2 h。以酶标仪检测450 nm 波长下各孔的光密度(OD)值,计算细胞存活率。
1.2.3 Annexin V-APC/PI 法检测细胞凋亡 取对数生长期的HCT116 p53+/+、HCT116 p53-/-细胞,按照2×105细胞/孔将细胞接种于6 孔板,接种24 h 后加入药物处理。实验共设计3组,阿帕替尼浓度分别为0、15、30 μmol/L。药物处理24 h后收集细胞,以不含EDTA的0.25%胰蛋白酶消化细胞,按照试剂盒说明书进行Annexin V-APC、PI染色,随后上机检测细胞凋亡情况。
1.2.4 实时荧光定量 PCR 检测p53、NF-κB p65、Caspase-3mRNA 表达 以 0、15、30 μmol/L 阿帕替尼处理 HCT116 p53+/+、HCT116 p53-/-细胞24 h,随后按照试剂盒说明书提取各组细胞总RNA。以微量分光光度计测RNA 浓度,按照试剂盒说明书将RNA 逆转录为cDNA,反应条件为:65 ℃5 min;25 ℃ 5 min;42 ℃ 60 min;70 ℃ 5 min。以微量分光光度计测cDNA 浓度后按照实时荧光定量PCR 试剂盒说明书检测细胞中p53、NF-κB p65、Caspase-3的mRNA表达水平。实时荧光定量 PCR 反应条件为:95 ℃ 2 min;95 ℃ 5 s,60 ℃ 13 s,进行40 个循环。引物由美国Invitrogen 公司合成,引物序列见表1。以2-ΔΔCt法计算各组细胞目的基因相对表达水平。
1.2.5 Western blot 检测 P53、NF-κB p65、Caspase-3 蛋白表达 以 0、15、30 μmol/L 阿帕替尼处理 HCT116 p53+/+、HCT116 p53-/-细胞24 h后提取细胞总蛋白,以BCA法检测各样本蛋白浓度,100 ℃加热10 min蛋白变性后,立即进行蛋白电泳、转膜。转膜结束后,PVDF 膜以5%脱脂牛奶室温封闭1 h,随后加入 P53(1∶1 000 稀释)、NF-κB p65(1∶1 000 稀释)、Caspase-3(1∶1 000 稀释)、GAPDH(1∶10 000 稀释)一抗,4 ℃摇床孵育过夜。TBST 洗4 次,随后加入HRP 标记的二抗(1∶20 000稀释),室温摇床孵育2 h,TBST洗4次。根据ECL 化学发光检测试剂盒说明书配置发光液,以Bio-Rad 成像仪进行条带显色,以Image J 软件进行半定量分析,以目的蛋白/内参蛋白(GAPDH)的灰度值作为蛋白的相对表达量。
1.3 统计学方法 选用SPSS 23.0统计学分析软件进行统计学分析,计数资料以均数±标准差()表示,多组间比较采用单因素方差分析,组间多重比较采用LSD-t法,2组间比较用成组t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 HCT116 p53-/-细胞的敲除效果 Western blot结果显示,HCT116 p53-/-细胞内未检测到P53 蛋白的表达,提示p53基因敲除成功,HCT116 p53-/-细胞可用于后续实验,见图1。
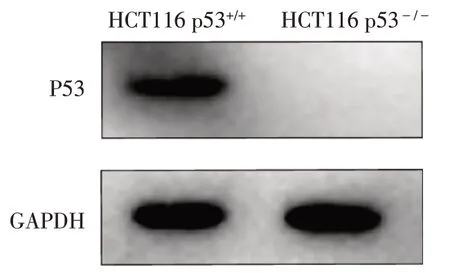
Fig.1 Knockout effect of p53 in HCT116 p53-/-cell图1 HCT116 p53-/-细胞的p53敲除效果
2.2 阿帕替尼对HCT116 p53+/+、HCT116 p53-/-细胞增殖的影响 CCK-8 结果显示,阿帕替尼对HCT116 p53+/+、HCT116 p53-/-细胞均有增殖抑制作用(P<0.01),且随药物浓度增加,阿帕替尼对2 种细胞的增殖抑制作用均逐渐增强(P<0.05)。与药物处理24 h 后相比,阿帕替尼作用48 h 后对2 种细胞的增殖抑制作用增强(P<0.05),见表2。
Tab.2 Effects of different concentrations of apatinib on HCT116 p53+/+and HCT116 p53-/-cell viability表2 不同浓度阿帕替尼对HCT116 p53+/+、HCT116 p53-/-细胞存活率的影响 (n=3,%,)
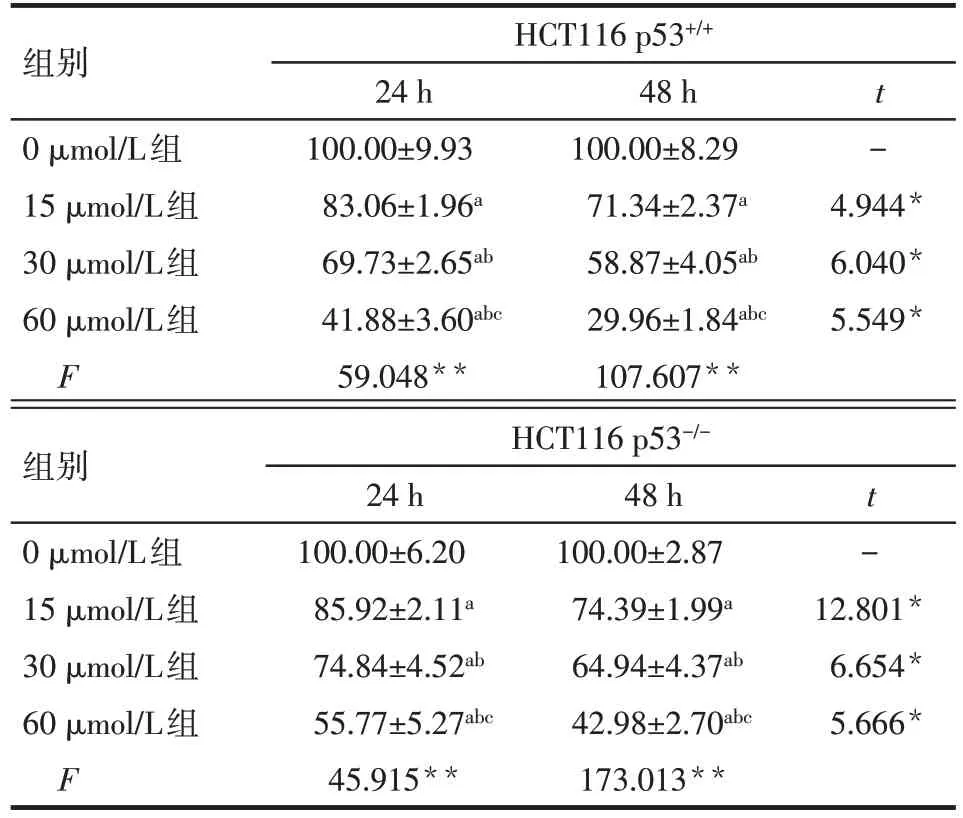
Tab.2 Effects of different concentrations of apatinib on HCT116 p53+/+and HCT116 p53-/-cell viability表2 不同浓度阿帕替尼对HCT116 p53+/+、HCT116 p53-/-细胞存活率的影响 (n=3,%,)
*P<0.05,**P<0.01;a 与 0 μmol/L 组比较,b 与 15 μmol/L 组比较,c与30 μmol/L组比较,P<0.05
组别0 μmol/L组15 μmol/L组30 μmol/L组60 μmol/L组F HCT116 p53+/+24 h 100.00±9.93 83.06±1.96a 69.73±2.65ab 41.88±3.60abc 59.048**48 h 100.00±8.29 71.34±2.37a 58.87±4.05ab 29.96±1.84abc 107.607**t-4.944*6.040*5.549*组别0 μmol/L组15 μmol/L组30 μmol/L组60 μmol/L组F HCT116 p53-/-24 h 100.00±6.20 85.92±2.11a 74.84±4.52ab 55.77±5.27abc 45.915**48 h 100.00±2.87 74.39±1.99a 64.94±4.37ab 42.98±2.70abc 173.013**t-12.801*6.654*5.666*
2.3 阿帕替尼对HCT116 p53+/+、HCT116 p53-/-细胞凋亡的影响 流式细胞术结果显示,梯度浓度阿帕替尼处理HCT116 p53+/+、HCT116 p53-/-细胞24 h后,与 0 μmol/L 组相比,15、30 μmol/L 组的细胞凋亡率增高(P<0.05),且与HCT116 p53+/+细胞相比,相同浓度阿帕替尼处理下,HCT116 p53-/-细胞的凋亡率较低(P<0.05),见表3、图2。
Tab.3 Effects of different concentrations of apatinib on apoptosis rates in HCT116 p53+/+and HCT116 p53-/-cells表3 不同浓度阿帕替尼对HCT116 p53+/+、HCT116 p53-/-细胞凋亡率的影响 (n=3,%,)
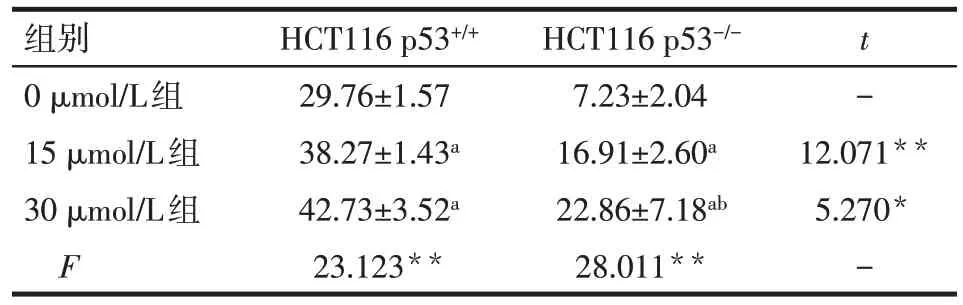
Tab.3 Effects of different concentrations of apatinib on apoptosis rates in HCT116 p53+/+and HCT116 p53-/-cells表3 不同浓度阿帕替尼对HCT116 p53+/+、HCT116 p53-/-细胞凋亡率的影响 (n=3,%,)
**P<0.01;a与0 μmol/L组比较,b与15 μmol/L组比较,P<0.05
组别0 μmol/L组15 μmol/L组30 μmol/L组F HCT116 p53+/+29.76±1.57 38.27±1.43a 42.73±3.52a 23.123**HCT116 p53-/-7.23±2.04 16.91±2.60a 22.86±7.18ab 28.011**t -12.071**5.270*-
2.4 阿帕替尼对HCT116 p53+/+、HCT116 p53-/-细胞的p53、NF-κB p65、Caspase-3mRNA 表达水平的影响 实时荧光定量PCR 结果显示,与0 μmol/L 组相比,梯度浓度阿帕替尼处理24 h 后,HCT116 p53+/+、HCT116 p53-/-细胞的p53、NF-κB p65、Caspase-3mRNA 表达水平均升高(P<0.05),且在 HCT116 p53+/+细胞中的表达水平高于HCT116 p53-/-细胞(P<0.05),见表4。
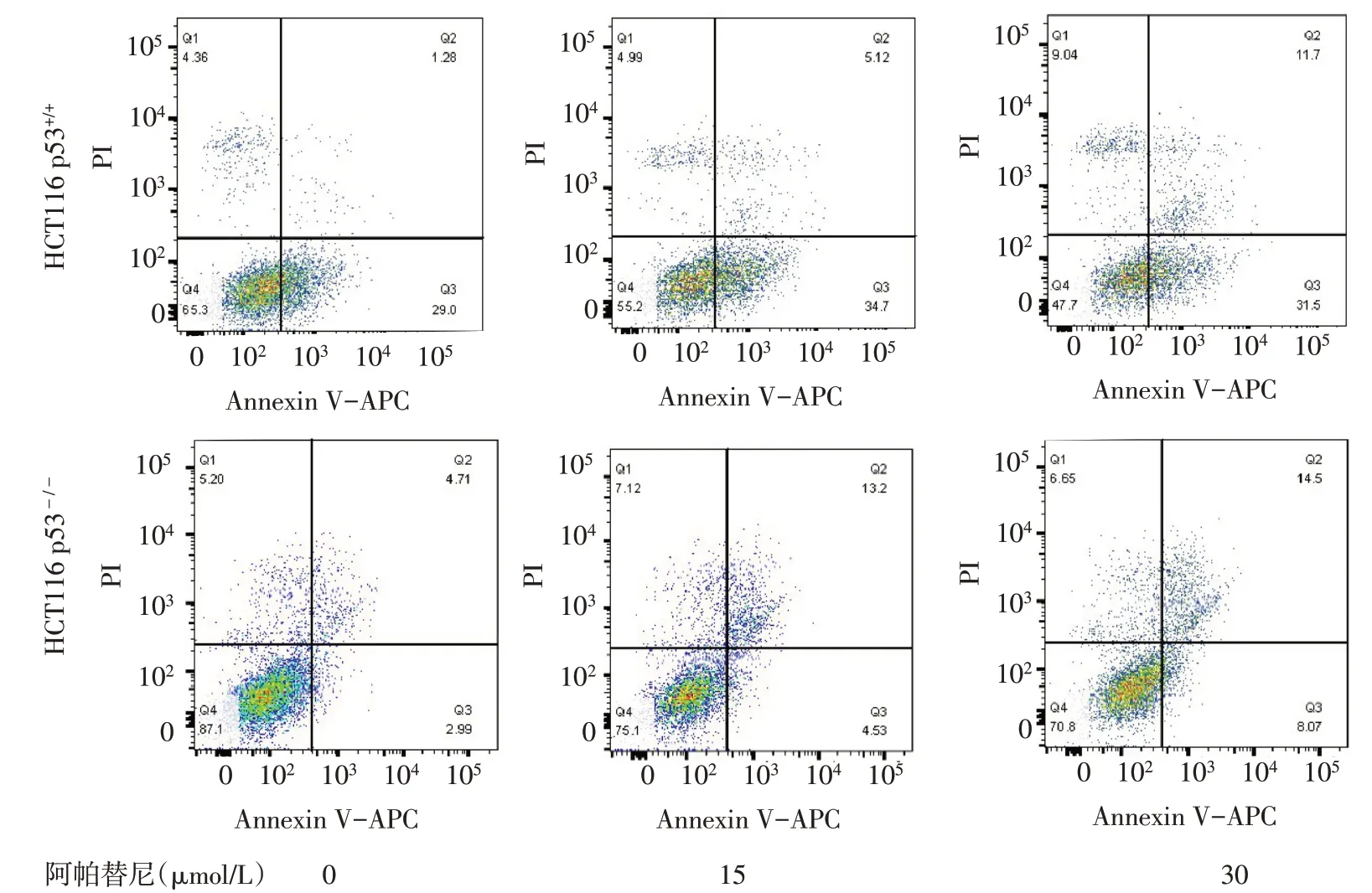
Fig.2 Effects of different concentrations of apatinib on apoptosis rates of HCT116 p53+/+and HCT116 p53-/-cells图2 不同浓度阿帕替尼对HCT116 p53+/+、HCT116 p53-/-凋亡率的影响
2.5 阿帕替尼对HCT116 p53+/+、HCT116 p53-/-细胞的 P53、NF-κB p65、Caspase-3 蛋白表达水平的影响 Western blot 结果显示,梯度浓度阿帕替尼处理24 h 后,与 0 μmol/L 组相比,HCT116 p53+/+中 P53、NF-κB p65 蛋白表达水平降低,但 HCT116 p53-/-的NF-κB p65蛋白表达水平升高(P<0.05),见表4、图3。阿帕替尼处理后2种细胞的Caspase-3蛋白表达水平均升高,且HCT116 p53+/+的表达水平高于HCT116 p53-/-的表达水平(P<0.01),见表4、图3。
Tab.4 The relative expression levels of p53,NF-κB p65 and Caspase-3 mRNA and protein of three groups表4 各组细胞的p53、NF-κB p65、Caspase-3 mRNA及蛋白表达水平 (n=3,)
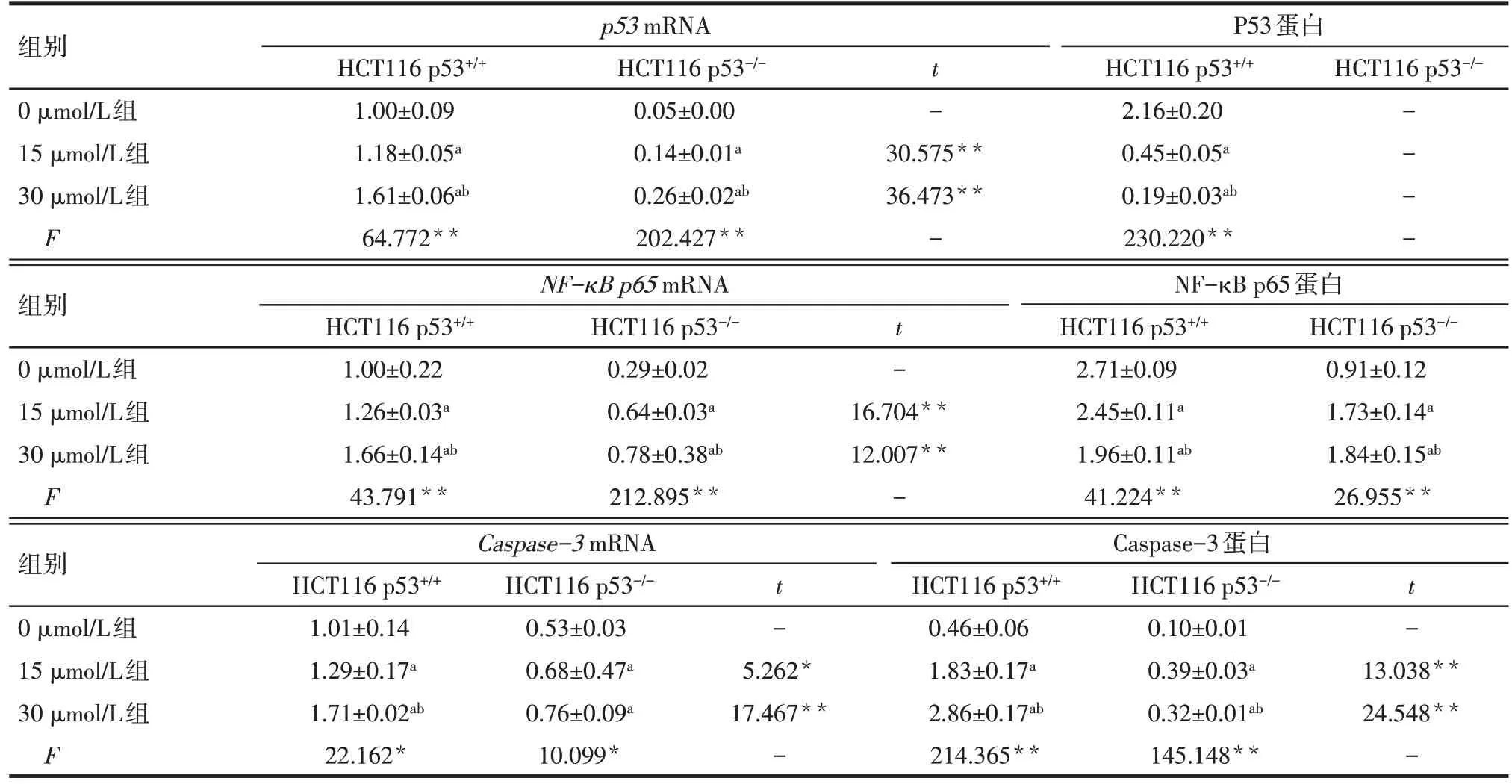
Tab.4 The relative expression levels of p53,NF-κB p65 and Caspase-3 mRNA and protein of three groups表4 各组细胞的p53、NF-κB p65、Caspase-3 mRNA及蛋白表达水平 (n=3,)
*P<0.05,**P<0.01;a与0 μmol/L组比较,b与15 μmol/L组比较,P<0.05
p53 mRNA HCT116 p53-/-组别0 μmol/L组15 μmol/L组30 μmol/L组F HCT116 p53+/+1.00±0.09 1.18±0.05a 1.61±0.06ab 64.772**HCT116 p53-/-0.05±0.00 0.14±0.01a 0.26±0.02ab 202.427**t -30.575**36.473**-P53蛋白HCT116 p53+/+2.16±0.20 0.45±0.05a 0.19±0.03ab 230.220**----组别0 μmol/L组15 μmol/L组30 μmol/L组F NF-κB p65 mRNA HCT116 p53+/+1.00±0.22 1.26±0.03a 1.66±0.14ab 43.791**HCT116 p53-/-0.29±0.02 0.64±0.03a 0.78±0.38ab 212.895**t -16.704**12.007**-NF-κB p65蛋白HCT116 p53+/+2.71±0.09 2.45±0.11a 1.96±0.11ab 41.224**HCT116 p53-/-0.91±0.12 1.73±0.14a 1.84±0.15ab 26.955**组别0 μmol/L组15 μmol/L组30 μmol/L组F Caspase-3 mRNA Caspase-3蛋白t -t -13.038**24.548**-HCT116 p53+/+1.01±0.14 1.29±0.17a 1.71±0.02ab 22.162*HCT116 p53-/-0.53±0.03 0.68±0.47a 0.76±0.09a 10.099*5.262*17.467**-HCT116 p53+/+0.46±0.06 1.83±0.17a 2.86±0.17ab 214.365**HCT116 p53-/-0.10±0.01 0.39±0.03a 0.32±0.01ab 145.148**
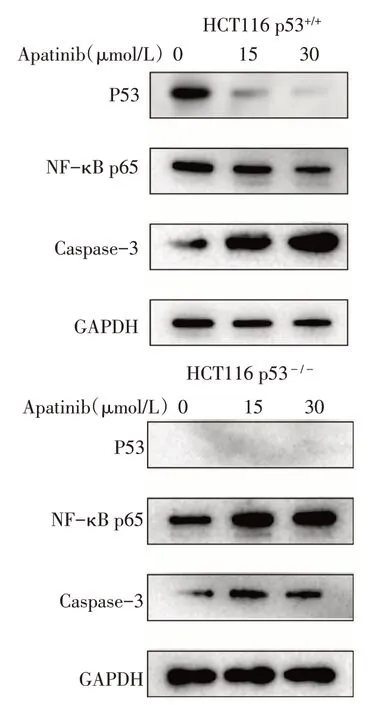
Fig.3 Western blot results of p53,NF-κB p65 and Caspase-3 protein expressions图3 Western blot检测p53、NF-κB p65、Caspase-3蛋白表达水平
3 讨论
结肠癌因发病较隐蔽、早期症状不明显,多数患者就诊时已错过了最佳治疗时机导致治疗效果不理想,如何有效治疗结肠癌一直是难题。目前结肠癌常用化疗药物主要包括5-氟尿嘧啶、卡培他滨、奥沙利铂等。常规化疗药物因不良反应明显,缺乏靶向性,还会杀伤正常细胞,故使用受到很多限制。近年来,靶向治疗药物因其特异性与肿瘤细胞位点结合,对正常细胞杀伤小,成为肿瘤治疗的新方向。阿帕替尼是一类靶向VEGFR2的小分子受体酪氨酸激酶抑制剂,已证实了其在胃癌、肺癌、胰腺癌中的抗癌作用[12-14],但目前关于阿帕替尼在结肠癌中作用的研究较少,其对结肠癌细胞作用的具体机制尚不明确。除已经报道的作用靶点外,阿帕替尼是否通过其他靶点对结肠癌细胞产生杀伤作用还需进一步研究探讨。
本研究发现,与HCT116 p53+/+细胞相比,阿帕替尼处理后HCT116 p53-/-的凋亡率更低。这与Boyer等[11]研究结果一致,他们发现,5-氟尿嘧啶、奥沙利铂等对敲除野生型p53后结肠癌细胞HCT116 的抑制作用降低,敲除野生型p53后结肠癌细胞对药物产生耐药。因此,本研究提示野生型p53参与结肠癌细胞对阿帕替尼产生耐药的过程。
p53是一类重要抑癌基因,野生型p53可促进受损DNA 修复,抑制肿瘤发展,但近年来研究显示野生型p53可以参与肿瘤发生。Kim等[9]发现,野生型p53在肝癌中通过促进PUMA基因表达,发挥促癌作用;在肝癌细胞中,野生型p53可促进肿瘤细胞发生代谢转换,促进肿瘤发展。本研究发现,阿帕替尼处理HCT116p53+/+细胞后,降低了P53 蛋白表达,与Jiang等[15]的研究结论一致。因此,笔者推断野生型p53可能在结肠癌细胞HCT116中发挥促癌作用,阿帕替尼通过降低野生型p53的表达而发挥肿瘤杀伤作用。
NF-κB 通路在多种恶性肿瘤中组成性高表达,促进肿瘤细胞增殖、阻止肿瘤细胞凋亡、增加肿瘤的血管生成和转移潜力,与肿瘤的发生发展密切相关[16]。NF-κB 通路经典激活途径为:在肿瘤坏死因子等相关信号分子刺激下,细胞质中NF-κB p65/p50 复合物与 IκB 解离,NF-κB p65/p50 复合物转移至细胞核中,与下游目的基因结合而发挥调控作用[17]。肿瘤坏死因子促进NF-κB通路激活需p53参与[18],NF-κB 通路激活后,可抑制肿瘤细胞发生凋亡,促进肿瘤发生[19]。NF-κB 通路可促进结肠癌细胞增殖、转移,促进肿瘤血管生长,对结肠癌的发生发展起到正向调控作用[20]。Caspase-3 处于细胞凋亡机制网络的核心位置,是细胞凋亡的执行分子,Caspase-3激活后作用于下游分子,诱导细胞发生凋亡[21]。Capsase-3也可通过促进NF-κB p65降解,抑制NF-κB通路激活[22]。本研究发现,阿帕替尼可下调结肠癌细胞HCT116中p53+/+的P53、NF-κB p65蛋白表达,抑制NF-κB通路激活,并促进Caspase-3蛋白表达,促进细胞凋亡,提示阿帕替尼可能通过抑制p53/NF-κB 通路而促进结肠癌细胞的凋亡;但敲除结肠癌细胞P53 表达后,阿帕替尼反而促进了NF-κB p65 蛋白表达。同时,阿帕替尼处理后,与HCT116 p53+/+细胞相比,HCT116 p53-/-细胞的Caspase-3 蛋白表达降低,提示敲除p53 后降低了阿帕替尼对结肠癌细胞的杀伤作用。本研究还发现,阿帕替尼处理后,结肠癌细胞的p53、NF-κB p65 的蛋白和mRNA 表达情况不一致,笔者推测可能与mRNA转录为蛋白的过程中还存在众多调控机制的影响有关,如基因转录、翻译过程存在一定延迟[23],以及不同mRNA 的转录速率可能存在差异[23]等,mRNA 与蛋白表达水平在某些程度上不一定相符。因此提示,阿帕替尼可能影响p53、NF-κB p65等基因从mRNA 翻译至蛋白的过程,但具体调控机制需要进一步研究探讨。
综上,阿帕替尼可能通过p53/NF-κB 通路促进结肠癌细胞发生凋亡,敲除野生型P53 后,与HCT116 p53+/+细胞相比,阿帕替尼处理后HCT116 p53-/-细胞的凋亡率较低,提示野生型P53 参与了结肠癌对阿帕替尼产生耐药的过程,本研究为阿帕替尼治疗结肠癌的临床使用提供一定理论基础。
