TRAP1对结直肠癌细胞增殖和凋亡的影响
2020-09-22李品玉盛文杰张嫄怡杨坚郑培丽张菲菲
李品玉,盛文杰,张嫄怡,杨坚,郑培丽,张菲菲
结直肠癌(colorectal cancer,CRC)是全球范围内最常见的恶性肿瘤之一,在我国其发病率和死亡率均位居恶性肿瘤第5位[1]。肿瘤细胞增殖和凋亡抵抗是导致不良预后的原因之一,磷脂酰肌醇3-激酶(phosphatidylinositol-3-kinases,PI3K)/蛋白质丝氨酸苏氨酸激酶(protein-serine-threonine kinase,AKT)信号通路是经典的肿瘤相关信号通路,对CRC细胞增殖和凋亡发挥重要的调节作用[2]。因此,针对PI3K/AKT信号通路关键节点以及调控因子进行研究有望为改善CRC患者预后提供新的突破点。肿瘤坏死因子受体相关蛋白1(tumor necrosis factor receptorassociated protein 1,TRAP1)是近年来研究发现的肿瘤相关蛋白,在多种肿瘤中异常表达[3],广泛参与调节肿瘤细胞周期、增殖、凋亡、迁移、上皮间质转化(epithelial-mesenchymal transition,EMT)等多种生物学行为。目前TRAP1蛋白与CRC关系的研究已初见报道[4-5],但其相关生物学功能仍不清楚。本研究旨在探讨TRAP1在CRC中的表达和对CRC细胞增殖、凋亡的影响,及其对PI3K/AKT信号通路的调节作用,为针对TRAP1蛋白设计抗癌药物提供理论和实验依据。
1 材料与方法
1.1 主要材料 (1)标本:选取2018年在南方医科大学南方医院进行手术治疗的6 例CRC 患者的癌及癌旁配对黏膜组织,所有患者手术前均未接受过放化疗或靶向治疗。所有标本在离体后均经预冷的PBS 洗涤干净,液氮迅速冷冻后置于-80 ℃保存。(2)细胞及主要试剂:人结直肠癌细胞株LOVO、HT29、HCT116、RKO、SW480 及正常结肠永生化上皮细胞NCM460 均由南方医科大学病理实验室提供。胎牛血清和RPMI-1640 购自美国 GIBCO 公司,TRAP1(兔多抗)、GAPDH(鼠单抗)、CyclinD1(兔多抗)、辣根过氧化物酶标记的山羊抗兔IgG 二抗、辣根过氧化物酶标记的山羊抗鼠IgG二抗购于Proteintech公司,Cleaved-casp3(兔多抗)、casp3(兔多抗)购自Affinity公司,p-PI3K(兔单抗)、PI3K(兔单抗)、p-AKT(兔多抗)、AKT(兔多抗)抗体购自Cell Signaling Technology 公司;LipofectamineTM3000 购自 Life Technologies,CCK8 试剂盒购自北京全式金生物技术有限公司,细胞周期及Annexin V-FITC/PI 双染细胞凋亡检测试剂盒购自南京凯基生物科技发展有限公司。
1.2 方法
1.2.1 通过Oncomine 数据库分析TRAP1 表达 打开Oncomine 数据库(https://www.oncomine.org/),选择分析类型为Cancervs.Normal Analysis,肿瘤类别(Cancer Type)选择Colorectal Cancer进行分析,设置P<0.05为有统计学意义。
1.2.2 细胞转染 取对数生长期的SW480细胞,以1×106个/孔接种于6 孔板中,待细胞密度为30%~50%时采用Lipofectamine 3000分别转染对照序列NC和TRAP1的干扰序列,操作严格按照Lipofectamine 3000 转染试剂盒说明书进行。TRAP1 干扰序列购自苏州吉玛公司,si-1 引物:上游5´-CGGUCCCUGUACUCAGAAATT-3´ ,下 游 5´-UUUCUGAGUACAGGGACCGGG-3´;si-2 引物:上游5´-GCUACACCCUGCACUAUAATT-3´,下 游 5´-UUAUAGUGCAGGGUGUAGCGG-3´;si-3 引物:上游 5´-CCTTCCTGGATGCTCTGCATT-3´,下游5´-TGCAGAGCATCCAGGAAGGCC-3´。
1.2.3 Western blot 检测TRAP1 蛋白对细胞周期相关蛋白、凋亡相关蛋白及PI3K/AKT通路的影响 提取组织和细胞全蛋白,定量后用10%SDS-PAGE 凝胶对蛋白进行电泳分离,湿法转印至PVDF膜上,将膜放入5%牛奶,配摇床缓慢摇动封闭1 h,加入稀释后的一抗TRAP1(1∶1 000)、CyclinD1(1∶1 000)、Cleaved-Casp3(1∶1 000)、Casp3(1∶1 000)、p-PI3K(1∶1 000)、PI3K(1∶1 000)、p-AKT(1∶1 000)、AKT(1∶1 000)、GAPDH(1∶1 000)4 ℃孵育过夜,次日PBST洗膜3次,加入辣根过氧化物酶标记的山羊抗兔IgG 二抗(1∶10 000),配摇床室温孵育1 h,PBST洗膜3次后ECL化学发光显色,并应用Image J 软件分析目标蛋白和内参蛋白灰度值,相对表达量=目标灰度值/内参灰度值。
1.2.4 CCK-8 法检测TRAP1 对CRC 细胞增殖的影响 将TRAP1的干扰片段及对照片段瞬时转染入SW480细胞,24 h后消化并计数,以1 000 个/孔的密度接种于96 孔板,分别于24、48、72、96、120 h将孔内培养基更换为含10%CCK-8试剂的培养基,37 ℃、5%CO2条件下孵育2 h,全自动酶标仪490 nm 处测定光密度(OD)值,并绘制细胞增殖曲线。每组细胞设置5个平行复孔,实验重复3次。
1.2.5 平板克隆实验检测TRAP1对CRC 细胞克隆形成能力的影响 将干扰TRAP1的SW480细胞及对照细胞计数后以200 个/孔种植于 6 孔板中,37 ℃、5%CO2条件下培养 2 周,甲醇固定15 min,PBS 洗 3 次,吉姆萨染色15 min,水洗后拍照计数克隆数目。
1.2.6 流式细胞术检测TRAP1对CRC 细胞周期的影响 将干扰TRAP1 的SW480 细胞及对照细胞消化后离心弃上清,预冷的PBS 洗涤2 次,预冷的75%乙醇固定1 h,离心弃上清加入25 μL PI染色液和10 μL RNase A,4 ℃避光反应30 min,利用流式细胞仪对各组细胞进行检测。
1.2.7 流式细胞术检测TRAP1对CRC 细胞凋亡的影响 将干扰TRAP1 的SW480 细胞及对照细胞用不含EDTA 的胰酶消化后1 000 r/min离心5 min,PBS洗涤3次。随后用100 μL的 Binding Buffer 重悬细胞,并加入 5 μL AnnexinV-APC 及 5 μL PI 染色液,混匀室温避光反应 15 min,再加入400 μL 的Binding Buffer混匀后上机检测。
1.3 统计学方法 采用SPSS 20.0 软件进行数据处理,所有实验均独立重复3次,计量资料用均数±标准差()表示,两样本均数比较采用t检验,多组间的均数比较采用单因素方差分析,组间多重比较采用Dunnett-t检验。CCK8 结果采用析因分析,P<0.05为差异有统计学意义。
2 结果
2.1 TRAP1 在CRC 组织和细胞中的表达 通过Oncomine 数据库分析,在Notterman 数据库中,正常结直肠组织TRAP1 比结直肠癌组织中升高(n=18,Fold=3.408,P<0.01)。Skrzypczak 数据库中分析发现TRAP1 在结直肠癌组织中的表达比正常肠黏膜组织高(n正常=24,n肿瘤=45,Fold=2.014,P<0.01)。Western blot 显示,6 对 CRC 组织中 TRAP1 的表达明显高于癌旁配对正常肠黏膜组织,见表1、图1A。在结直肠癌细胞LOVO、HT29、HCT116、RKO、SW480中TRAP1的表达水平(分别为0.81±0.02、1.21±0.04、1.55±0.04、1.89±0.04、2.00±0.03)也明显高于正常永生化结肠上皮细胞NCM460(0.45±0.02),差异有统计学意义(n=3,F=85.297,P<0.01),见图1B。
Tab.1 Expression levels of TRAP1 in CRC tissues and their paired paracancerous tissues表1 TRAP1在CRC组织及癌旁正常组织中的表达(n=3,)
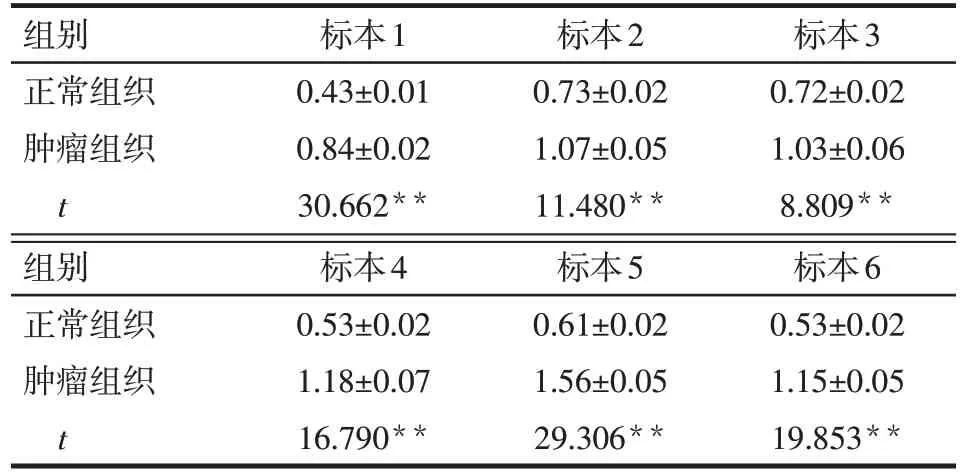
Tab.1 Expression levels of TRAP1 in CRC tissues and their paired paracancerous tissues表1 TRAP1在CRC组织及癌旁正常组织中的表达(n=3,)
**P<0.01
组别正常组织肿瘤组织t标本1 0.43±0.01 0.84±0.02 30.662**标本2 0.73±0.02 1.07±0.05 11.480**标本3 0.72±0.02 1.03±0.06 8.809**组别正常组织肿瘤组织t标本4 0.53±0.02 1.18±0.07 16.790**标本5 0.61±0.02 1.56±0.05 29.306**标本6 0.53±0.02 1.15±0.05 19.853**
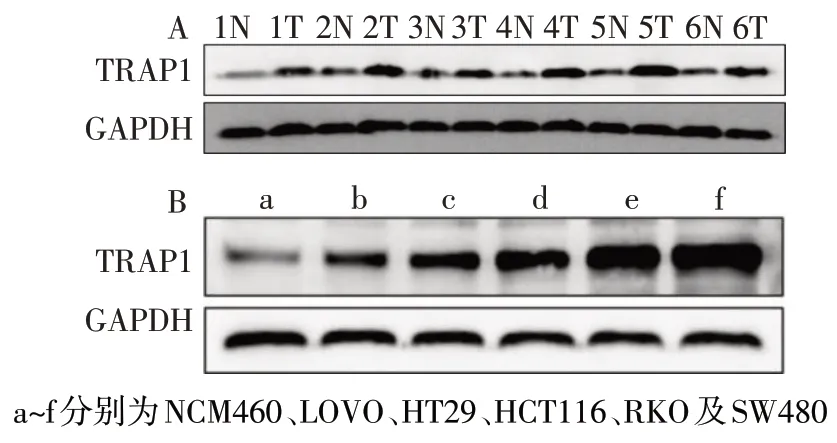
Fig.1 The expressions of TRAP1 in CRC tissues and cells图1 TRAP1在结直肠癌组织和细胞中的表达
2.2 TRAP1 对CRC 细胞增殖的影响 Western blot结果显示,TRAP1 的干扰序列均有效,NC、si-1、si-2、si-3 组干扰效率分别为 1.40±0.03、0.21±0.02、0.36±0.03、0.39±0.03,选取干扰效率最高的si-1组进行后续研究(n=3,F=1 010.014,P<0.05),见图 2。平板克隆实验显示,干扰TRAP1的表达(NC、si-1组分 别 为 81.00±3.61、25.67±2.08)可 以 明 显 降 低SW480 细胞的克隆形成能力(n=3,t=23.020,P<0.05),见图3A。CCK8结果显示干扰TRAP1的表达可以显著降低SW480 细胞的增殖能力(n=3,F组间=160.630,F时间=775.226,F交互=16.355,P<0.05),见图3B。

Fig.2 The efficiency of TRAP1 siRNAs detected by Western blot assay图2 TRAP1干扰效率的检测
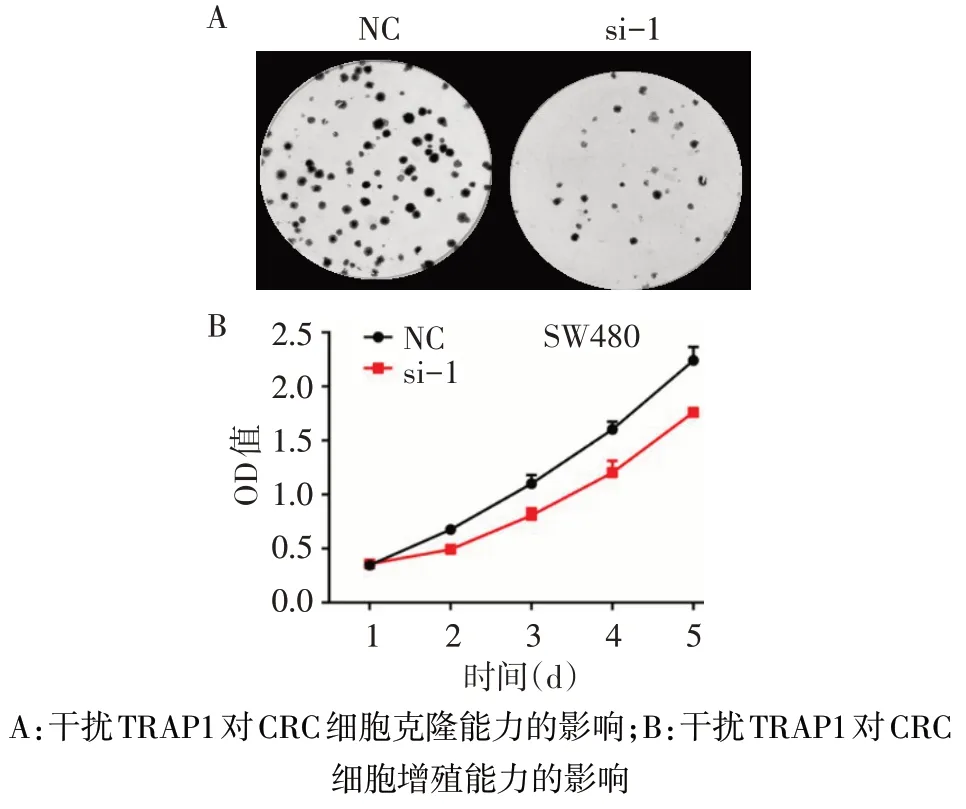
Fig.3 The effect of TRAP1 on the proliferation of CRC cells图3 TRAP1对CRC细胞增殖能力的影响
2.3 TRAP1 对CRC 细胞周期和凋亡的影响 流式细胞检测结果显示,干扰TRAP1 的表达后可以将SW480细胞周期阻滞在G0/G1期(P<0.01),见表2,图4A,并且增加细胞凋亡(NC组、si-1组细胞凋亡率分别为 5.80%±0.70%、9.73%±0.68%;n=3,t=6.977,P<0.01),见图4B。
Tab.2 The effect of TRAP1 on cell cycles表2 TRAP1对CRC细胞周期的影响 (%,)
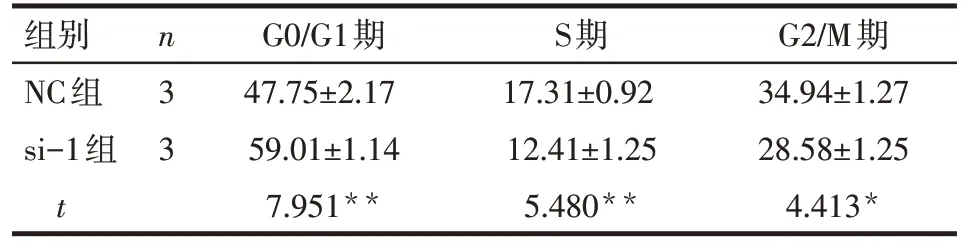
Tab.2 The effect of TRAP1 on cell cycles表2 TRAP1对CRC细胞周期的影响 (%,)
*P<0.05,**P<0.01
组别NC组si-1组t n33 G0/G1期47.75±2.17 59.01±1.14 7.951**S期17.31±0.92 12.41±1.25 5.480**G2/M期34.94±1.27 28.58±1.25 4.413*
2.4 TRAP1 对增殖、凋亡相关指标及PI3K/AKT 通路的影响 Western blot结果显示,干扰TRAP1的表达后,细胞周期相关蛋白CyclinD1 表达降低(P<0.01),见图5A,表3;凋亡相关蛋白Cleaved-Casp3表达增加(P<0.05),见图5B,表3;p-PI3K 和p-AKT表达降低(P<0.01),PI3K/AKT 通路被抑制,见表4,图6。
3 讨论

Fig.4 The effects of TRAP1 on cell cycles and cell apoptosis图4 TRAP1对CRC细胞周期和凋亡的影响

Fig.5 The effects of TRAP1 on CyclinD1 and Cleaved-caspase 3 protein expressions图5 TRAP1对CyclinD1和Cleaved-caspase 3蛋白表达的影响
Tab.3 The effect of TRAP1 on CyclinD1 and Cleavedcaspase 3 protein expressions表3 TRAP1对CyclinD1和Cleaved-caspase 3蛋白表达的影响 ()
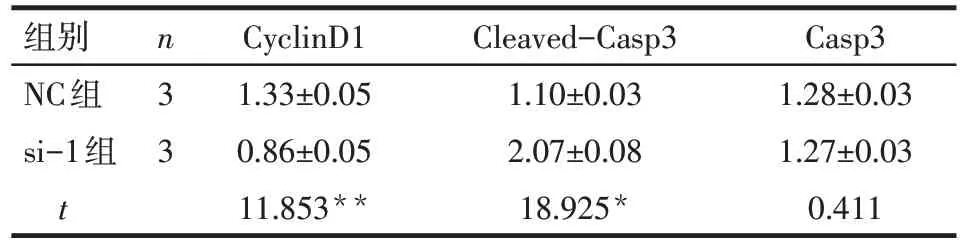
Tab.3 The effect of TRAP1 on CyclinD1 and Cleavedcaspase 3 protein expressions表3 TRAP1对CyclinD1和Cleaved-caspase 3蛋白表达的影响 ()
*P<0.05,**P<0.01
组别NC组si-1组t n33 CyclinD1 1.33±0.05 0.86±0.05 11.853**Cleaved-Casp3 1.10±0.03 2.07±0.08 18.925*Casp3 1.28±0.03 1.27±0.03 0.411
CRC 治疗是全世界面临的难题,前期笔者团队针对CRC 开展了相关基础研究,发现转化生长因子β(transforming growth factor β,TGFβ)是诱导 CRC EMT 和转移的重要因子,而二苯乙烯苷可通过抑制PI3K/AKT通路,拮抗TGFβ介导的肿瘤转移效应,因此二苯乙烯苷有望通过抑制PI3K/AKT 通路应用于CRC 治疗[6]。除了肿瘤转移,肿瘤细胞的恶性增殖和凋亡抵抗也是介导CRC 患者不良预后的重要原因。因此探索肿瘤增殖和凋亡相关基因,有望为治疗CRC提供新的方法。
为了进一步寻找CRC 肿瘤相关基因,本研究通过生物信息学分析成功筛选出TRAP1 是CRC 潜在的癌基因。回顾既往研究,TRAP1 在多种肿瘤中高表达。Ou等[7]发现TRAP1在食管癌中表达升高,与患者淋巴结转移密切相关,并可通过激活STAT3/MMP2 信号通路,促进食管癌细胞的迁移和侵袭。在甲状腺癌中,TRAP1 的表达随着恶性程度增加而增加,通过调控ERK信号通路促进甲状腺癌细胞的增殖、抑制凋亡[8]。值得注意的是,TRAP1除了扮演促癌基因角色外,也在部分肿瘤中低表达,从而发挥抑癌作用。Yin 等[9]研究证实 TRAP1 在胶质母细胞瘤中表达降低,并调控肿瘤细胞侵袭与凋亡。目前TRAP1 在 CRC 中的作用已初见报道,Pak 等[10]研究发现过表达TRAP1可能导致CRC细胞的局部侵袭,其表达与CRC侵袭深度和不良预后相关。Han等[11]通过免疫组化检测结直肠癌手术标本中的TRAP1和切除修复交叉互补基因1(ERCC1)的表达,发现TRAP1 与ERCC1 表达的高低可预测CRC 对奥沙利铂和5-氟尿嘧啶(5-Fu)的化疗敏感性。但目前TRAP1 在CRC 中作用的研究大部分处于基因表达水平,缺乏基础实验依据,其在CRC 中的表达和生物学功能仍需进一步挖掘。
Tab.4 The effect of TRAP1 on PI3K/AKT pathway of SW480 cells表4 SW480细胞中TRAP1对PI3K/AKT信号通路的影响 ()

Tab.4 The effect of TRAP1 on PI3K/AKT pathway of SW480 cells表4 SW480细胞中TRAP1对PI3K/AKT信号通路的影响 ()
**P<0.01
组别NC组si-1组t n33 p-PI3K 1.19±0.02 0.57±0.03 36.454**PI3K 0.18±0.02 0.43±0.02 0.690 p-AKT 1.14±0.01 0.72±0.01 57.277**AKT 0.45±0.01 0.45±0.02 0.702

Fig.6 The effect of TRAP1 on PI3K/AKT pathway图6 TRAP1对PI3K/AKT信号通路的影响
本研究多层次检测了TRAP1 的表达,发现TRAP1在CRC组织中的蛋白表达水平显著升高,同样,与NCM460细胞相比,TRAP1在CRC细胞中的表达也更高。文献报道TRAP1 可调控肿瘤细胞增殖和凋亡进程[12-13]。本研究也针对该生物学行为进行观察,在SW480 细胞中干扰TRAP1 后,肿瘤细胞的增殖能力和克隆形成能力明显减弱;流式细胞术检测发现干扰TRAP1后SW480细胞周期阻滞在G0/G1期,并且凋亡增加;同时,细胞周期相关蛋白CyclinD1 表达降低,而凋亡相关蛋白Cleaved-Casp3表达增加,说明TRAP1 可以促进CRC 细胞增殖、抑制CRC细胞凋亡,是CRC的癌基因。
肿瘤细胞信号传导与肿瘤细胞恶性生物学行为密切相关[14],其中,PI3K/AKT 信号通路是与肿瘤增殖和凋亡最相关的信号通路之一[15]。笔者前期针对PI3K/AKT 的通路及其潜在抑制药物已经开展了相关基础研究[6],另有研究也证实TRAP1抑制剂SNX-2112 可抑制AKT 通路及其下游核因子(NF)-κB 的活性[16]。本研究通过Western blot证实,干扰TRAP1后,CRC 细胞 PI3K 和 AKT 磷酸化水平显著降低,进而支持TRAP1 可正向调控PI3K/AKT 信号通路,因此推测其对CRC 细胞增殖和凋亡的影响可能是通过PI3K/AKT信号轴来发挥的。
综上,本研究证实TRAP1 是CRC 的癌基因,在CRC 中高表达,可促进CRC 细胞增殖而抑制其凋亡,其潜在机制与TRAP1 激活PI3K/AKT 通路相关,为针对TRAP1 设计PI3K/AKT 通路抑制剂和抗肿瘤药物提供了实验证据。
