SIRT5对高糖环境下结肠癌细胞增殖、凋亡、迁移的影响及机制探讨
2020-09-22贺帅岳淑芬周蕾齐琦
贺帅,岳淑芬,周蕾,齐琦
结肠癌是最常见的恶性肿瘤之一,其发病率和病死率呈逐年升高的趋势,大多数结肠癌患者确诊时已处于中晚期,预后较差[1]。糖尿病在结肠癌中常见,并影响其发展及预后[2-3]。糖代谢异常(糖代谢重编程)在结肠癌的发生、发展中发挥重要作用;而机体的代谢改变可能会驱动癌症代谢重编程,糖尿病会加剧这种情况;有氧糖酵解对糖代谢异常具有重要意义[4-5]。Sirtuin5(SIRT5)是Sirtuins 家族中独特的成员,其去丙二酰化及去琥珀酰化等蛋白修饰作用涉及糖酵解过程中关键酶并可增强糖酵解,而糖酵解与肿瘤发生发展有关[6]。SIRT5 是否可通过影响糖代谢关键酶己糖激酶-2(HK2)及哺乳动物雷帕霉素靶蛋白(mTOR)/缺氧诱导因子(HIF)-1α/M2型丙酮酸激酶(PKM2)信号通路来促进糖代谢并参与高糖环境下结肠癌发展的研究少见。本研究利用SIRT5-RNAi 慢病毒靶向沉默人结肠癌Lovo 细胞,以检测其对高糖环境下细胞增殖、凋亡、迁移的影响,并进一步检测SIRT5 对糖酵解关键酶HK2 及mTOR/HIF-1α/PKM2 信号通路的影响,探讨其与高糖环境下结肠癌发生、发展的关系及可能机制。
1 材料与方法
1.1 材料 人结肠癌HT-29、SW620、SW480、Lovo细胞系购自中科院上海细胞库;兔多克隆抗体SIRT5、mTOR、HIF-1α、PKM2、HK2、GAPDH 及HRP-标记的羊抗兔IgG 购自北京博奥森公司;RIPA 裂解液购自上海鼎国生物技术有限公司;Trizol 购自 promega 公司;RPMI 1640 及 DMEM 培养液购自Ausbian公司;胎牛血清(fetal bovine serum,FBS)购自Corning公司;凋亡试剂盒购自eBioscience公司;MTT购自Genview公司;BCA Protein Assay Kit 及RIPA 裂解液购自碧云天生物技术 有 限 公 司 ;PVDF 膜 购 自 millipore 公 司 ;Celigo 购 自Nexcelom公司;PCR引物由上海吉凯基因有限公司合成;MMLV 及 PCR 试剂盒购自 promega 公司;PCR 仪购自 Roche 公司;对照RNAi 慢病毒及SIRT5-RNAi 慢病毒购自上海吉凯基因有限公司。
1.2 方法
1.2.1 细胞培养与选择、慢病毒转染和分组 复苏人结肠癌细胞系(SW620、Lovo、HT-29 及 SW480 细胞),置于 RPMI 1640 培养液(SW620、Lovo、SW480 细胞)及 DMEM 培养液(HT-29细胞)中(含10%FBS)培养、传代,至细胞状态稳定时行前期探索研究,结果显示Lovo 细胞SIRT5 表达量最高,用此做后续实验。分别用普通培养基(葡萄糖含量2 000 mg/L)及高糖培养基(葡萄糖含量4 500 mg/L)培养SIRT5高表达的Lovo 细胞,进行慢病毒转染实验,高糖培养基及普通培养基细胞各分为3 组:空白对照组(MOCK 组,无干预)、阴性对照组(NC 组,利用对照RNAi 慢病毒转染)和SIRT5-RNAi 组(KD组,采用SIRT5-RNAi慢病毒转染)。
1.2.2 MTT 法检测SIRT5 瞬时沉默后Lovo 细胞增殖能力的改变 慢病毒转染实验分组同1.2.1;调整细胞浓度为1×104个/mL,加入96孔培养板中,每孔2 000 个细胞,每组设置3个重复;从铺板后次日开始,培养终止前4 h每孔加20 μL MTT液(5 g/L),分别于1、2、3、4、5 d去除培养基,每孔加150 μL二甲基亚砜(DMSO),振荡器振荡2~5 min,酶联免疫检测仪测定490 nm波长各孔光密度(OD)值,确定细胞活性,设调零孔(完全培养基+MTT+DMSO)。
1.2.3 AnnexinⅤ法检测SIRT5 瞬时沉默后Lovo 细胞的凋亡率 慢病毒转染分组同1.2.1,转染后72 h 待细胞融合度为85%左右时,收集各组细胞,200 μL结合缓冲液重悬细胞,加入10 μL Annexin V-APC 染色,室温避光10~15 min。流式细胞仪检测凋亡情况。使用流式细胞仪分析软件guava InCyte分析凋亡率。
1.2.4 Celigo 划痕实验检测SIRT5 沉默后Lovo 细胞的迁移率 参照文献[2],选择高糖环境(高糖培养基)中SIRT5 对细胞迁移能力的影响。慢病毒转染分组同1.2.1高糖培养基分组,以50 000个细胞/孔的密度接种到96孔板中,次日细胞融合度为90%以上时用划痕仪对96孔板轻推形成划痕。磷酸盐缓冲液(PBS)轻轻冲洗2 次,添加1%FBS 血清培养基并即刻(0 h)刷板,继续在37 ℃,5%CO2的培养箱中培养,在24 h用Celigo 清扫平板,使用Celigo 分析迁移面积,计算迁移率=[(S3+S4)-(S1+S2)]/[1-(S1+S2)]×100%,1-(S1+S2)代表0 h划痕区面积,(S3+S4)-(S1+S2)代表划痕区24 h减少的面积。
1.2.5 实时荧光定量PCR(qPCR)检测高糖环境下结肠癌Lovo细胞系SIRT5、mTOR、HIF-1α、PKM2及HK2mRNA的表达情况 复苏培养高糖环境下各组Lovo 细胞,分组同1.2.1高糖培养基分组,待细胞融合度达90%时,Trizol 裂解,提取总RNA,测定浓度,以1 μg RNA为模板,选取反转录引物,利用反转录酶合成cDNA,1∶100 稀释合成的cDNA,取 1 μL cDNA组成12 μL反应体系(SYBR Premix EX taq 6.0 μL,上游引物(5 μmol/L)0.5 μL,下游引物(5 μmol/L)0.5 μL,cDNA 1.0 μL,无核酸酶水 4.0 μL),qPCR检测高糖环境下各组Lovo细胞SIRT5、mTOR、HIF-1α、PKM2及HK2mRNA 的相对含量,并制作熔解曲线,GAPDH为内参,引物序列见表1。反应过程:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 30 s,40 个循环;95 ℃ 15 s,60 ℃ 1 h ,95 ℃ 15 s。采用相对定量的 2-ΔΔCt法进行数据分析。

Tab.1 Primer sequence for qPCR表1 qPCR所用引物序列
1.2.6 Western blot 检测高糖环境下结肠癌Lovo 细胞系SIRT5、mTOR、HIF-1α、PKM2及HK2蛋白的表达情况 蛋白裂解液提取各组结肠癌细胞蛋白,分组同1.2.1高糖培养基分组。每个上样孔加50 μg 蛋白,行10%的聚丙烯酰胺凝胶电泳(SDS-PAGE),将蛋白转印至PVDF 膜,5%脱脂乳封闭,4 ℃过夜,分别加入内参GAPDH 抗体及SIRT5、mTOR、HIF-1α、PKM2、HK2 兔多克隆抗体,37 ℃温育1 h。加HRP-标记的羊抗兔IgG(1∶5 000),37 ℃孵育1 h,化学发光试剂盒显色,凝胶成像系统采集图像,蛋白质条带经Gel-Pro Analyzer version 4.5软件进行灰度值测量,用GAPDH条带的灰度值对测量结果进行校正。
1.3 统计学方法 采用SPSS 17.0 统计软件进行统计学分析。符合正态分布的计量资料以()表示,多组间比较采用单因素方差分析,组间多重比较采用LSD-t法;计数资料用例(%)表示。以P<0.05为差异有统计学意义。
2 结果
2.1 不同培养条件下各组Lovo 细胞增殖情况比较 普通培养基中,SIRT5-RNAi慢病毒载体靶向沉默后1~4 d 对细胞活性无明显影响,5 d 时KD 组较NC组、MOCK组OD值降低(P<0.05),但后2组间差异无统计学意义;高糖培养基中,3~5 d 时KD 组较NC 组、MOCK 组 OD 值均降低,4 d 时 NC 组较 MOCK组OD值亦降低(P<0.05),见表2。
2.2 不同培养条件下各组Lovo 细胞凋亡率的比较 普通培养基中,3组细胞凋亡率无明显变化;高糖培养基中,KD组较NC组、MOCK组凋亡率明显增加(P<0.05),但后2 组间差异无统计学意义,见图1、表3。
2.3 高糖环境下各组Lovo 细胞迁移率比较 高糖培养基中,MOCK组、NC组及KD组的细胞迁移率分别 为 55.03%±1.99%、54.13%±1.84% 及 44.18%±1.84%(F=38.792,P<0.01),KD 组较 NC 组、MOCK组迁移率降低(P<0.05),但后2 组间差异无统计学意义,见图2。
2.4 高糖环境下各组Lovo 细胞中SIRT5、mTOR、HIF-1α、PKM2及HK2mRNA的表达水平 除NC组HIF-1α低于 MOCK 组外,NC 组、MOCK 组及 KD 组SIRT5、mTOR、PKM2及HK2mRNA 的表达水平依次降低(P<0.01),见表4。
2.5 高糖环境下各组Lovo 细胞中SIRT5、mTOR、HIF-1α、PKM2及HK2蛋白的表达水平 MOCK组、NC 组及 KD 组 SIRT5、mTOR 及 HIF-1α 依次降低,KD 组较 MOCK 组、NC 组 PKM2 及 HK2 的蛋白表达水平降低(P<0.01),但后2 组间PKM2 及HK2 的蛋白表达水平差异无统计学意义,见图3、表5。
Tab.2 Comparison of Lovo cell proliferation ability between three groups表2 各组Lovo细胞增殖能力比较 (n=3,OD值,)

Tab.2 Comparison of Lovo cell proliferation ability between three groups表2 各组Lovo细胞增殖能力比较 (n=3,OD值,)
*P<0.05,**P<0.01;a与MOCK组比较,b与NC组比较,P<0.05
组别MOCK组NC组KD组F普通培养基1 d 0.171±0.010 0.168±0.009 0.171±0.004 0.166 2 d 0.223±0.007 0.217±0.004 0.223±0.011 0.512 3 d 0.271±0.013 0.270±0.012 0.265±0.014 0.186 4 d 0.343±0.014 0.342±0.013 0.331±0.013 0.739 5 d 0.623±0.010 0.614±0.011 0.586±0.019ab 5.920*组别MOCK组NC组KD组F高糖培养基1 d 0.185±0.011 0.183±0.005 0.181±0.004 0.229 2 d 0.273±0.011 0.269±0.007 0.243±0.017a 4.709*3 d 0.351±0.012 0.345±0.009 0.251±0.006ab 111.213**4 d 0.491±0.010 0.442±0.007a 0.289±0.015ab 266.024**5 d 0.653±0.015 0.635±0.014 0.439±0.011ab 250.294**

Fig.1 The apoptosis of Lovo cells detected by AnnexinⅤafter intervention图1 AnnexinⅤ法检测干预后各组Lovo细胞的凋亡率

Fig.2 The migration ability of Lovo cells after intervention detected by scratch test图2 划痕实验检测干预后各组Lovo细胞的迁移能力
Tab.3 Comparison of apoptosis rates between three Lovo cell groups表3 各组Lovo细胞凋亡率比较(%,)
**P<0.01;a与MOCK组比较,b与NC组比较,P<0.05
组别MOCK组NC组KD组F n333普通培养基0.13±0.06 0.10±0.01 0.10±0.02 0.870高糖培养基0.63±0.06 0.50±0.10 1.43±0.06ab 137.600**

Fig.3 Expressions of SIRT5,PKM2 and HK2 protein in Lovo cells图3 各组Lovo细胞中SIRT5、PKM2及HK2蛋白的表达水平
Tab.4 Expression levels of SIRT5,mTOR,HIF-1α,PKM2 and HK2 mRNA in Lovo cells表4 各组Lovo细胞中SIRT5、mTOR、HIF-1α、PKM2及HK2 mRNA的表达水平 ()

Tab.4 Expression levels of SIRT5,mTOR,HIF-1α,PKM2 and HK2 mRNA in Lovo cells表4 各组Lovo细胞中SIRT5、mTOR、HIF-1α、PKM2及HK2 mRNA的表达水平 ()
**P<0.01;a与MOCK组比较,b 与NC组比较,P<0.05
组别MOCK组NC组KD组F HK2 0.848±0.020 0.953±0.014a 0.556±0.022ab 384.648**SIRT5 0.892±0.022 0.961±0.014a 0.315±0.023ab 955.638**mTOR 0.816±0.020 0.921±0.010a 0.526±0.020ab 385.755**HIF-1α 0.789±0.020 0.642±0.011a 0.319±0.027ab 466.180**PKM2 0.856±0.010 0.976±0.022a 0.588±0.019ab 331.001**
Tab.5 Expressions of SIRT5,mTOR,HIF-1α,PKM2 and HK2 protein in each Lovo cell group表5 各组Lovo细胞中SIRT5、mTOR、HIF-1α、PKM2及HK2蛋白的表达水平 ()
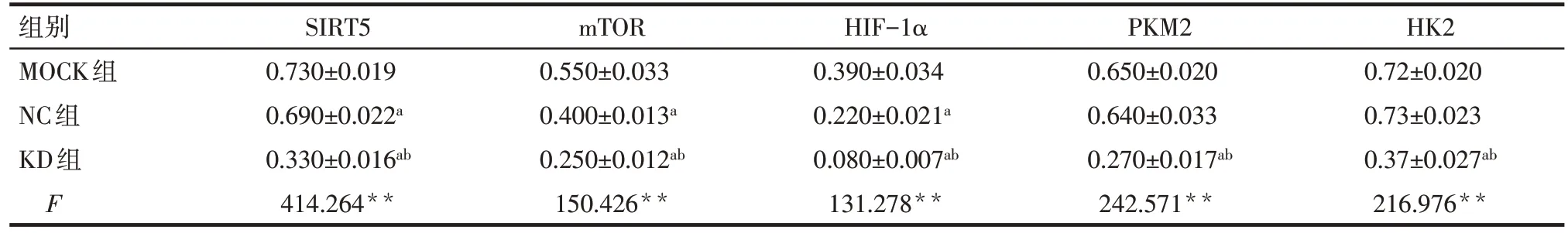
Tab.5 Expressions of SIRT5,mTOR,HIF-1α,PKM2 and HK2 protein in each Lovo cell group表5 各组Lovo细胞中SIRT5、mTOR、HIF-1α、PKM2及HK2蛋白的表达水平 ()
**P<0.01;a与MOCK组比较,b与NC组比较,P<0.05
组别MOCK组NC组KD组F HK2 0.72±0.020 0.73±0.023 0.37±0.027ab 216.976**SIRT5 0.730±0.019 0.690±0.022a 0.330±0.016ab 414.264**mTOR 0.550±0.033 0.400±0.013a 0.250±0.012ab 150.426**HIF-1α 0.390±0.034 0.220±0.021a 0.080±0.007ab 131.278**PKM2 0.650±0.020 0.640±0.033 0.270±0.017ab 242.571**
3 讨论
研究显示,结肠癌中伴发高血糖的总体病死率显著高于正常血糖者[3]。SIRT5是Sirtuins家族中独特的成员,具有NAD+依赖的去乙酰化、去丙二酰化、去琥珀酰化及去戊二酰化活性,与糖脂代谢关系密切[6-7]。已有研究显示,SIRT5 在胃癌[8]、乳腺癌[9]等恶性肿瘤细胞高表达,在肿瘤细胞的代谢重编程中发挥重要作用。本研究显示,普通培养基中,靶向沉默 SIRT5 后 1~4 d 对细胞活性无明显影响,5 d 时KD 组较 NC 组、MOCK 组 OD 值降低,但各组细胞凋亡率差异无统计学意义;高糖培养基中,靶向沉默后3~5 d时KD组较NC组和MOCK组OD值、24 h时迁移率明显降低、凋亡率增加,提示与NC 组及MOCK组比较,KD组在普通培养基条件下第5天增殖才会降低,高糖培养基中沉默SIRT5 后次日细胞增殖水平即降低;高糖培养基中,KD 组较 NC 组、MOCK 组增殖、迁移能力明显降低,而凋亡率增高,证实了SIRT5可促进高糖环境下结肠癌的进展。
HK2 及PKM2 是糖酵解过程中的关键酶,肿瘤细胞有氧糖酵解活跃过程中其表达水平增高[4]。PKM2翻译后修饰可促进糖酵解,且PKM2高表达能增强Warburg 效应,促进肿瘤发生[10]。已有研究显示,SIRT5 介导的去琥珀酰化作用可调控糖酵解关键酶PKM2 的活性,进而增强糖酵解能力[10]。笔者前期研究结果显示,SIRT5、PKM2 及HK2 在结肠癌中高表达,且高表达部位一致,三者之间有一定的相关性[11]。目前,对于SIRT5 是否可通过影响糖代谢关键酶HK2及PKM2表达来促进高糖环境下结肠癌发展还鲜见报道。本研究显示,KD 组与NC 组及MOCK 组比较,高糖环境中结肠癌细胞PKM2及HK2mRNA 及其蛋白表达水平均降低,表明高糖环境下SIRT5可能通过直接或间接的方式影响糖酵解关键酶PKM2 及HK2 表达水平,从而促进糖酵解并参与结肠癌的发生发展。
糖代谢异常所致的高血糖环境下,HIF 通过激活葡萄糖转运蛋白(glucose transporter,GLUT)及糖酵解基因的表达,可使肿瘤细胞摄入大量葡萄糖以加强糖酵解,使肿瘤细胞获得充足的腺苷三磷酸(ATP)[12],而活跃的糖酵解使HIF-1α 过表达,两者共同作用促进肿瘤细胞的增殖[5]。糖酵解产生的大量乳酸可改变肿瘤细胞微环境,有利于肿瘤细胞的侵袭。mTOR信号通路PI3K/AKt/mTOR 异常与肿瘤密切相关,该信号通路改变可促进糖摄取和糖酵解的过程[13]。mTOR 与其调节的下游因子Myc家族和HIFs 家族在肿瘤中处于活化状态且可共同作用,从而激活多种糖酵解过程中的关键酶,促进肿瘤的发生[14]。mTOR也可通过HIF-1α介导的PKM2基因转录来促进PKM2 的表达,促使肿瘤的发生,且PKM2的异常表达与多种肿瘤的转移呈正相关已得到证实[14]。本实验中,SIRT5-RNAi 慢病毒瞬时沉默SIRT5 后,与 NC 组及 MOCK 组比较,高糖环境中结肠癌细胞 mTOR、HIF-1α 及 PKM2 表达量均显著下降,再次证实SIRT5 可通过直接或间接的方式影响糖酵解,促进结肠癌细胞的增殖及迁移。
综上所述,SIRT5 可能通过促进高糖环境下糖酵解关键酶 HK2 表达及 mTOR/HIF-1α/PKM2 信号通路,以直接或间接方式促进糖酵解,影响结肠癌细胞增殖、凋亡及迁移,促进结肠癌的发展。因此,笔者认为SIRT5抑制剂可为结肠癌合并糖尿病的治疗提供新的研究方向。
