Tim-3调控巨噬细胞极化在类风湿性关节炎中的研究进展
2020-09-22钟玉梅陈洋罗小超周海燕
钟玉梅,陈洋,罗小超,周海燕
类风湿性关节炎(rheumatoid arthritis,RA)是以滑膜炎症为主要临床表现的慢性、难治性、自身免疫性疾病,目前药物治疗的效果欠佳,且该病有较高的致残率,严重影响了患者的生活质量[1]。T细胞免疫球蛋白黏蛋白分子-3(T cell immunoglobulin and mucin-domain- containing molecule-3,Tim-3)作为免疫系统共刺激抑制受体家族成员,是免疫调节的关键调控分子。在RA疾病进展中,Tim-3在局部免疫和全身免疫中均发挥作用[2-3]。同时,Tim-3 作为巨噬细胞极化信号通路的调控分子,其对巨噬细胞极化具有确切的影响[4-5]。本文就近年来Tim-3 调控巨噬细胞极化在RA中的研究进展进行综述,以增强对Tim-3/巨噬细胞极化在RA 发病机制中的认识,也为RA的研究提供新的思路和治疗靶点。
1 Tim-3的研究进展
Tim-3 是近年新发现的 T 细胞表面分子[6],是 T细胞免疫球蛋白黏蛋白(Tim)家族的成员,主要是由先天性和适应性免疫细胞分泌的一组Ⅰ型跨膜蛋白[7-9]。Tim-3广泛表达于T细胞、巨噬细胞、自然杀伤细胞等细胞表面,并且与其配体结合发挥免疫调节功能。目前越来越多的研究表明,Tim-3与RA易感性密切相关,可促进多种细胞内信号传导和免疫反应,调节T细胞分化,在对抗炎症和自身免疫性疾病中起到了重要作用[10-12]。
1.1 Tim-3 及其配体的生物学特性 McIntire 等[13]在小鼠11 号染色体Tapr基因座位上发现了Tim 基因家族,其所在的染色体区与自身免疫性和变态反应性疾病发生相关。Tim-3分子结构包括3部分:胞外段、跨膜段、胞内段。胞外段由IgV区及含31%丝氨酸和苏氨酸残基的黏蛋白样结构组成,含有4个N连锁的糖基化位点和5 个O 连锁的糖基化位点;胞内段含有6个酪氨酸残基,其中1个酪氨酸残基是酪氨酸磷酸化基序(RSENIY)中的一部分,而RSENIY与Tim-3下游信号传导有关。人和鼠的Tim-3总氨基酸有63%的同源性,两者胞内段有77%的氨基酸同源。
半乳糖凝集素-9(galectin-9,Gal-9)最早被认为是Tim-3的配体,它在体内分布非常广泛,尤其是免疫细胞上[14];主要参与细胞聚集、黏附、分化、凋亡、调节肿瘤转移和炎症反应等[15]。Gal-9 含有碳水化合物识别区,通过与Tim-3的IgV结构域中的碳水化合物结构相结合进而发挥生物学功能。Tim-3/Gal-9 信号通路在肿瘤免疫[16]、抗感染免疫[17]和移植免疫[18]等方面发挥着重要的作用。
1.2 Tim-3 与免疫性疾病 Tim-3 作为负性免疫调节共刺激分子,一方面参与调控免疫平衡,维持对自身抗原的免疫耐受,确保完成免疫应答,避免自身免疫性疾病的发生;另一方面通过调控外周组织中免疫应答的持续性和强度,从而避免过度免疫造成的机体自我损伤[3]。研究发现,在辅助性T 细胞1(Th1)介导的实验性自身免疫性脑脊髓炎中,阻断Tim-3 可加速疾病的发作,导致小鼠病情恶化[6]。Liu等[19]发现,Tim-3的基因多态性可增加自身免疫性疾病的发病风险。刘叶等[20]发现,Tim-3 抑制能有效调节支气管哮喘患者Th17 和调节性T 细胞(Treg)的平衡,减轻患者的气道炎症。在对免疫性血小板减少症患者的研究中发现,Tim-3 的表达水平明显升高,且与干扰素(IFN)-γ、血小板水平呈正相关[21]。Tim-3基因敲除后,T细胞分泌肿瘤坏死因子(TNF)-α、IFN-γ的水平显著增高,体外杀伤胃癌AGS-EBV 细胞的能力也明显增强[22]。另有研究发现,单核细胞/巨噬细胞表达的Tim-3 可能是胃癌进展的重要机制[23]。
2 巨噬细胞M1/M2 极化信号通路失衡与RA 的关系
巨噬细胞浸润是RA 病理过程中的一个突出特征,而巨噬细胞又是固有免疫和适应性免疫的重要组成部分[24-26]。当受到不同因素刺激时,巨噬细胞可极化成为功能相反的2种表型:M1型(促炎型)和M2型(抗炎型)。M1型可导致促炎细胞因子炎症介质产生,包括TNF-α、白细胞介素(IL)-1β、IL-6、IL-12 和单核细胞趋化蛋白(MCP)-1;而极化为M2 型时产生精氨酸酶1(Arg1)、IL-10、血管内皮生长因子(VEGF)等,这与免疫调节、抗炎、组织修复密切相关。在正常情况下,M1/M2 处于平衡状态,M2 分化充足,抑制M1 的分化[27-30],即所谓“正气存内,邪不可干”的状态。但M1 与M2 在一定条件下可以相互转化,并调节机体炎症反应应答。研究发现,RA 中存在M1、M2表型极化的失衡[31-32]。在RA疾病发生发展过程中,多种因素会打破巨噬细胞M1/M2 型的动态平衡,引起数量和比例失衡,导致M1 型促炎巨噬细胞不断增多,从而加剧炎症反应[33],邪实日益严重。因此,有效干预巨噬细胞M1 型转为M2 型,使M1/M2 恢复平衡状态,有利于促进炎症消退及组织修复,正气足则邪自安。
3 Tim-3与RA
3.1 Tim-3 的免疫调控与RA 发病的关系 研究发现,RA 患者外周血及滑膜液中CD4+和CD8+T 细胞表面Tim-3 的表达均较健康人明显升高,且Tim-3水平与病情的严重程度呈负相关[34]。RA 发病过程中,位于CD4+和CD8+T 细胞表面的Tim-3 起着负性调节免疫功能的作用,抑制T 细胞产生IFN-γ 等促炎因子,促进T 细胞生成IL-4 等抑炎因子。Tim-3作为免疫系统的关键调节者,是免疫炎症的纽带,也是抑制RA炎症反应的重要共刺激因子,已成为治疗RA的一个关键突破口。
3.2 Tim-3是调节巨噬细胞M1/M2极化信号通路的诱导器 Tim-3信号传导对巨噬细胞炎症因子表达和极化具有确切的影响,Tim-3高表达于M2型巨噬细胞,可促进巨噬细胞向M2 型极化并抑制M1 型极化,从而上调巨噬细胞中抗炎因子的表达并抑制促炎因子的表达;抑制Tim-3的表达可有效促进M1型巨噬细胞极化,抑制M2型巨噬细胞极化[35-36]。实际上Tim-3 对巨噬细胞极化的调控涉及2 部分:一种是通过接头蛋白直接调控,Tim-3与其配体Gal-9结合增强Tim-3 与信号转导及转录激活因子1(STAT1)之间的结合,再通过STAT1/miR-155/细胞因子信号传导抑制因子1(SOCS1)信号轴发挥对巨噬细胞极化的调控;另一种是与Gal-9 结合发挥Tim-3/Gal-9 信号通路对T 细胞免疫发挥抑制或促进的调节作用,通过不同免疫反应产生的产物如IFN- γ 或 IL-4 诱 导 巨 噬 细 胞 向 M1 或 M2 型极化[37-38]。
此外,也有文献报道Tim-3 信号可以促进β 干扰素TIR结构域衔接蛋白(TRIF)和干扰素调控因子3(IRF3)水平,调节巨噬细胞M1极化[39]。目前已证实在葡聚糖硫酸钠(DSS)诱导的结肠炎小鼠模型中,Tim-3抑制了M1型巨噬细胞的极化和IRF3的磷酸化水平,IRF3 是调节巨噬细胞极化的Toll 样受体4(TLR-4)下游转录因子[40],但目前对该通路的研究还不够深入。
3.2.1 Tim-3 直接调控巨噬细胞极化 STAT1 是Tim-3 直接调控巨噬细胞极化的胞内关键接头蛋白。研究发现,Tim-3 通过其细胞内尾部的残基Y256 和 Y263 直 接 结 合 STAT1 并 抑 制 STAT1/miR-155/SOCS1 信号轴而极化巨噬细胞[37]。在该途径中,Gal-9与Tim-3的结合增强了Tim-3与STAT1之间的结合,STAT1 在miR-155 的上游起作用并促进miR-155 转 录 ,SOCS1 参 与 Tim-3/STAT1/miR-155下游的信号级联并介导巨噬细胞最后极化。Tim-3通过磷酸化残基Y256和Y263与Janus激酶(JAK)竞争结合STAT1,然后抑制STAT1磷酸化;STAT1磷酸化受到抑制后使miR-155 表达降低,进而对SOCS1表达的抑制作用降低,随后IL-10 和Arg-1 表达增加,最终导致巨噬细胞向M2表型的极化。
3.2.2 Tim-3 间接调控巨噬细胞极化 Tim-3 还可通过调节T细胞产生的IFN-γ或IL-4等产物诱导巨噬细胞向M1型或M2型极化。IFN-γ 是Th1细胞分泌的主要细胞因子之一,Tim-3/Gal-9信号通路可抑制Th1 细胞产生IFN-γ,而IFN-γ 是巨噬细胞M1 型极化的诱导因子,促使巨噬细胞M1型极化[41]。IL-4是Th2 细胞产生的主要细胞因子之一,Tim-3/Gal-9信号通路可促进Th2 细胞产生IL-4,IL-4 同时也是巨噬细胞M2 型极化的诱导因子,可诱导巨噬细胞M2 型极化。M1 的激活途径由STAT1 介导。IFN-γ通过其受体 IFNR-1 和 IFNGR-2 募集 JAK1 和 JAK2衔接子,激活STAT1 通路和干扰素调节因子(IRF);IFN-γ 诱导的信号转导的主要介质是STAT1、JAK2和IRF1[42-43]。M2的激活途径主要由STAT6介导,首先IL-4 通过与其受体IL-4Rα 等结合,受体二聚化(Ⅱ型受体)后分别激活Janus 激酶JAK1/JAK3 或JAK1/JAK2,从而募集胰岛素受体底物(IRS)家族主要成员形成复合物;磷酸化的IRS 激活生长因子受体结合蛋白2(Grb2)和磷脂酰肌醇3-激酶(PI3K),进一步募集STAT6,并使STAT6发生酪氨酸磷酸化;磷酸化的STAT6形成二聚体,入核后,启动相关基因的转录,使巨噬细胞逐步向 M2 极化[38,44-46]。Tim-3通过IFN-γ/IL-4 调节巨噬细胞极化,最终产生作用不同的产物(图1)。
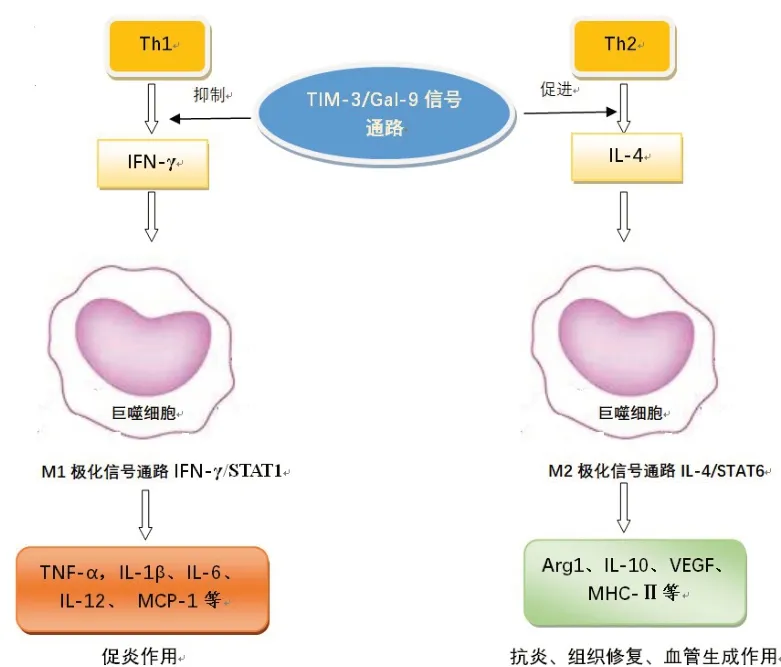
Fig.1 The flow chart of Tim-3 regulating the polarization of macrophage through IFN-γ/IL-4图1 Tim-3通过IFN-γ/IL-4调节巨噬细胞极流程图
4 小结
巨噬细胞作为固有免疫和适应性免疫的重要组成成分,其极化方向在RA病理过程中扮演了重要的角色。Tim-3 作为巨噬细胞极化信号通路的诱导器,其信号传导可促进M2 型巨噬细胞极化并抑制M1 型极化,从而调节巨噬细胞中炎症因子的表达,但其与RA 病理发展的相关性仍待进一步的研究。Tim-3 调控分子的研究不仅对深入揭示RA 的发病机制具有重要的指导作用,也为RA的临床治疗提供了新的靶点。
