妊娠期卵巢子宫内膜异位囊肿蜕膜化诊断研究
2020-09-21俞琤叶笑君翁轶南胡玲
俞琤 叶笑君 翁轶南 胡玲
子宫内膜异位症是一种良性病变,发病率可达7%~10%[1]。其中以卵巢子宫内膜异位囊肿(卵巢内异囊肿)最为常见,在非妊娠期通过超声图像结合临床症状诊断准确率较高;但在妊娠期间,绝大多数卵巢内异囊肿多随孕周增长而缩小[2],部分卵巢内异囊肿可能会发生形态上的变化,囊肿内壁出现圆形或类圆形、光滑、高度血管化的实性乳头状突起,这被称为“蜕膜化”。“蜕膜化”在卵巢内异囊肿中很少发生[3]。国内外报道也较少。Mascilini等[4]报道,联合了欧洲7个妇产科中心,在8年时间内仅发现了卵巢内异囊肿“蜕膜化”18例。由于临床医生及超声医生对卵巢内异囊肿“蜕膜化”的认识不足,常将其误诊为恶性或交界性肿瘤[5],从而导致不必要的手术治疗。本研究探讨妊娠期卵巢内异囊肿“蜕膜化”改变的超声诊断价值,旨在提高临床医生及超声医生对其的认识,从而减少误诊的发生,现将结果报道如下。
1 对象和方法
1.1 对象 收集2017年5月1日至2020年4月30日在杭州市妇产科医院经临床诊断为妊娠期卵巢内异囊肿“蜕膜化”的患者 11 例,年龄 22~43(30.6±5.8)岁,发现肿块时妊娠天数 46~78(56.8±9.2)d。
1.2 超声检查方法 使用彩色多普勒超声诊断仪(型号:Voluson E8,美国通用电气;型号:WS80A 2.0,韩国三星集团;型号:DC-8,迈瑞医疗),探头均采用腔内探头,频率5.0~9.0 MHz。检查时先确认宫内妊娠情况,注意胚胎大小以及存活与否,然后检查附件区包块,记录大小、乳头个数、最大乳头大小、乳头及囊壁的血供情况。
2 结果
2.1 超声检查结果及临床结局 所有患者囊内液透声均差,乳头个数1至6~7个不等,乳头内均可见少许血流信号。8例有卵巢内异囊肿病史,其他3例不详。11例患者中3例行手术切除治疗,术后病理诊断为卵巢内异囊肿。另8例于超声随诊过程中,乳头消失,其中3例经手术证实为卵巢内异囊肿;另5例妊娠后超声复诊发现囊肿形态学改变,结合临床资料,诊断为卵巢内异囊肿“蜕膜化”。具体情况见表1。
2.2 典型病例分析
2.2.1 患者1(表1病例1) 31岁,若干年前行超声检查提示卵巢囊肿,具体不详。此次停经70+d,未诉不适,超声检查提示宫内早孕,右卵巢一囊性为主混合回声(图1),大小约4.1 cm×2.7 cm×2.9 cm,内充满细小光点,囊壁可见数枚乳头样突起,大者约0.5 cm×0.4 cm,彩色多普勒血流显像(color Doppler flow imaging,CDFI)示乳头内可见少许血流信号。停经12+周继续复查右卵巢包块,提示混合回声光团(图2),大小及乳头情况变化不明显,CDFI示乳头内可见少许血流信号,阻力指数(RI)为 0.56。实验室检查:糖类抗原 125(CA125)109.1 U/ml(正常范围:<35 U/ml),人附睾蛋白4(HE4)16.19 pmol/L(正常范围:0~73.7 pmol/L)。因怀疑为卵巢交界性肿瘤,于妊娠13+周在本院行腹腔镜肿瘤摘除术。病理诊断:卵巢内异囊肿。术后恢复良好,于妊娠38+周行剖宫产术,母婴均状态良好。
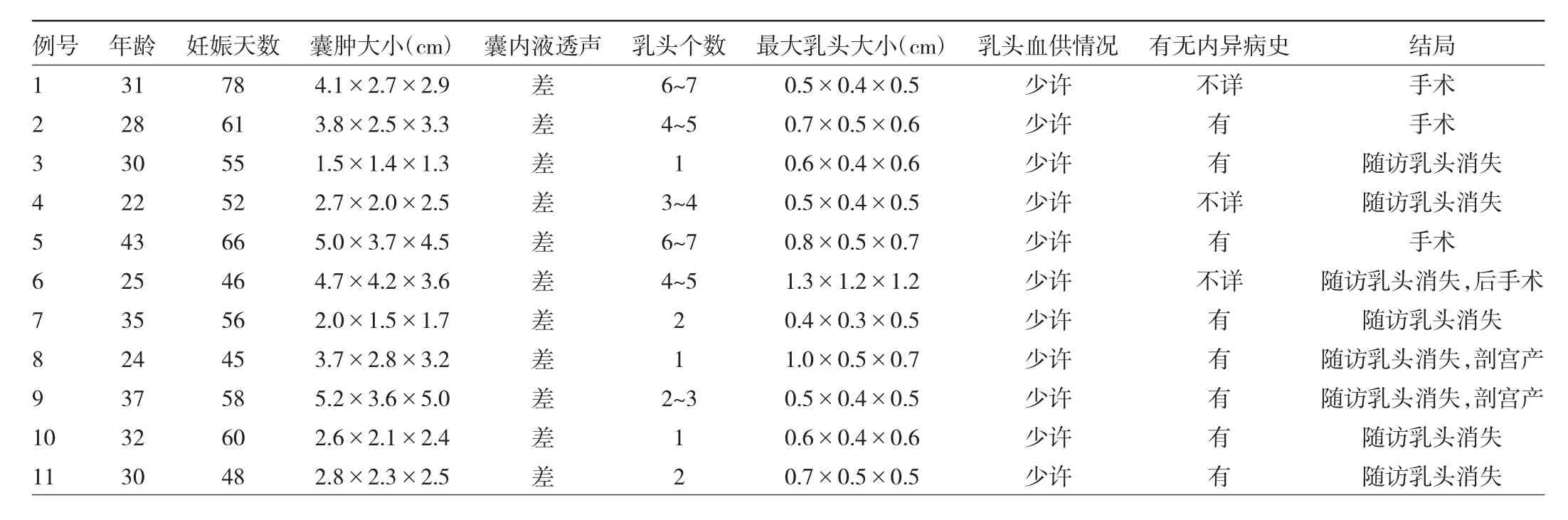
表1 11例患者超声检查结果及临床结局
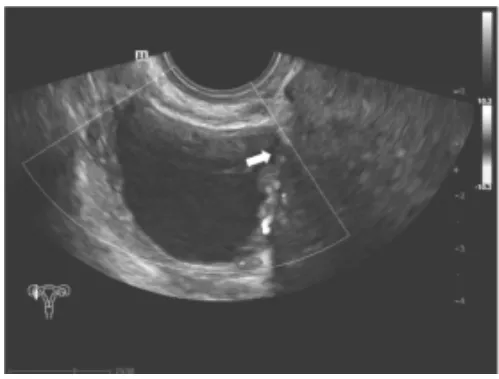
图1 停经70+d,右卵巢一囊性为主混合回声(箭头示囊内乳头状突起,并可及血流信号)

图2 停经12+周,右卵巢混合回声包块(箭头示囊内乳头状突起,并可及血流信号)

图3 停经50+d,右卵巢一囊性为主混合回声(箭头示囊壁乳头状突起)
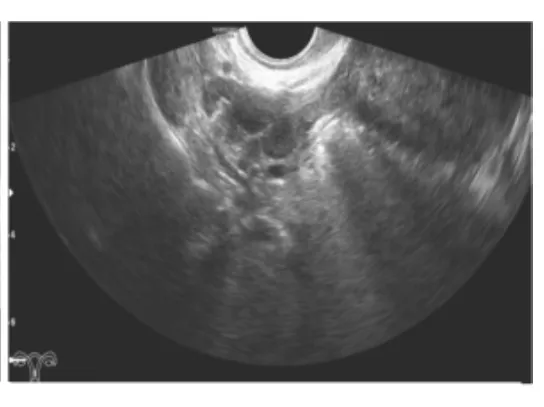
图4 人工流产术后1个月超声复查右卵巢囊性包块(未见乳头状突起)
2.2.2 患者2(表1病例3) 30岁,体检发现右卵巢内异囊肿数年,停经50+d来本院检查,超声提示宫内早孕,右卵巢内见大小约1.5 cm×1.4 cm×1.3 cm囊性回声,界清,内充满细小光点,囊壁可见大小约0.6 cm×0.4 cm×0.6 cm偏强回声乳头样突起(图3),CDFI示乳头内可见少许血流信号。患者要求行人工流产术,术后1个月超声复查提示右卵巢内见大小约1.6 cm×1.3 cm×1.0 cm囊性回声,界清,囊壁稍厚,内充满细小光点(图 4)。
2.2.3 患者3(表1病例6) 25岁,未曾进行过超声及其他妇科检查,此次因停经40+d行常规检查,超声提示宫内早孕,左侧卵巢内见一大小约4.7 cm×4.2 cm×3.6 cm的以囊性为主的混合回声,内见几处偏强回声乳头状突起,较明显一处范围1.3 cm×1.2 cm×1.2 cm,CDFI示乳头内可见少许血流信号(图5)。MR提示卵巢内异囊肿,囊腺瘤不排除。患者要求行人工流产术,于妊娠50+d行人工流产术,术后1个月复查左卵巢内可见一大小约3.8 cm×4.1 cm×3.0 cm的囊性暗区,界清,壁厚,内液透声差,充满细小光点(图6)。术后2个月患者行腹腔镜手术,摘除左侧卵巢内肿瘤。病理诊断:卵巢内异囊肿。
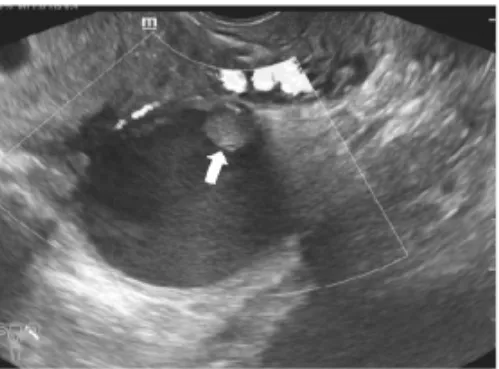
图5 停经40+d,左卵巢一囊性为主混合回声(箭头示囊壁乳头状突起,并可及血流信号)
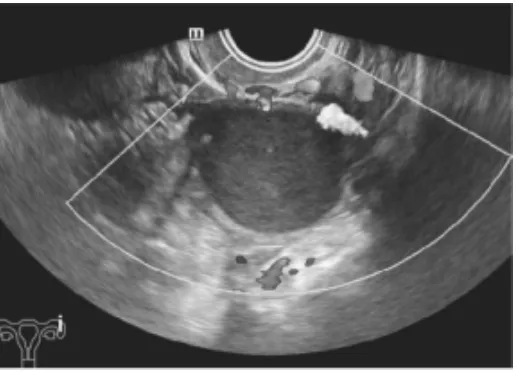
图6 人工流产术后1个月复查左卵巢囊性包块(未见乳头状突起)
3 讨论
在超声图像上卵巢内异囊肿“蜕膜化”易与卵巢交界性上皮肿瘤相混淆,两者相似部分为囊壁存在乳头状突起,囊内液透声较差,因实性成分均呈高度血管化,故CDFI显示实性突起内可探及低阻力血流信号。两者区别在于“蜕膜化”仅在妊娠情况下发生,两者声像图细微区别在于囊壁上实性突起的形态。妊娠状态下,囊壁上的乳头突起形态规则,轮廓清晰,表面光滑,则可能是卵巢内异囊肿。而囊壁乳头状突起轮廓形态不规则,部分类似菜花状则提示倾向交界性或恶性改变[6]。
除了超声声像图上的相似性,肿瘤指标上的不典型性也大大增加了误诊率。CA125和CA19-9是常用肿瘤指标,常被用于甄别卵巢良恶性病变。病例1 CA125有明显增高,但CA125在正常妊娠以及子宫内膜异位症中也存在增高现象,同时在上皮性卵巢肿瘤中也会出现增高[7],因此对于妊娠合并卵巢内异囊肿“蜕膜化”的患者意义并不是很大。研究表明HE4的表达与卵巢浆液性肿瘤的临床分期、组织学分级均有较大相关性,可为临床诊断和评估卵巢上皮细胞性肿瘤预后提供参考[8]。其在子宫内膜异位症中无特异性改变,因此HE4在“蜕膜化”患者中通常是不升高的。目前国际上仍未研究出一种针对子宫内膜异位症的特异性检测方法。
除上述两点误诊可能性外,超声医生的知识面及经验学在诊断过程中起到非常大的作用,对卵巢内异囊肿各类分型声像图的不熟悉以及对存在“蜕膜化”改变可能性的不了解都将导致误诊。结合患者痛经史,以及乳头状突起生成及快速消失均与妊娠与否密切相关,可以帮助明确其良性性质。因此对于无需继续妊娠的患者,可以通过超声随诊来评估良恶性。而对于需要继续妊娠的患者,妊娠期肿瘤处理的延误和治疗方案选择的不当,都可能导致肿瘤的进展,从而影响母儿的预后,因此对肿瘤的恶性风险作出评估至关重要[9]。在妊娠期间,虽然超声检查是首选的检查手段,但其在对卵巢内异囊肿“蜕膜化”改变的鉴别诊断上仍十分困难[10]。MRI上发现蜕膜化的表现与上皮性肿瘤中的乳头表现略有不同,可能有助于在手术前将卵巢内异囊肿“蜕膜化”与交界性或恶性改变区分开[11],其对妊娠早期发现的卵巢内异囊肿诊断率更高[12]。
除依靠单纯的检验检查外,孕前常规妇科超声检查必不可少,可为在妊娠状态下发现病变提供一部分诊断依据。11例患者中有8例孕前有卵巢内异囊肿病史,因此在诊断中超声医生结合超声声像图,倾向考虑为卵巢内异囊肿“蜕膜化”,随访观察后证实。而其余3例孕前检查信息不详,导致诊断难度增加,其中2例选择了手术,若孕前有足够的信息提示存在卵巢内异囊肿,可在妊娠期对其进行监测,减少不必要的手术风险。
综上所述,为了鉴别出卵巢内异囊肿“蜕膜化”改变,需要做到以下4点:(1)常规孕前检查,询问是否有痛经史;(2)需要经验丰富的超声专家根据病史、囊内壁情况、囊内液透声尤其是乳头的边界等超声特征给出最为可能的诊断;(3)特异的检验指标:如HE4指标;(4)在以上3点结合后仍无法明确的情况下,进一步结合MR检查。
