大黄鱼卵分离蛋白乳液的构筑及其体外消化规律
2020-09-17王笑涵吴海涛张志慧崔浩哲于佳卉
王笑涵,姜 卉,吴海涛,张志慧,崔浩哲,于佳卉,杨 贺,唐 越
(大连工业大学食品学院,国家海洋食品工程技术研究中心,辽宁 大连 116034)
脂溶性营养物质是指一类能够溶解在脂肪中,进而被人体摄入、消化、吸收的物质。常见的脂溶性营养物质包括维生素类、类胡萝卜素类、黄酮类、多酚类、多不饱和脂肪酸类等[1]。β-胡萝卜素是一种存在于黄色或橘色水果或蔬菜中的天然脂溶性活性物质,可作为天然色素、抗氧化剂、VA原等[2]。β-胡萝卜素猝灭单线态氧和灭活自由基的能力在预防特定的癌症、心血管疾病、黄斑退化症、白内障和提高免疫反应中可发挥较大作用[3]。然而,其存在水溶性差、易氧化降解、生物利用度低等缺点,这极大地限制了其在食品领域的应用。为了保护这类脂溶性活性物质,常见的方法是利用水包油型乳液体系对其进行包埋。水包油型乳液体系主要通过一种或多种乳化剂实现油相和水相的均化,乳化剂可吸附到油滴的表面,起到降低界面张力并阻止液滴将聚集的作用。Yuan Yuan等[4]采用高压均质法制备了稳定的基于Tween系列β-胡萝卜素纳米乳液。Silva等[5]利用分散-蒸发法制备β-胡萝卜素纳米颗粒,其稳定性好,不易分层。
在大多数乳液输送体系中,包埋活性成分的载体主要是植物蛋白。然而,以鱼类分离蛋白为载体构筑活性成分输送体系的研究还鲜有报道。大黄鱼(Pseudosciaena crocea)是中国海水养殖排名第一的鱼类,其中富含多种长链不饱和脂肪酸和蛋白质[6]。大黄鱼主要分布在我国东海和南海,鱼卵约占鱼体总质量的20%。然而,除了一些鱼卵加工成鱼子酱或饲料外,其余均未被利用,造成了极大的资源浪费[7]。目前,国内外有关大黄鱼卵的研究主要集中在鱼卵的孵化、化学组成分析等方面[11],大黄鱼卵蛋白资源开发利用的相关研究却鲜有报道。
活性成分的释放直接关系着乳液输送体系的生物学效价。近年来,体外胃肠道(gastrointestinal tract,GIT)模型作为研究乳液系统中活性成分释放特性的工具模型备受关注。GIT模型中脂质的消化是一种动态且复杂的现象,涉及许多不同的内源性和外源性分子。通常,口腔液中的黏蛋白可结合脂质表面的乳化剂并改变其表面性质和聚集状态[8]。胃液和小肠液内的胃蛋白酶和脂肪酶可水解脂质形成游离脂肪酸[9]。随后,脂质消化物与小肠液中的胆汁盐相互作用,将游离脂肪酸转运到小肠上皮细胞中,进而被人体吸收[10]。
本研究的目的为开发一种大黄鱼卵分离蛋白(Pseudosciaena crocearoe protein isolate,PRPI)乳化剂,用于构建β-胡萝卜素输送体系并提高β-胡萝卜素的生物利用度。通过GIT模型,研究在消化过程中乳液特性的变化、游离脂肪酸的释放情况、β-胡萝卜素的保留率以及生物利用度,为水产鱼类蛋白源乳化剂的脂溶性活性物质输送系统的建立提供理论支持。
1 材料与方法
1.1 材料与试剂
新鲜大黄鱼卵产自山东青岛;玉米油 山东西王食品有限公司;β-胡萝卜素、异硫氰酸荧光素(fluorescein isothiocyanate,FITC)、胃蛋白酶(250 U/mg)、猪脂肪酶(100~500 U/mg)、猪胆汁盐 美国Sigma-Aldrich公司;人工唾液 上海源叶生物科技有限责任公司;尼罗红 生工生物工程(上海)股份有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
PandaPLUS+2000高压均质机 意大利基伊埃尼鲁索尔维有限公司;Zetasizer3000HSA激光粒度仪 英国马尔文仪器公司;SP8激光共聚焦显微镜 德国徕卡有限公司;T18高速分散机、RT15恒温摇床 德国IKA仪器设备公司;UV2100紫外分光光度计 上海尤尼柯仪器有限公司;Infinite M200多功能酶标仪 中国济南来宝生物科技有限公司;DF-101S集热式恒温加热磁力搅拌器中国巩义市予华仪器有限责任公司;HH-3A三孔三温水浴锅 中国常州市中贝仪器有限公司;AB2004-N电子分析天平 瑞士梅特勒-托利多仪器有限公司。
1.3 方法
1.3.1 PRPI的提取
参照Osborne[12]的方法,并稍加修改。将20 g大黄鱼卵冻干粉与400 mL浓度为0.6 mol/L的NaCl溶液混合,并在室温下搅拌3 h。将得到的混合溶液11 000×g离心15 min,取上清液透析48 h。将蛋白质溶液在-40~-35 ℃真空冷冻干燥72 h,获得PRPI。
1.3.2 PRPI乳液的制备
参照Tang Yue等[13]乳液制备的方法,稍加改动。将PRPI分散在10 mmol/L、pH 8的磷酸盐缓冲液中以获得5 mg/mL的蛋白质溶液。将β-胡萝卜素加入玉米油中(5 mg/mL),在20 kHz、50 ℃条件下超声加热20 min,以获得含有β-胡萝卜素的油相。将蛋白质水相和油相以98∶2的体积比混合,并在10 000 r/min高速分散2 min得到PRPI粗乳液,将其在12 000 psi下高压均质循环5 次得到PRPI乳液。以Tween 20为乳化剂制备的乳液体系为对照组。向乳液中添加终质量分数0.02%的叠氮化钠以避免微生物的生长,并在室温下避光贮存。
1.3.3 PRPI乳液贮存稳定性的考察
将制备的PRPI乳液在室温下避光贮存0、1、4、7、14 d,采用激光粒度仪测定乳液的平均粒径、Zeta电位变化并观察乳液的外观形态。平均粒径测试前,所有样品先用去离子水或pH值为7的缓冲液稀释100 倍以防止多重光散射效应。测试参数水相溶液折射率为1.33,测试温度25 ℃,每个样品平行测定3 次,取平均值。
1.3.4 模拟消化道的构建
在Tangsrianugul等[14]的研究方法基础上稍加修改,构建体外模拟GIT模型,该模型由口腔、胃、小肠3 个阶段的模拟消化道组成,以此模拟乳液在体内的消化过程。在整个实验过程中,所有溶液和分散体的温度保持在37 ℃,采用1 mol/L NaOH或HCl溶液调节样品的pH值。
模拟口腔消化阶段:取在37 ℃条件下预热的20 mL乳液样品与20 mL人工唾液混合,调节pH值为6.8,并在37 ℃、100 r/min条件下恒温摇动10 min以模拟口腔消化。
模拟胃消化阶段:将2 g NaCl与7 mL HCl溶于1 L蒸馏水以制备模拟胃液。将预热至37 ℃的20 mL口腔消化后的液体与20 mL含胃蛋白酶(3.2 mg/mL)的模拟胃液混合,调节pH值至2.5。在37 ℃、100 r/min条件下恒温摇动2 h以模拟胃消化。
模拟小肠消化阶段:将5.5 g CaCl2与32.9 g NaCl溶于1 L蒸馏水中制备模拟小肠液[15]。取30 mL胃消化后的液体于100 mL烧杯中,于37 ℃恒温加热磁力搅拌器中以100 r/min匀速搅拌并调节pH值至7.0。向样品中加入1.5 mL的模拟小肠液和3.5 mL的胆汁盐(53.6 mg/mL),再次调节pH值至7.0。最后,向此体系中加入2.5 mL的脂肪酶溶液(24 mg/mL),通过在2 h内向样品中滴加0.02 mol/L的NaOH溶液使体系的pH值保持在7.0,以模拟小肠消化。
1.3.5 模拟体外消化过程中乳液特性的变化
1.3.5.1 模拟体外消化过程中PRPI乳液粒径及Zeta电位的变化
测定经模拟消化后各阶段2 种乳液体系平均粒径及Zeta电位的变化,测定方法同1.3.3节。
1.3.5.2 模拟体外消化过程中PRPI乳液微观结构的变化
根据Gumus等[16]报道的方法,采用激光共聚焦显微镜对经模拟消化各阶段的乳液体系的微观结构进行观察。采用FITC和尼罗红作为荧光探针分别标记鱼皮明胶以及玉米油,FITC的激发/发射波长为488 nm/535 nm,尼罗红的激发/发射波长为561 nm/670 nm。分别取初始乳液以及模拟消化后各阶段的样品50 μL,加入2 μL尼罗红溶液(10 mg/mL甲醇)和2 μL FITC溶液(10 mg/mL二甲基亚砜)并充分混匀。取5 μL染色后的样品置于载玻片中央,立即盖上盖玻片后,使用×63油镜的激光共聚焦显微镜观察各样品的微观形貌。
1.3.6 模拟体外消化过程中PRPI乳液β-胡萝卜素保留率的测定
根据Yuan Yuan等[17]的方法并稍加修改。将200 μL样品与2.5 mL乙醇-正己烷(2∶3,V/V)混合,振荡10 s后,收集上层正己烷相。再向剩余水相中加入1.5 mL正己烷,重复收集3 次,将收集物定容至10 mL。使用紫外分光光度计测定波长450 nm处溶液的吸光度,以β-胡萝卜素的质量浓度(X)为横坐标,吸光度(Y)为纵坐标绘制标准曲线,得到线性回归方程Y=0.078 2X+0.046 9,R2=0.999,按式(1)计算β-胡萝卜素保留率:

式中:C为经过不同消化阶段的乳液中β-胡萝卜素质量浓度/(mg/mL);C0为初始乳液β-胡萝卜素质量浓度/(mg/mL)。
1.3.7 模拟体外消化后β-胡萝卜素生物利用度的测定
取经过模拟小肠消化后液体,4 ℃、8 000 r/min离心30 min,上清液即为溶解后β-胡萝卜素的胶束部分。采用1.3.6节方法计算胶束部分的β-胡萝卜素含量,按式(2)计算生物利用度:
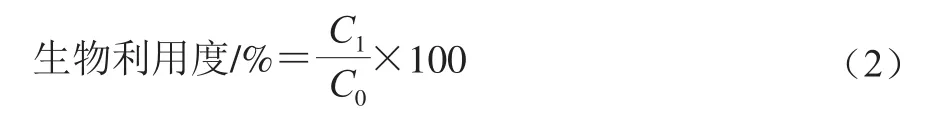
式中:C1为胶束部分β-胡萝卜素质量浓度/(mg/mL);C0为初始乳液β-胡萝卜素质量浓度/(mg/mL)。
1.4 数据处理
2 结果与分析
2.1 贮存时间对PRPI乳液稳定性的影响
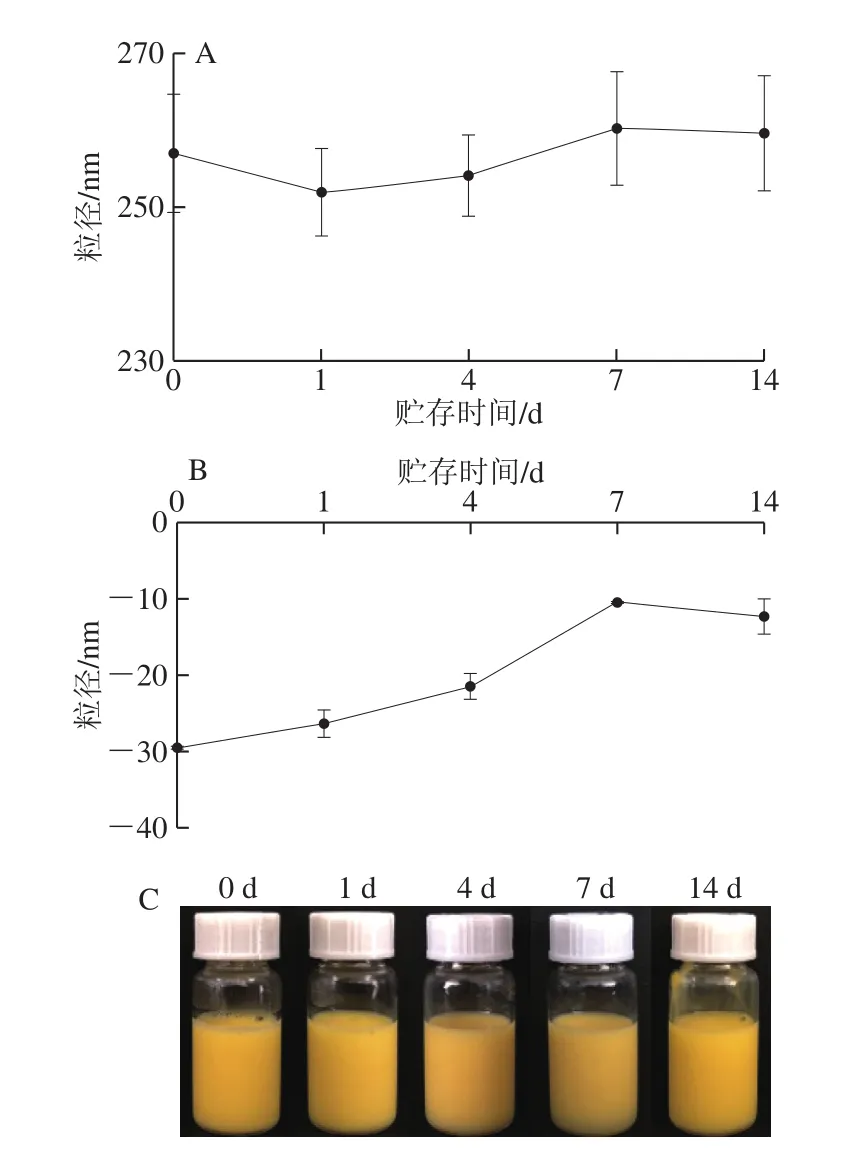
图1 PRPI乳液分别在室温贮存1~14 d的平均粒径(A)、Zeta电位(B)和外观形态(C)Fig.1 Average particle size (A), zeta potential (B) and appearance (C) of β-carotene-loaded emulsions stored at room temperature for 1–14 d
如图1所示,在贮存14 d中,随着贮存时间的延长,PRPI乳液的平均粒径从(257.02±7.73) nm上升至(259.67±7.51) nm(P>0.05)(图1A)。随着贮存时间的延长,PRPI乳液中液滴间相互碰撞的概率变大,使得液滴发生聚集,乳液的粒径略有增大[18]。Zeta电位是检测乳液稳定性常用的一个指标,乳液Zeta电位绝对值越大,体系中颗粒间电荷的相互排斥作用较强,颗粒不易聚集,则乳液稳定性较好[19]。PRPI乳液随着贮存时间的延长Zeta电位从(-29.50±0.17) mV上升(-12.34±2.30) mV(P<0.05)(图1B)。这说明PRPI乳液中颗粒间相互作用较弱,颗粒间发生一定程度的聚合。PRPI乳液在贮存过程中Zeta电位的绝对值发生显著的降低,而平均粒径却没有显著的变化,这可能是由于稀释过程对乳液粒径产生的影响。乳液体系的贮存稳定性还可以通过其外观形态在贮存过程中的变化判断。若乳液不出现分层现象,说明其有良好的贮存稳定性;若乳液发生溢油、破乳等分层现象,则说明其贮存稳定性不佳[20]。由图1C可知,PRPI乳液在贮存14 d后均呈现出状态均匀的淡黄色液体,未出现分层现象。因此,虽然乳液在贮存过程中Zeta电位绝对值减小,有聚集的趋势,但其平均粒径没有显著变化,并且乳液没有出现分层现象,故PRPI乳液有良好的贮存稳定性。
2.2 体外模拟消化过程中PRPI乳液粒径的变化
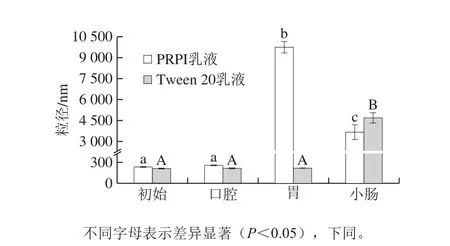
图2 PRPI和Tween 20乳液体外模拟消化过程中的粒径变化Fig.2 Changes in average particle size of PRPI or Tween 20-stabilized emulsions during in vitro simulated digestion
水包油乳液在消化过程中平均粒径的变化可影响其包埋的脂溶性营养物质的吸收释放情况。如图2所示,PRPI乳液在模拟消化的过程中平均粒径呈先增大后减小的趋势。经过模拟口腔液消化之后,PRPI乳液的粒径相比于初始乳液的粒径升高了22.50 nm(P>0.05)。这主要是因为模拟唾液中的盐离子和黏蛋白对乳液结构的影响。黏蛋白与油滴的相互作用会引起桥接或排斥絮凝[21]。经过模拟胃液消化后,PRPI乳液的粒径显著增加(P<0.05)。这可能是因为胃液中的胃蛋白酶会水解部分外层的PRPI,使得部分油滴暴露出来并发生聚集[22]。模拟小肠液消化后,PRPI乳液粒径降低到(3 654.36±527.91) nm,与模拟胃消化后的粒径相比显著降低(P<0.05)。在小肠消化过程中,胆汁盐可逐渐取代界面处的PRPI,使脂肪酶进入乳液内部,促进油滴的分解[23]。胆汁盐能够吸附形成一个新的乳化界面,从而减小了液滴的粒径。然而,对照组Tween 20乳液经模拟口腔和胃消化后,两者的平均粒径无显著性差异(P>0.05),随后经模拟小肠消化后,其粒径有显著升高(P<0.05)。这与Zhang Ruojie等[24]报道的结果一致,Tween 20乳液在小肠消化后具有较高的粒径,主要因为其是由未消化的脂质、混合胶束以及脂质消化后剩余的不溶性钙盐组成。
2.3 体外模拟消化过程中PRPI乳液电位的变化
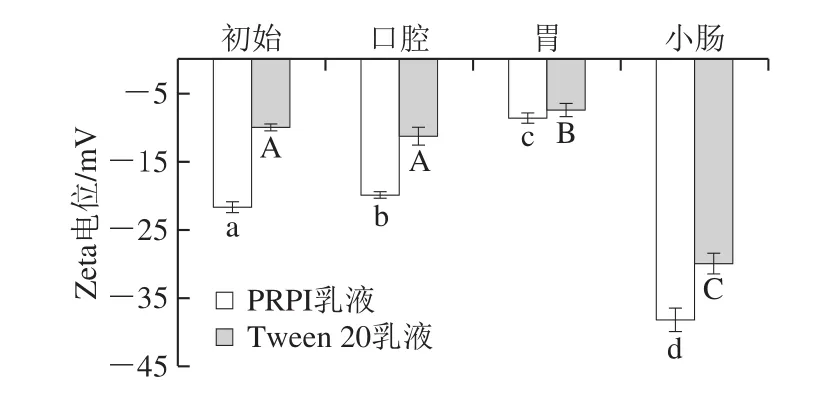
图3 PRPI和Tween 20乳液体外模拟消化过程中的Zeta电位变化Fig.3 Changes in zeta potential of PRPI or Tween 20-stabilized emulsions during in vitro simulated digestion
在模拟消化过程中,只有在营养素与消化液无限接近的情况下,才能打破相间的能量壁垒达到释放营养物质的目的。Zeta电位可以评价乳液中能量壁垒的变化,可通过分析能量障碍判断对包埋物生物利用度的影响[25]。如图3所示,在体外模拟消化过程中,2 种乳液体系的Zeta电位绝对值的变化趋势相似,均呈先减小后增大的趋势。乳液在体外模拟消化过程中Zeta电位变化与平均粒径相对应。在模拟胃液消化后,PRPI乳液和Tween 20乳液的Zeta电位分别为(-8.60±0.75)mV和(-7.40±0.95)mV,均呈现出一个较低的负电位值,这主要是由于胃液中的极低pH值引起的液滴表面电荷性质的变化[26]。另外,经模拟胃液消化后的PRPI乳液其离子强度相对较高,这可能会降低液滴之间的静电排斥力,导致电位降低。在模拟小肠液消化后,2 种乳液体系的Zeta电位绝对值均显著增加(P<0.05)。小肠液中的阴离子物质(如胆汁盐)会吸附在油滴表面,使乳液的Zeta电位绝对值增大。
2.4 体外模拟消化过程中PRPI乳液微观结构的变化
为了观察乳液体系在消化过程中微观结构的变化,通过荧光染色的方法观察蛋白和油脂的变化情况[27]。经激光扫描共聚焦显微镜观察(图4),2 种乳液体系微观结构的变化与平均粒径的结果相对应,初始乳液体系可观察到大小均一的红色油滴均匀的分散在水相中,这表明初始乳液体系状态稳定,没有出现絮凝。经模拟口腔液消化后,2 种乳液体系红色液滴仅有轻微的聚集,但相较于初始乳液变化不明显。经模拟胃液消化后,PRPI乳液的油滴发生大范围的聚集。经模拟小肠液消化后,PRPI油滴聚集程度变小,说明其油脂发生水解,内部的活性成分开始暴露出来,进而可被人体吸收。然而,Tween 20乳液经小肠液消化后,油滴才开始聚集,说明在小肠阶段PRPI乳液外层的Tween 20才开始发生水解,而内部的活性成分还没有暴露,这也可能是其β-胡萝卜素生物利用度较低的原因。
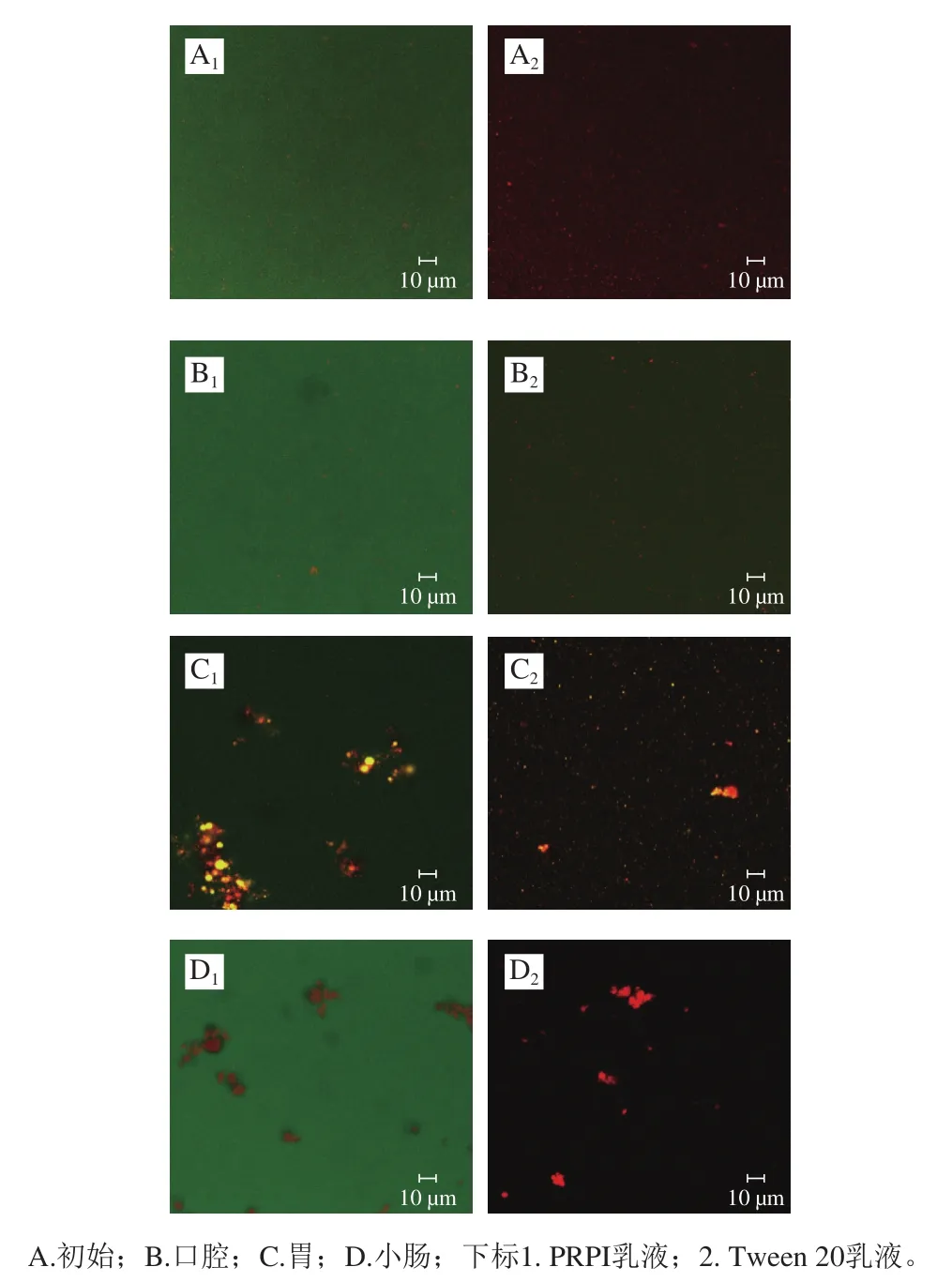
图4 PRPI和Tween 20乳液体外模拟消化过程中的微观形态Fig.4 Micromorphology of PRPI or Tween 20-stabilized emulsions during in vitro simulated digestion
2.5 体外模拟消化过程中PRPI乳液β-胡萝卜素保留率的变化
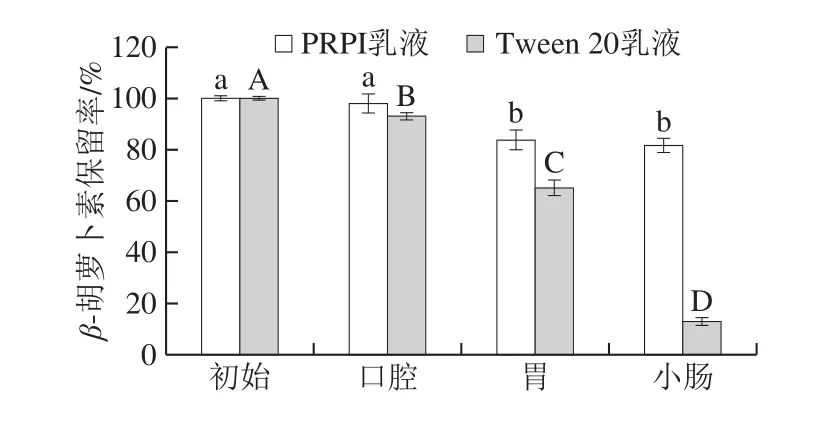
图5 PRPI和Tween 20乳液体外模拟消化过程中的β-胡萝卜素保留率Fig.5 Retention rates of β-carotene in PRPI or Tween 20-stabilized emulsions during in vitro simulated digestion
在经过各个模拟消化阶段的过程中,2 种乳液体系的β-胡萝卜素均有不同程度的损失。如图5所示,经模拟口腔液消化后,PRPI乳液的β-胡萝卜素保留率几乎没有发生变化,但Tween 20乳液的β-胡萝卜素保留率却降低了6.96%(P<0.05)。经模拟胃液消化后,PRPI乳液及Tween 20乳液的β-胡萝卜素保留率分别降低为(83.77±3.81)%、(65.13±3.01)%,在此阶段,PRPI可以明显地展现出活性成分的保护效果。最后经小肠液消化后,PRPI乳液的β-胡萝卜素保留率高达(81.64±2.72)%,说明经过小肠液消化后PRPI乳液的β-胡萝卜素基本没有损失;但是,Tween 20乳液的β-胡萝卜素保留率却仅为(13.00±1.53)%。在模拟体外消化的过程中,β-胡萝卜素会受到各种环境因素的影响,如离子强度、pH值等[28],而蛋白质外壳在一定程度上能够起到保护油滴的作用,PRPI具有一定的抗氧化特性,可抑制化学降解反应,同时,蛋白质可能与β-胡萝卜素形成复合物,保护β-胡萝卜素免于降解[29]。因此,与Tween 20乳液相比,PRPI乳液经模拟消化后仍有较高的β-胡萝卜素保留率。
2.6 PRPI乳液中β-胡萝卜素的生物利用度分析
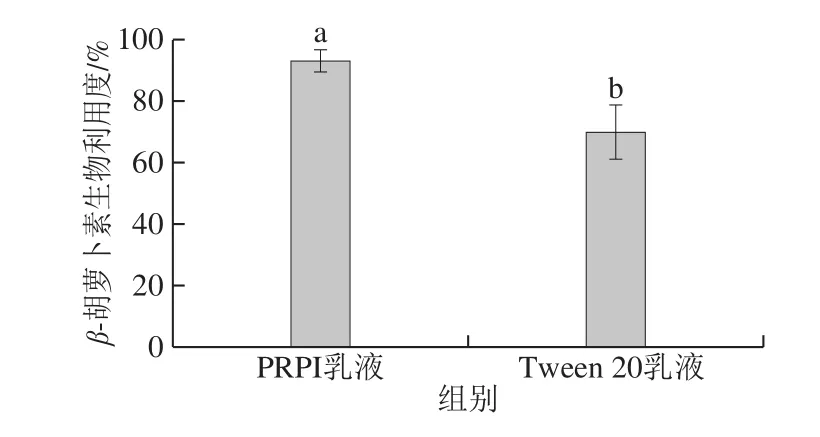
图6 PRPI和Tween 20乳液的β-胡萝卜素生物利用度Fig.6 Bioavailability of β-carotene-loaded emulsions stabilized with PRPI or Tween 20 during in vitro simulated digestion
在小肠消化阶段,由于载体油的水解,包埋在乳液中的营养物质会被释放,并溶解在胆汁盐胶束中,进而被小肠吸收[28]。通过测定胶束相和小肠消化液中β-胡萝卜素的含量,确定不同的乳化剂对β-胡萝卜素生物利用度的影响,结果如图6所示。PRPI乳液和Tween 20乳液中β-胡萝卜素的生物利用度分别为(93.13±3.59)%、(69.81±8.65)%,表明以PRPI为乳化剂构筑的乳液体系经模拟体外消化后其包埋的脂溶性活性物质仍有较高的生物利用度。有研究表明,乳液中的油脂、胆盐等可与原有乳化剂发生竞争性取代,吸附于乳滴表面,从而影响脂溶性活性物质胶束的形成[30]。PRPI作为乳化剂,在消化过程中可被消化液包含的各种消化酶酶解形成多肽,减小了界面层的厚度,更易于发生竞争吸附,被油脂、胆盐等替换,因而提高了PRPI乳液的β-胡萝卜素生物利用度。
3 结 论
本研究以高压均质的方法制备PRPI乳液,发现其在贮存14 d后乳液仍有良好的贮存稳定性。以乳液的平均粒径、Zeta电位、β-胡萝卜素的保留率及生物利用度为指标,探究PRPI乳液在模拟体外消化过程中的变化规律,并以Tween 20乳液作为对照。消化过程中PRPI乳液在口腔阶段保持稳定,到达胃阶段后蛋白外层开始水解,经小肠消化后油脂开始水解,β-胡萝卜素暴露出来,从而可被人体所吸收。PRPI乳液具有较高的β-胡萝卜保留率及生物利用度。因此,本研究以PRPI为乳化剂构筑的乳液输送体系能够较好地包埋β-胡萝卜素,并对β-胡萝卜素的递送和保护起到积极作用。上述研究为今后水产蛋白源乳液输送体系的设计及脂溶性营养物质体内生物利用度的提升提供良好借鉴,并为脂溶性营养物质在体内的控制释放研究提供了良好的基础。
