苜蓿冰结构蛋白对冷冻湿面筋品质及结构的影响
2020-09-17杜婷婷朱秀清陈凤莲李凌俐卢曼曼
曲 敏,吴 征,杜婷婷,朱秀清,陈凤莲,李凌俐,卢曼曼
(哈尔滨商业大学食品工程学院,黑龙江 哈尔滨 150076)
冰结构蛋白(ice structuring proteins,ISPs),又称抗冻蛋白或热滞蛋白,是我国于2006年批准可用于冷冻食品的新型添加剂。ISPs可由多种生物如鱼类,植物及昆虫体内所合成以保证其在低温生存[1-2]。它能以非依数形式降低水溶液冰点,具有热滞活性(thermal hysteresis activity,THA),可与冰表面不可逆结合,通过修饰冰晶形态来抑制冰晶产生和生长,使已有冰晶体颗粒大小之间重新分配,抑制冰晶重结晶[3-5]。Liu Mei等[6]发现重组胡萝卜抗冻蛋白可有效减少冻藏产生的冰晶数量,显著提高了冷冻面团所制面包的质量;潘振兴等[7]发现冰结构蛋白对长期冻藏冷冻面团发酵特性与超微结构的抗冻保护作用。而冷冻面团品质下降的主要原因是,面筋蛋白在冷冻过程中品质发生劣变[8]。因此,研究ISPs在冷冻过程中对面筋蛋白的品质影响,可为改善冷冻面团品质提供依据。
紫花苜蓿俗称金花菜,是重要的豆科牧草,亦可食用。其鲜品中蛋白含量高达18%以上。苜蓿耐寒能力极强,在-45 ℃极寒条件下返青率仍达90%。本课题组在前期研究中,以紫花苜蓿干草为原料,采用冰结合磷酸盐缓冲溶液法提取苜蓿冰结构蛋白(alfalfa ice-structuring proteins,AISPs),混合蛋白电泳结果显示,AISPs由两2 个组分组成,其分子质量分别约为34 kDa和52 kDa,经差示扫描量热(differential scanning calorimetry,DSC)仪检测THA为0.54 ℃,且其冰晶体积小、数量多,多呈菱形,具有很好的抗冻活性[9]。将AISPs添加到冷冻面团中,冷冻面团的硬度明显降低,弹性、回复性和内聚性稍增大,咀嚼性有所下降,改善了冷冻面团的品质[10]。将AISPs添加到速冻饺子皮中,速冻饺子皮的持水性显著提高,无明显开裂或无开裂。扫描电子显微镜(scanning electron microscope,SEM)结果显示,AISPs有效地改善了湿面筋蛋白的网络结构,并对生、熟饺子皮的质构特性产生了影响,可有效地保护饺子皮质地的均一性及稳定性[9]。本研究以苜蓿干草为原料提取AISPs,对其氨基酸组成及分离纯化后不同组分的THA、糖蛋白和二级结构进行鉴定,并将其与冷冻湿面筋粉混合,检测湿面筋蛋白持水性、可冻结水含量、蛋白分子质量及微观结构的变化。探究AISPs对冷冻湿面筋的品质和结构的影响。
1 材料与方法
1.1 材料与试剂
北大荒高筋面包粉 黑龙江北大荒有限公司;“肇东”紫花苜蓿 黑龙江省农业科学院草业研究所兰西苜蓿种植基地;考马斯亮蓝G250 上海科技发展有限公司;乙醇、叔丁醇、戊二醛、磷酸二氢钠、磷酸氢二钠、丙烯酰胺、过硫酸铵、甘氨酸、双丙烯酰胺(均为分析纯) 天津市致远化学试剂有限公司。
1.2 仪器与设备
中草药粉碎机 天津市泰斯特仪器有限公司;ZLG-10型真空冷冻干燥机 北京博医康试验仪器有限公司;R-205旋转蒸发仪 上海中胜生物技术公司;Z366高速大容量离心机 上海浦东物理光学仪器厂;EMS-9A磁力搅拌器 天津欧诺仪器仪表有限公司;SE-3400N SEM 日本日立公司;Q200 DSC仪 美国TA公司;TDL80-2B台式小离心机 上海安亭科技仪器厂;Nexus-470傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)仪 美国Nicolet公司。
1.3 方法
1.3.1 AISPs的提取
参考文献[11]中改进的冰球结合磷酸缓冲溶液法提取AISPs。将得到的冰提AISPs溶液冷冻干燥,即得AISPs冻干粉,备用。
1.3.2 AISPs的氨基酸组成分析
参照贾青慧等[12]的方法进行测定。
1.3.3 AISPs分离纯化
参照张延红等[13]的方法进行改进分离纯化AISPs。经检测AISPs的等电点为3.4,故采用阴离子交换色谱柱DEAE-52进行分离纯化。分离条件为:离子交换洗脱液pH 8.0、缓冲液浓度20 mmol/L、上样量1 mL,上样质量浓度40 mg/mL。收集各洗脱峰,于40 ℃旋转蒸发,待液体浓缩至10 mL左右停止旋蒸,装入透析袋,2~3 h更换一次透析液,透析48 h后经冷冻干燥,配成质量分数10%的溶液进行后续鉴定。
1.3.4 AISPs分离组分的THA检测
参照曲敏等[9]方法进行测定。THA与冰核含量计算方法如下:

式中:Th为保留温度;T0为在不同停留温度下体系的开始结晶温度。

式中:Φ为冰晶质量分数/%;ΔHf、ΔHm分别为AISPs溶液的结冰焓和熔融焓。
1.3.5 AISPs分离组分糖蛋白的鉴定
参照刘翠芳等[14]的方法并改进。将含有样品的滤纸浸在70%乙醇溶液中,片刻后吹干,在高碘酸溶液中浸5 min,用70%乙醇溶液清洗后于还原液中浸5~8 min,用70%乙醇溶液清洗,在亚硫酸-品红溶液中浸24~25 min后用亚硫酸盐冲洗3 次,乙醇脱水后,吹干。
1.3.6 AISPs分离组分的FTIR检测
参照张秋会等[15]的方法并改进。准确称取1 mg待测样品,加入100 mg溴化钾,研磨均匀后进行压片,进行FTIR的测定。测定波数在4 000~400 cm-1之间的吸收光谱,波数精度为0.01 cm-1,分辨率为4 cm-1,扫描次数为32 次。
1.3.7 面筋蛋白干粉的制备
参照姜小苓等[16]的方法并改进。称取150 g脱脂小麦面粉,加入100 mL蒸馏水(不超过20 ℃)揉成面团后,置于含500 mL蒸馏水的1 L大烧杯中,静置30 min。经过一系列蒸馏水揉洗(2×300 mL,2×150 mL,4×100 mL,4×75 mL和6×50 mL),得面筋蛋白组分,将其冷冻干燥后,粉碎、过80 目筛,即为面筋蛋白干粉。
1.3.8 湿面筋样品的冻藏与冻融处理
将面筋蛋白干粉分别与添加量0%、0.5%、1%、1.5%的AISPs冻干粉充分混匀,溶于蒸馏水中。一组于-18 ℃及-40 ℃冻藏1、3、5、7 周;另一组于-18 ℃及-40 ℃冻融1、3、5、7 周(每周解冻1 次)。测定前在室温下进行解冻。
1.3.9 湿面筋蛋白持水性的测定
参照李翠翠等[17]的方法并改进。取解冻后的样品以10 000 r/min离心15 min,倒掉离心出来的液体,以离心前后样品的质量差与样品质量的比值,评估样品的持水性。
1.3.10 湿面筋蛋白可冻结水含量的测定
参照钱晓洁等[18]的方法并改进。取面筋蛋白样品10 mg放在铝制坩埚中进行压片。将坩埚放入DSC中,在-15 ℃和5 ℃保持5 min,然后从-15 ℃升温到5 ℃,升温速率为1 ℃/min。
1.3.11 湿面筋蛋白的SDS-PAGE测定
参照张延红等[13]的方法并改进。采用12%分离胶、4%浓缩胶,电泳初始电压100 V,待条带跑至浓缩胶与分离胶界面时改为80 V。电泳结束后,染色、脱色处理,拍照。用Quantity One软件对电泳图进行分子质量分析与确定。
1.3.12 冷冻湿面筋蛋白微观结构观察
参照郭金英等[19]的方法并改进。将干燥样品固定在样品台上,用镀膜仪镀上金属膜,置于SEM下观察样品的结构。
1.4 数据统计方法
所有数据平行测定3 次,采用SPSS 17.0软件进行方差分析,结果以±s表示;用Microsoft Excel 2010软件制图。
2 结果与分析
2.1 AISPs的氨基酸组分分析
由表1可以看出,AISPs含17 种氨基酸。含量最多的为天冬氨酸占1.75%,其次是谷氨酸占1.64%,两者皆为亲水性氨基酸。含量最低的是蛋氨酸占0.07%。亲水性与疏水性氨基酸的比例约为7∶4,说明AISPs具有较强的亲水性,可与冰晶表面水分结合,从而修饰冰晶形态、抑制冰晶生长。
2.2 AISPs组分的鉴定
2.2.1 AISPs组分的分离
从图1A可以看出,共有4 条洗脱峰。对分离出的AISPs蛋白组分进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)检测,结果如图1B所示,可以看出条带清晰的P2、P4组分分别约为34、52 kDa,故取其进行后续检测。
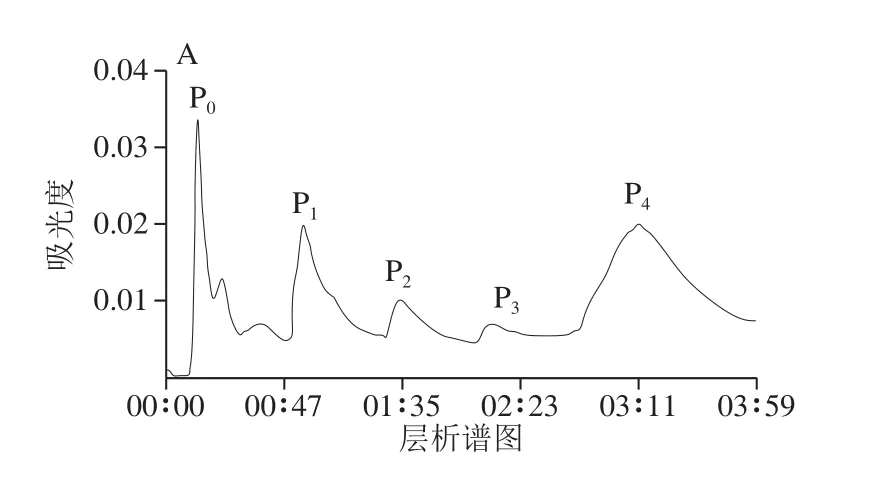

表1 氨基酸组成及含量Table 1 Amino acid composition of AISPs
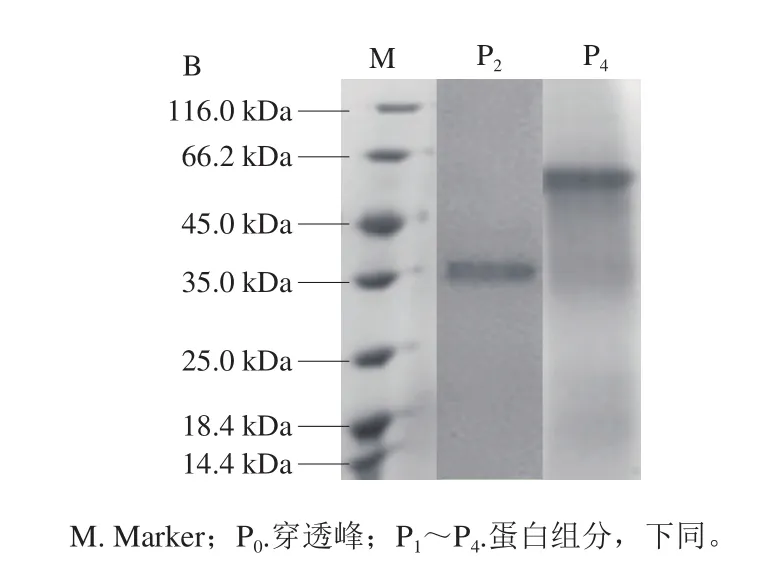
图1 AISPs组分的层析谱图(A)及SDS-PAGE检测结果(B)Fig.1 Chromatographic separation (A) and SDS-PAGE (B) of AISPs
2.2.2 THA的DSC检测结果
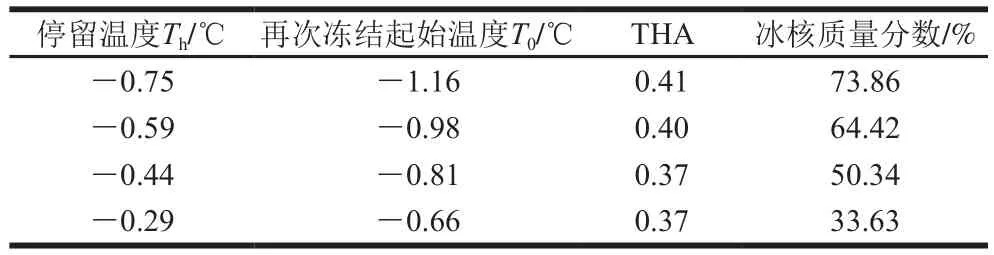
表2 AISPs P2组分的THA检测结果Table 2 THA measurement of component P2 of AISPs

表3 AISPs P4组分的THA检测结果Table 3 THA measurement of component P4 of AISPs
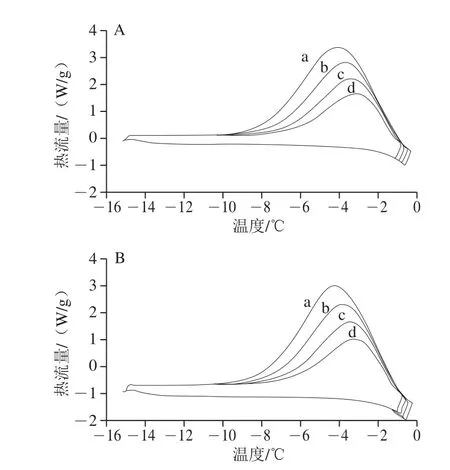
图2 AISPs组分的DSC热流曲线Fig.2 DSC heat flow curve of AISPs components
由表2、3和图2可看出,随着停留温度升高,放热曲线面积变大,处于该停留温度下的冰核质量分数减少。P2组分随着停留温度升高,THA逐渐降低,当停留温度从-0.75 ℃升高至-0.29 ℃时,冰核质量分数从73.86%降至33.63%;P4组分,随着停留温度升高,THA先稳定后降低,当停留温度从-0.75 ℃升高至-0.28 ℃时,冰核质量分数从74.94%降至35.41%;P2组分的THA为0.37~0.41 ℃,P4组分的THA为0.32~0.41 ℃,均接近沙冬青叶ISPs的0.46 ℃[20],表明AISPs组分的THA良好。而本研究组实验前期研究的AISPs混合组分的THA为0.54 ℃[21],说明分离后AISPs的单一组分的THA有所降低。
2.2.3 AISPs的糖蛋白鉴定结果

图3 AISPs的糖蛋白鉴定结果Fig.3 Identification of AISPs as glycoprotein
过碘酸可把糖类相邻2 个碳上的羟基氧化成醛基,用Schiff试剂和醛基反应使糖类呈现紫红色。如图3所示,利用Schiff染色法对P2、P4组分进行染色,显色反应的结果如箭头处所示:P2组分呈现紫红色,表明34 kDa组分为糖蛋白;而P4组分无显色反应,表明52 kDa组分为非糖蛋白。
2.2.4 AISPs的FTIR检测结果
酰胺I带(1 600~1 700 cm-1)和酰胺III带(1 220~1 330 cm-1)是蛋白质的特征谱带,其振动频率取决于C=O和N-H之间的氢键性质,为特征振频率,反映了AISPs 2 个组分的特定二级结构。在酰胺I带中,1 618~1 640 cm-1为β-折叠;1 650~1 660 cm-1为α-螺旋;1 640~1 650 cm-1为无规卷曲;1 660~1 700 cm-1为β-转角。从图4a显示,由于P2组分的特征峰谱带相互叠加,1 631 cm-1属于酰胺I带的β-折叠的特征峰,采用peakfit软件对该范围峰进行分解拟合分析。图4b的拟合曲线显示,1 653 cm-1为α-螺旋,1 613、1 635、1 622、1 628 cm-1为β-折叠,1 664 cm-1为β-转角,1 644 cm-1为无规卷曲。从图4c显示,1 641.31cm-1属于酰胺I带(1 600~1 700 cm-1)吸收峰,1 641cm-1属于β-折叠的特征吸收峰;酰胺III带出现圆头峰。通过peakfit进行拟合,从图4d可以看出,1 652.48 cm-1为α-螺旋,1 610.63、1 620.38、1 628.73、1 635.07 cm-1为β-折叠,1 662.48、1 673.77、1 685.39 cm-1为β-转角,1 642.8 cm-1为无规卷曲。二级结构的检测结果见表4。
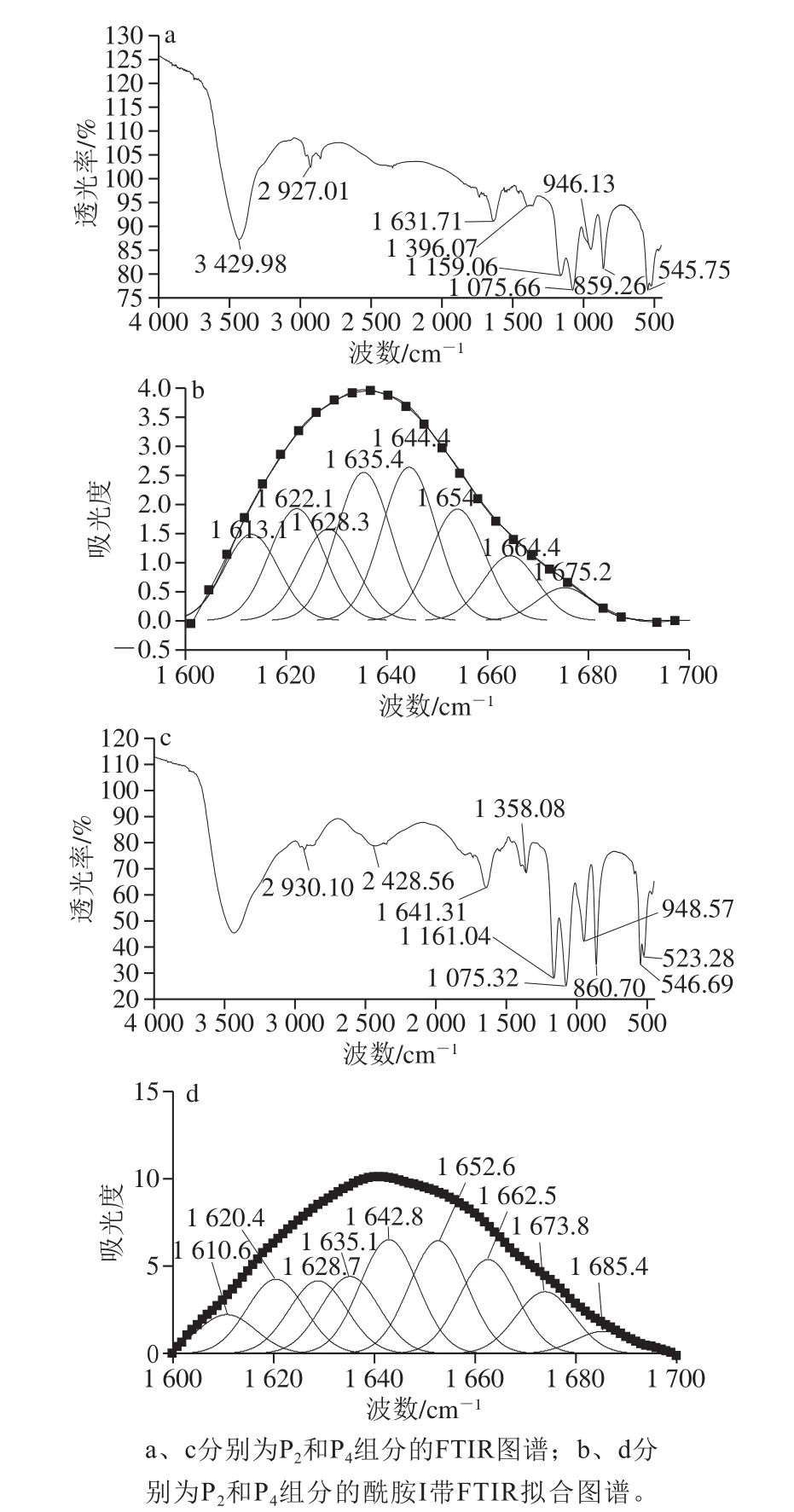
图4 AISPs组分的FT-IR图谱及酰胺I带FTIR拟合图谱Fig.4 FTIR spectra and AISPs components and curve fitting of amide I band
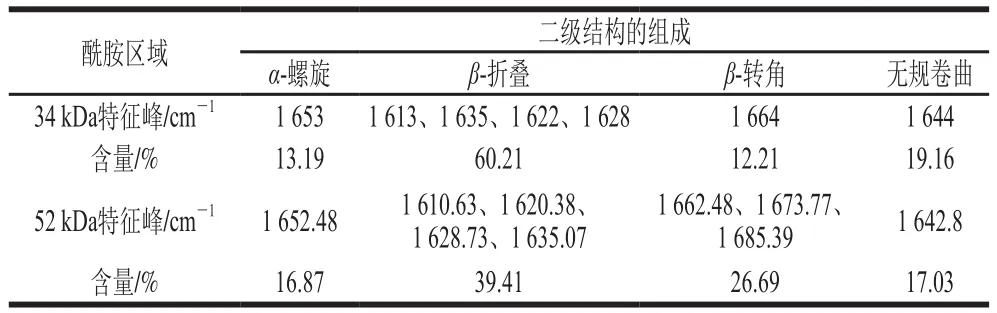
表4 AISPs P2、P4组分二级结构的检测结果Table 4 Secondary structure composition of AISPs P2 and P4
从表4得出,AISPs的34 kDa组分的二级结构比例为α-螺旋∶β-折叠∶β-转角∶无规卷曲=13.19∶60.21∶12.21∶19.16;52 kDa组分的二级结构比例为α-螺旋∶β-折叠∶β-转角∶无规卷曲16.87∶39.41∶26.69∶17.03。Yu Zhao等[22]采用拉曼光谱对天然SPI的二级结构进行测定,发现其含有较多的β-折叠结构,其含量为55.2%,而α-螺旋结构较少,含量仅为14.4%,这与2.2.4节得到的天然AISPs二级结构的含量相近。
2.3 冷冻湿面筋蛋白持水性与可冻结水含量的变化
2.3.1 冷冻湿面筋蛋白持水率的变化
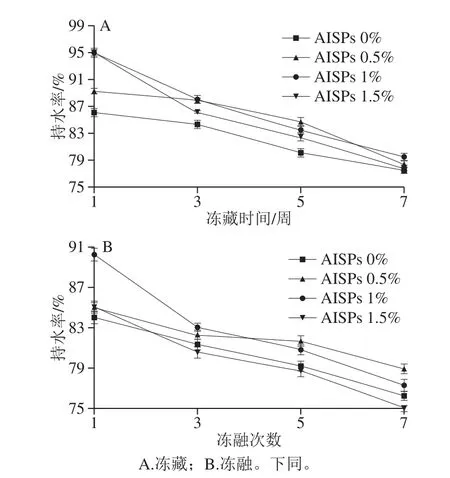
图5 -18 ℃不同AISPs添加量下冻藏冻融湿面筋蛋白持水率的变化Fig.5 Changes in water-holding capacity of frozen-thawed wet gluten with different amounts of AISPs added at -18 ℃
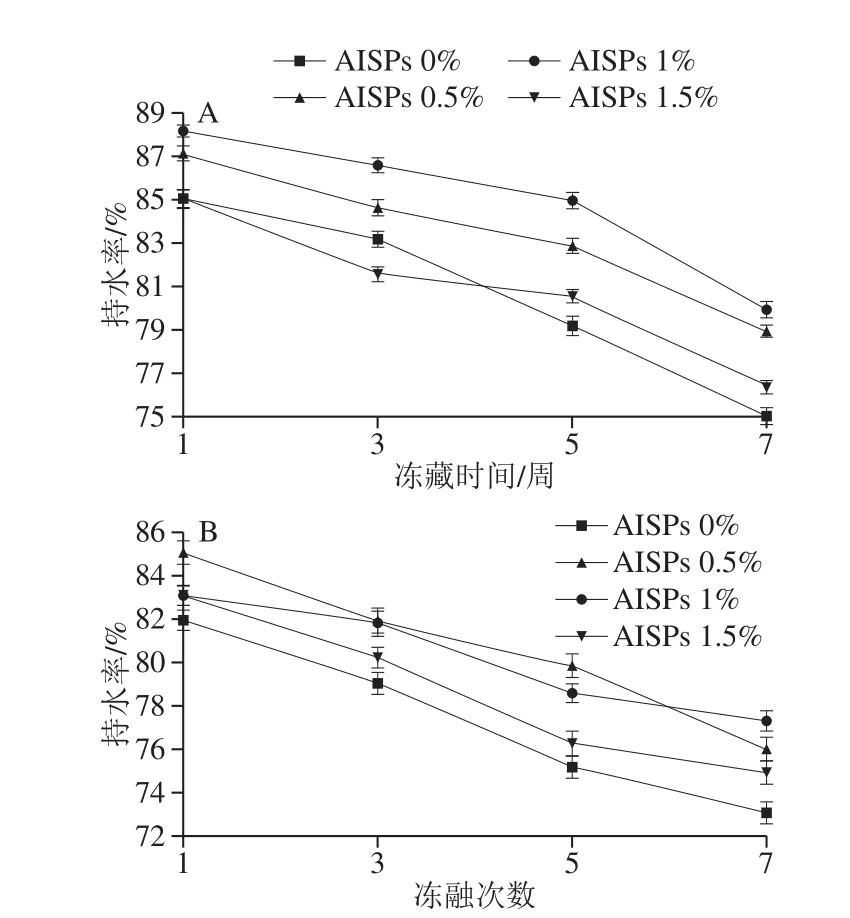
图6 -40 ℃不同AISPs添加量下冻藏冻融湿面筋蛋白持水率的变化Fig.6 Changes in water-holding capacity of frozen-thawed wet gluten with different amounts of AISPs added at -40 ℃
图5、6对比可知,在-18 ℃和-40 ℃时,添加不同浓度AISPs的冻藏冻融湿面筋蛋白持水率较空白组均有所上升,但-18 ℃的持水率上升幅度较小,说明AISPs在-40 ℃低温处理时作用效果更为显著,故后续研究及讨论均在-40 ℃进行。
从图6可以看出,随着冷冻时间的延长,冻藏和冻融各组的湿面筋蛋白持水率均呈下降趋势。冻藏和冻融对照在3、5、7 周后,持水率大幅度下降,且冻融处理比冻藏处理的下降幅度更大,说明对湿面筋破坏作用更为显著。不同添加量的AISPs,不同程度地缓解了下降趋势,其中,添加0.5%和1% AISPs组的效果明显高于对照和1.5%组,其中1% AISPs组的总体效果更突出,冻藏组较对照分别提升了3.42%、5.79%、4.85%;冻融较对照分别提升了2.82%、3.39%、6.27%。说明由于温度波动产生的冰晶重结晶现象进一步破坏了面筋网络结构,添加AISPs对冷冻湿面筋蛋白的持水性具有保护作用,保护了水分的流失,且不同AISPs添加量、不同冷冻方式对湿面筋蛋白持水率的影响有差异。
2.3.2 冷冻湿面筋可冻结水含量的变化
由图7可以看出,随着冷冻时间的延长,冻藏组和冻融组的湿面筋蛋白可冻结水含量均逐渐增加。不同添加量的AISPs,不同程度地缓解了上升趋势,其中,添加0.5% AISPs组效果最好。在冷冻处理3、5、7 周后,冻藏组较对照分别下降了4.55%、4.49%和4.30%;冻融组较对照分别下降了3.37%、2.17%和3.16%。说明在冷冻过程中,湿面筋中水分发生结晶,其中的半结合水因与高分子物质结合不紧密而发生迁移,小冰晶不断聚集形成大冰晶,刺破面筋的网络结构,从而导致持水率下降及水分流失,可冻结水含量增加[23]。而AISPs的添加减缓了可冻结水含量的上升趋势。说明AISPs可以降低溶液的凝固点,在范德华力、疏水性相互作用和氢键作用下吸附到面筋蛋白体系中冰核表面,抑制冻结过程中的冰晶生长和再结晶[24],减少了冰晶对湿面筋网络结构的破坏,阻止了水分从面筋网络结构中离析[25]。
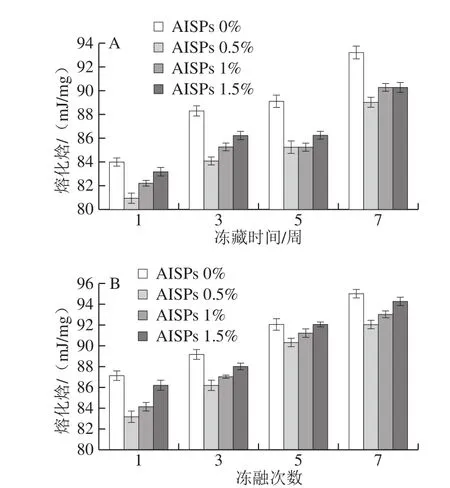
图7 AISPs对湿面筋冻藏冻融过程中熔化焓值变化的影响Fig.7 Effect of AISPs on the change in melting enthalpy of wet gluten during freezing-thawing process
此外,当AISPs添加量为1.5%时,冻藏1 周时持水率小于对照,5、7 周后,高于对照、却小于其他添加量;冻融组中虽一直高于对照,却小于其他添加量。Carpenter[26]和蔡路昀[27]等发现ISPs相对浓度较低时可显著提高红细胞的存活率;而较高浓度将致使红细胞的存活率降低。因此,当AISPs的添加浓度较低,体现出抑制湿面筋体系中大冰晶形成及对面筋蛋白的破坏,有效地锁住了水分;而AISPs较高浓度时,促进了大冰晶的形成,对湿面筋蛋白的破坏作用开始显现,导致持水性下降。说明,AISPs的添加量与湿面筋持水性及可冻结水含量的抗冻保护作用存在着一定的量效关系。
2.4 AISPs对冷冻湿面筋蛋白分子质量的影响
采用Quantity One软件分析图7中各湿面筋蛋白样品的电泳条带及分子质量,结果如图8所示。
小麦面筋蛋白由麦醇溶蛋白、麦谷蛋白、麦清蛋白及麦球蛋白组成,其中麦醇溶蛋白约占蛋白质总量的50%,其分子质量范围为30~80 kDa,根据其在低pH值下电泳迁移率的不同可分为α-、β-、γ-、ω-麦醇溶蛋白4 种类型[17]。α-、β-、γ-麦醇溶蛋白的分子质量范围为30~50 kDa,ω-麦醇溶蛋白的分子质量范围在45~75 kDa之间。麦谷蛋白约占蛋白质总量的35%~45%,其亚基可分为HMW-GS和LMW-GS。HMWGS可分为X、Y两种类型,分子质量分别为80~90 kDa和65~75 kDa。LMW-GS可分为B、C、D 3 种类型,C、D型分子质量分别为20~40、50~70 kDa,大多数为B型分子质量为30~40 kDa[28]。麦谷蛋白和麦醇溶蛋白分别决定面团的黏弹性和延展性,对面筋网络结构、冷冻面团及冷冻面食品的质量产生很大影响。
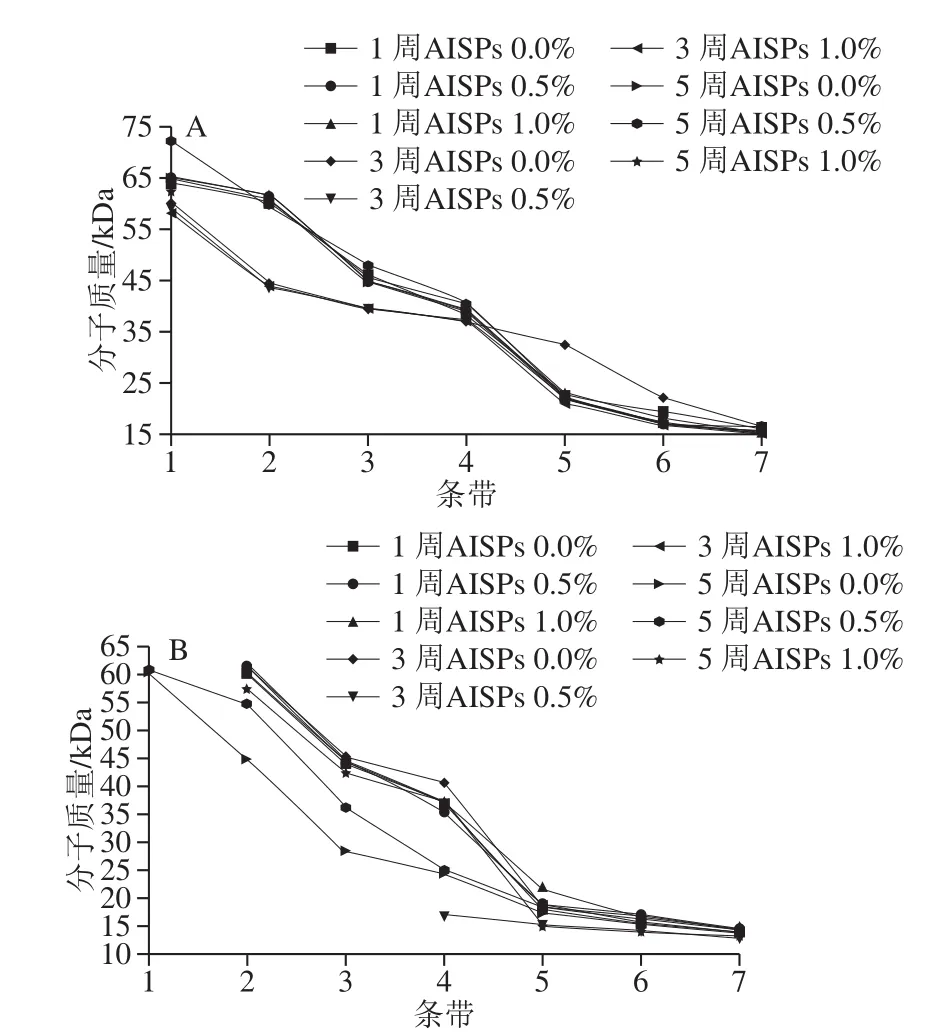
图8 冻藏与冻融湿面筋蛋白样品的分子质量变化趋势Fig.8 Changes in molecular mass of frozen and freeze-thaw gluten samples
从图8可以看出,经过冻藏处理的湿面筋蛋白分子质量呈下降趋势,分子质量范围在14~70 kDa之间。随着冷冻时间的延长,65~75 kDa的蛋白组分完全消失,14.4~30 kDa的组分显著增加。其中,ω-麦醇溶蛋白部分降解,麦谷蛋白HMW-GS全部降解,LMW-GS的B亚基和C亚基较稳定,D亚基有不同程度的增加,尤其在冻藏5 周和7 周时D亚基组分的增加进一步加大。AISPs添加组的湿面筋蛋白组分较对照均有低分子质量组分的不同程度增加,其中0.5% AISPs的湿面筋蛋白分子质量变化较大,如对D亚基分子质量的影响偏大,冻藏3 周时对照组的D亚基分子质量为39.23 kDa,0.5%AISPs的在5 周则增加至47.79 kDa。说明在低温冷冻破坏了维持HMW-GS和ω-麦醇溶蛋结构的作用键,使得蛋白质发生伸展和降解。冰晶的重结晶和水分的重新分布使LMW-GS/HMWGS的比率呈现出较为明显的增大趋势[29-30]。
从图8可以看出,经过冻融处理后的湿面筋蛋白分子质量同冻藏处理的结果,亦呈下降趋势,总体范围处在12~60 kDa之间,其中ω-麦醇溶蛋白、麦谷蛋白HMWGS及LMW-GS的B、C、D亚基的变化也同冻藏处理结果相仿。而随着冻融次数的增加,低分子质量蛋白进一步增加,明显多于冻藏处理。B、C、D亚基发生了不同程度的增加,其中主要集中在B亚基和C亚基的增加。加入AISPs后,在一定程度上缓解了蛋白组分降解。以AISPs添加量为1%时最佳,此时冻融处理后在35~66.2 kDa分子质量的蛋白显著增加。Ribotta[31]和Sharadanant[32]等认为冷冻处理不再使低分子质量蛋白发生降解,与本实验结果有差异。分析原因为加入AISPs后,冰晶的形态被修饰成规则的六边形状,对蛋白聚集体的破坏力减弱,从而缓解了高分子蛋白的解聚,且与蛋白质三维网络结构的物理截留作用存在很大的关系[33-34]。
由图8可知,经冻融处理后,分子质量为61.26~71.96 kDa的蛋白组分全部降解,经冻融处理湿面筋蛋白全部蛋白组分的分子质量较冻藏低,说明低温反复冻融对麦谷蛋白聚集体的破坏更为严重。但添加AISPs冻融处理的样品表现出高分子质量解聚与低分子质量聚集的现象有所减缓,说明AISPs对冻融湿面筋蛋白具有一定的抗冻保护作用。
2.5 湿面筋SEM微观结构表征
由图9可见,湿面筋蛋白超微结构呈现出多孔的三维立体网络状,呈连续纤维状的为麦谷蛋白聚合体,而较小的麦醇溶蛋白则穿插其中。冻藏1 周时面筋蛋白呈网眼状紧密相连且蛋白孔洞大小均匀且光滑,表明蛋白结构致密统一,具有较好的稳定性[35]。随着冻藏时间的延长,面筋蛋白网络结构中的黑色孔洞逐渐变大,这是由于湿面筋蛋白冷冻时,其中的水分形成冰结晶分布在面筋蛋白基质的各个部位,速冻后冰晶升华成汽体从面筋蛋白中溢出,冰晶体原来所处位置便成为空穴[36]。与同组样品冻藏条件湿面筋蛋白超微结构相比,冻融条件下,湿面筋蛋白面筋碎片增多,产生了大量不规则孔洞,质地粗糙、面筋纤维束断裂,说明冻融循环对面筋网络结构的破坏更大。刘国琴等[37]认为冻融处理会导致温度发生波动而产生等质量重结晶、迁移重结晶和晶体生长等重结晶现象。此外,冻融处理可引起湿面筋网络结构物化性质的改变,冻藏冻融处理后的湿面筋蛋白持水性下降,导致组分中游离水增多,可冻结水形成冰晶后体积增加,其异常的膨胀特性使得蛋白质的三维网络结构受到挤压而破坏[38]。Kontogiorgos等[39]发现由于水与蛋白质的相互作用,可以增加水合结构中原子-原子间相互作用,高分子质量蛋白质体系如麦谷蛋白,在冷却过程中会发生玻璃化现象,从而减缓对面筋蛋白网络结构的损害。说明,低温冻藏与冻融处理破坏麦谷蛋白HMW-GS后,导致其不同程度的降解,进而加剧了对面筋网络结构的破坏。SEM结果与本实验前期对湿面筋蛋白电泳及其分析结果相印证。
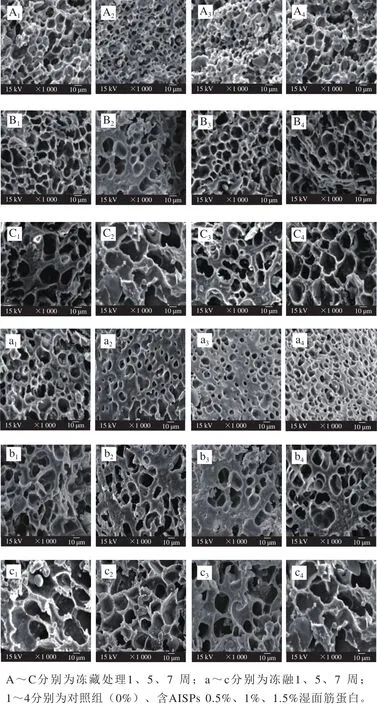
图9 -40 ℃冻藏和冻融处理的湿面筋蛋白超微结构(×1 000)Fig.9 Ultrastructure of frozen and thawed wet gluten at -40 ℃ (× 1 000)
与对照组相比,AISPs的添加均使面筋蛋白微观结构得到明显改善。对比不同添加量,当AISPs添加量为1%时,孔壁厚且较为光滑;面筋蛋白的网络结构重新交联,孔洞重新排布,使得面筋蛋白网络支撑力加强。说明AISPs可抑制冰晶形成,使冷冻湿面筋蛋白内外部的可冻结水形成相对较小且均匀的冰晶,对面筋蛋白具有抗冻保护作用,可提高冷冻面制品的品质[40]。
湿面筋蛋白的持水率和可冻结水含量的变化,反映了水分的存在方式和迁移规律,在一定程度上佐证了冷冻条件下,湿面筋蛋白组分的分子质量及SEM网络表征的变化趋势。综上确定,AISPs添加量为1%时,对-40 ℃条件下冻融样品的抗冻保护效果最优。
3 结 论
AISPs含17 种氨基酸,亲水性与疏水性氨基酸的比例为7∶4;对AISPs进行分离后,得到34、52 kDa两个分离组分,前者为糖蛋白,后者为非糖蛋白;34 kDa组分的THA为0.37~0.41 ℃,52 kDa组分的THA为0.32~0.41 ℃。34 kDa组分的二级结构比例为α-螺旋∶β-折叠∶β-转角∶无规卷曲=13.19∶60.21∶12.21∶19.16;52 kDa组分的二级结构比例为α-螺旋∶β-折叠∶β-转角∶无规卷曲=16.87∶39.41∶26.69∶17.03。
在-18 ℃和-40 ℃分别冻藏与冻融处理湿面筋蛋白,显示添加不同浓度AISPs各组的持水率下降趋势减缓,且对-40 ℃处理样品的保护效果更为显著。
随着冻藏时间的延长和冻融周期的增加,湿面筋蛋白的持水性呈下降趋势,可冻结水含量逐渐增加,冻融组均高于冻藏组。添加AISPs后,持水率下降和可冻结水上升趋势减缓。且AISPs的添加量与湿面筋蛋白持水性及可冻结水含量的抗冻保护作用存在着一定的量效关系。
经电泳和Quantity One软件分析,随着冻藏时间的延长,湿面筋蛋白的ω-麦醇溶蛋白部分降解,HMW-GS全部降解,LMW-GS的B亚基和C亚基较稳定,D亚基有所增加;随着冻融次数的增加,低分子质量蛋白进一步增加,明显多于冻藏。B、C、D亚基发生了不同程度的增加,主要集中在B亚基和C亚基的增加。加入AISPs后,在一定程度上缓解了蛋白组分降解。并促使低分子质量组分有不同程度增加,其中0.5% AISPs和1% AISPs分别对冻藏和冻融样品的影响较大。
SEM表征结果显示,随着冻藏时间的延长和冻融周期的增加,面筋网络结构受到破坏,出现大量不规则、质地粗糙的孔洞。AISPs的添加使湿面筋网络得以清晰连续。
