人工胃肠液模型在药物稳定性研究中的应用现状
2015-01-08黄财顺李宝才
黄财顺,李宝才,向 诚,2*
1昆明理工大学生命科学与技术学院,昆明 650500;2 北京大学天然药物及仿生药物国家重点实验室,北京 100191
口服药物吸收的主要场所是胃肠道,胃肠液的消化作用可能使药物降解失活,所以进行胃肠道的稳定性研究具有一定的价值。人工胃肠液模型主要包括人工胃液和人工肠液孵育,制作简单,操作简便,有助于了解药物在体内的稳定性情况,探讨影响药物稳定性的因素,有助于指导药物结构优化和制剂的开发,已经被广泛应用[1-7]。然而各家的实验设计、考虑因素差异较大,例如人工胃液的作用时间少则5 min,多则可达24 h[10];人工肠液的作用时间少则10 min,多则可达24 h;是否需要边孵化边搅拌以模拟肠胃蠕动,也没有统一;其他因素的设定也没有统一规范,故本文对影响药物在人工胃肠液中稳定性的主要因素、因素范围及其分析方法进行了综述,并提出包括时间、pH 值、酶浓度和搅拌速度在内的四因素析因设计的实验方法,为更好地采用该模型进行研究提供参考依据。
1 人工胃肠液模型用于药物稳定性研究的基本操作
《中国药典》(2010 版)记载的人工胃肠液的配制方法为:稀盐酸16.4 mL,加水约800 mL 与胃蛋白酶10 g,摇匀后,加水稀释成1000 mL;人工肠液的配制方法为:取磷酸二氢钾6.8 g,加水500 mL 使溶解,用0.1 mol/L 氢氧化钠溶液调节pH 值至6.8,取胰酶10 g,加水量使溶解,将两液混合后,加水稀释至1000 mL 即得。
利用人工胃、肠液模型研究药物的消化稳定性主要包括以下步骤:1、配制人工胃液和肠液;2、将待测药物稀释成一定浓度加入到配好的人工胃液和肠液中,并设计孵化温度和时间,定时取出孵化液样品;3、样品经过处理后进行含量检测,综合分析后可知该药物在胃肠道中的稳定性情况。
2 人工胃肠液模型的主要考察因素和实验方法
影响药物在人工胃、肠液中的稳定性的因素除了药物本身性质以外主要还有五个,分别是1.胃、肠液的pH;2.胃、肠蛋白酶;3.胃肠道作用时间;4.胃肠道温度;5.胃肠蠕动速度。
若想详细认识药物在胃、肠液中的稳定性情况,有必要规范操作对各因素做系统的分析。目前,大部分学者采用以下四种实验设计的方法:简单分析、单因子分析、双因子分析、胃液-肠液整体分析的方法。
2.1 简单分析
简单分析是指直接用《中国药典》规定的人工胃、肠液处理药物,时间等因素不做考虑。例如尚晓娅等[6]用此类方法对抗性淀粉进行了体外稳定性研究;伍妍俊等[8]对甲基化EGCG 的合成及其在人工模拟胃、肠液中的稳定做了研究。以上研究均直观地表明了药物稳定性是否受人工胃、肠液的影响。该分析方法较简单,以含量的变化为指标就能判断药物在消化模型中是否稳定,但不能分析原因。
2.2 单因子分析
单因子分析方法是目前采用较多的方法,多以胃肠道作用时间作为单因子,以一定的时间间隔点抽取反应产物进行分析。例如金晖等[9]探讨南瓜多糖在人工胃液中的稳定性情况,经30、90、150、720 min 作用后,还原糖及分子量的变化表明南瓜多糖在人工胃液中随时间的延长降解程度越大。周园等[10]对烟酰水杨酸在人工胃、肠液中10 min、30 min、1、2、3、4、5、6、10、18、24 h 分别取样,结果显示烟酰水杨酸在人工肠液中的降解程度较人工胃液的大,且随作用时间延长降解率更高。冼小敏等[11]制备燕窝水提物,分别与等体积的人工胃、肠液混合,37 ℃消化,按时间梯度0、1、5、10、15、30、60 min 准确计时并终止反应,SDS-PAGE 凝胶电泳方法检测燕窝蛋白质的降解情况,结果发现燕窝蛋白降解物没有随着反应时间的延长而增多。这类实验设计可以得到消化时间对药物稳定性的影响。
2.3 双因子分析
双因子分析方法是另外一种应用较广泛的实验设计方法:即以胃肠道消化酶和pH 作为双因子,考察pH、消化酶和作用时间对药物稳定性的影响。主要出现以下四种情况,统计结果见表1。
情况一:药物在人工胃、肠液(酸碱环境+消化酶)和不含消化酶的人工胃、肠液NE(仅含酸碱环境)中均稳定,即可推断该药物可能耐受胃、肠液的酸碱环境和消化酶。陈国庆等[12]以此方法对四乙酰葛根素的稳定性进行研究,发现四乙酰葛根素在人工肠液和不含胰蛋白酶的人工肠液NE 中稳定性均很好,推断四乙酰葛根素在人工肠液中稳定性较好,可开发肠溶制剂。
情况二:药物在人工胃、肠液中不稳定,但在人工胃、肠液NE 中稳定性良好,即可推断影响稳定性的最主要因素是胃、肠蛋白酶。荣娜娜等[13]以人工胃、肠液和不含蛋白酶的人工胃、肠液NE 处理灯盏花乙素,并间隔0.5 h 取样,发现灯盏花乙素在人工胃液中不稳定,从0.5 h 到2.5 h 之间出现降解产物,在空白人工胃液NE 中没有任何变化。据此推断,胃蛋白酶是影响灯盏花乙素稳定性的主要因素。
情况三:药物在人工胃、肠液和人工胃、肠液NE中均不稳定,且二者对药物稳定性的影响基本相同,即可推断影响稳定性的最主要因素是胃液pH。马剑敏等[14]以此方法处理过辣根氧化物酶,并于不同时间点取样,结果标准人工胃液与人工胃液NE 对HRP 稳定性的影响基本相同,反映出胃液pH 是影响HRP 稳定性的主要因素;汪景长等[15]研究超氧化物歧化酶在模拟胃肠道中稳定性时以同样的方法反映出天然超氧化物歧化酶对胃蛋白酶具有较强的耐受力,对其稳定性最直接的影响可能是由胃酸造成的。
情况四:人工胃、肠液对药物稳定性的影响比人工胃、肠液NE 的大,即可推断胃、肠pH 及消化酶均对药物稳定性有影响。叶盛英等[16]以此方法研究重组人表皮生长因子在人工胃液和肠液中的稳定性,发现人工胃、肠液和人工胃、肠液NE 对重组人表皮生长因子的稳定性均有影响,且酶存在时重组人表皮生长因子的降解更明显,反映了胃、肠液pH和蛋白酶对重组人表皮生长因子的稳定性均有影响。米坤等[17]对芽孢杆菌纤溶酶进行稳定性的研究,发现芽孢杆菌纤溶酶在人工胃液和人工胃液NE中活性均下降,且在人工胃液中失活率更高,所以人工胃液的强酸性及胃蛋白酶的存在对芽孢杆菌纤溶酶的稳定性均有影响。
2.4 胃液-肠液整体分析
若需要更详细了解药物在整个胃肠道消化吸收中的稳定性,可使用人工胃液和人工肠液串联式的研究方法,即将人工胃液处理后的产物转移至人工肠液中继续反应。例如王玉蓉等[18]在肠安康胶囊的体外释药考察研究中,将人工胃液处理后的肠安康胶囊转移至人工肠液中,更准确得知药物在人工胃液中1 h 后约释放药物17%左右,在人工肠液中5 h 后基本释药完全;Lee BJ 等[19]以同样的方法,发现药物在二者中的释药情况完全不一样,药物在胃液中释放平稳,却在肠液中线形释放。McDougal GJ[20]、Kerstin F[21]等也有类似研究,较为完整系统地评价了药物在消化过程中的稳定性,更有效地指导药物制剂开发。
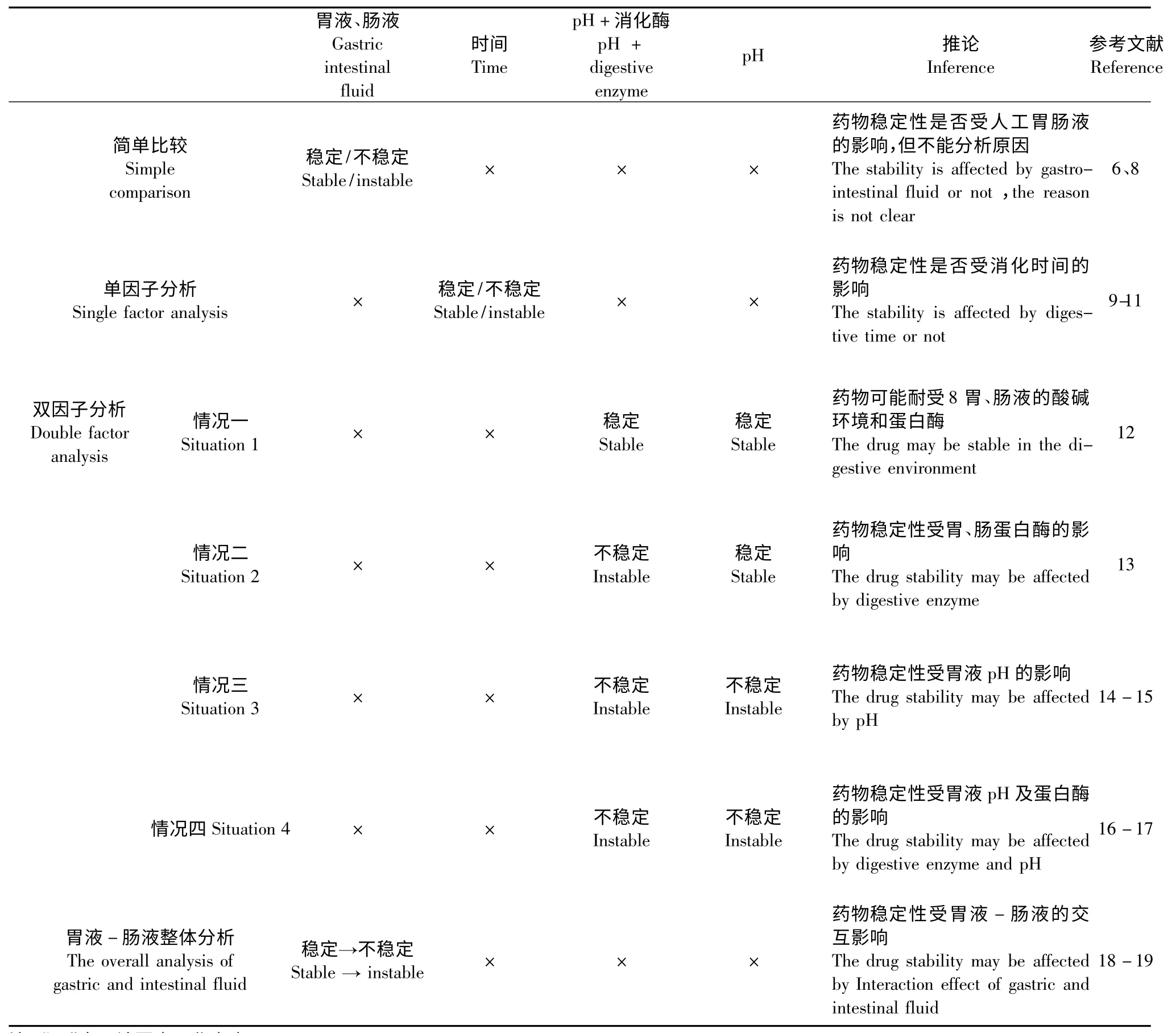
表1 常用的实验设计方法Table 1 Commonly used experimental designs
3 人工胃肠液模型的应用
口服药物在胃肠道中的稳定性将直接影响药物的吸收。人工胃肠液模型在新药开发中可针对上述影响因素,指导新药或新剂型的开发,以提高药物的稳定性,方法主要包括制备该药物的前药和改良剂型。除此以外,还可以对胃肠道内产生的代谢产物做简单分析。
3.1 指导前药的制备
通过药物的稳定性研究,可以指导前药的设计。胃液的强酸性环境是引起抗生素类药物失效的主要因素,把它们制备成前药是增强其稳定性的主要方法。例如红霉素在酸性溶液中也容易分解失效,因此将红霉素制成难溶性的酯[22]。除抗生素类药物外,某些药物也可以进行衍生化而提高其稳定性。伍妍俊等[8]研究甲基化的EGCG 在人工胃肠液中的稳定性,结果EGCG4dMe 由于甲基化,稳定性提高。
3.2 指导剂型的改良
通过药物的稳定性研究,可针对性地对现有剂型进行改良,提高药物的吸收率。若肠道环境是影响其稳定性的主要因素,那么可将其设计成胃滞留片,例如Wei ZP 等[23]设计了一种胃滞留片以提高药物的稳定性。若胃肠道的作用时间是影响其稳定性的主要因素,那么可根据其起效的时间规律进行设计,例如茶碱在胃液中随作用时间延长降解率升高,但茶碱需在夜间有一定的吸收才能有效治疗疾病,因此Danckwerts MP 等[24]设计了一种三阶段释药的缓释片剂,该片剂能在肠液中稳定存在并持续释放茶碱。若胃肠液pH 和消化酶是影响稳定性的主因,那么可将其进行包衣以抵御酸碱环境和消化酶,例如蛋白质类药物易受胃肠道pH 和消化酶的影响,为解决这一问题,Nadia Rasool 等[25]用胰岛素作为模式药物,成功制备了能有效抵御胃液和消化酶的水凝胶包衣材料;Anal AK 等[26]以壳聚糖和藻酸盐作为包衣材料,设计了一种能有效抵御胃酸和胃肠道消化酶的丸剂。
类似的针对影响因素,提高药物的胃肠道稳定性的新剂型主要有环糊精包合物[27]、微球[28]、微乳[29]、肠溶剂[30]等。
3.3 代谢产物的检测
胃肠道是药物代谢转化的重要场所,人工胃肠液作为模拟体内的体外模型,虽不能完全代表体内消化情况,却也可能发生代谢反应,尤其是人工肠液。例如迷迭香酸在人工肠液中反应生成两个代谢产物,应用液相LC-MS 技术鉴定为丹参素和咖啡酸[31]。但也有体内在肠道发生代谢反应,而在人工肠液中不发生代谢的情况[32],因为大部分药物的代谢是由于肠内菌引起的[33,34],因此可考虑在人工肠液中加入肠内菌以更真实地模拟肠内代谢反应。
4 现行方法存在的不足
仔细分析药物的胃肠道情况,方能正确指导制剂的开发,提高药物的稳定性,但目前药物在胃、肠液中稳定性因素的分析方法普遍存在以下四方面的不足:1.采用的单因子和双因子分析方法不够全面,没有考虑因子间可能产生的先后交互作用,各因素可能以先后顺序对药物稳定性产生影响。例如汪景长等[35]发现天然结构的超氧化物歧化酶先经过胃液的酸化才能被消化酶降解,而传统的分析方法只能得出影响因素是pH 和消化酶;2.胃肠道作用时间设计较随意,没有根据胃、肠的生理情况进行设计。综述的文献显示:人工胃液的作用时间少则5 min,多则可达24 h;人工肠液的作用时间少则10 min,多则也可达24 h,而且部分时间的设计跨度较大,取样点多,大大增加了工作量而无实际意义;3.大部分实验没有对胃、肠液pH 进行设计。正常情况下,人体胃液的pH 值范围是1~4,空腹时胃液pH 值可为0.9~1.5,饮水或进食后可上升到3.0~5.0,这些范围内的pH 值对某些药物的稳定性产生的影响是不一样的。例如张明等[36]用不同pH 的人工胃液处理非厌氧下HJ9211 冻干双歧杆菌,结果表明双歧杆菌在pH 为2~3 时失活率较接近,pH为1 时失活很明显。4.传统的分析方法没能考虑胃肠道蠕动的情况。肠胃蠕动有助于磨碎食物并将其逐步向后推移,体外试验虽难以实现,但简单的震荡搅拌也有很好的模拟效果,不同的搅拌速度可模拟肠胃的蠕动情况。因此,胃肠道蠕动也应作为考察因素,目前已有少数实验将人工胃肠液结合搅拌更真实地模拟体内消化[37-39],只是设计有待改善。
5 展望
综述各文献后,本文认为可以采用析因设计[40]的实验方法对影响药物稳定性的四个主要因素进行分析。其优点是效率更高、可评估因子间的交互作用。除此以外,根据胃肠道的生理条件,小肠对药物的吸收程度远远大于大肠,因此主要以小肠的生理条件为依据对消化液pH 值和消化时间[41,42]进行设计,调整搅拌器速度以模拟肠胃蠕动[37],方案见表2、3。若最后发现所研究药物在肠液中不稳定,需要在胃液中提高吸收,可对人工胃液的作用时间进行调整,根据的是胃滞留片[43]的一般作用时间,可设为8、12、16、20、24 h。
本试验涉及四个试验因素:消化酶、时间、pH 和搅拌速度,观察指标为降解率,可采用SPSS 软件进行多因素方差分析,将四个因素对降解率影响的主次关系进行分析,可得到多个因素单独作用和交互作用的信息。

表2 人工胃液中影响药物降解的因素分析Table 2 The influence factors of gastric fluid in the drug degradation
表3 人工肠液中影响药物降解的因素分析Table 3 The influence factors of intestinal fluid in the drug degradation
长期以来,人工胃肠液模型主要用于药物的稳定性研究,但本文认为其也可应用于中药和天然产物活性成分的筛选。中药和天然药物多口服且成分复杂,一般而言,其在胃肠道稳定存在的成分才可能吸收入血、发挥药效。筛选中药和天然药物中消化稳定的成分,将缩小研究范围,再进行针对性分离、鉴定和活性筛选,将提高筛选的成功率。
1 Qiu S,et al.Effect of 1-MCP on quality and antioxidant capacity ofin vitrodigests from Sunrise'apples stored at different temperatures.Food Res Int,2009,42:337-342.
2 Biehler E,Bohn T.Methods for assessing aspects of carotenoid bioavailability.Curr Nutri Food Sci,2010,6:44-69.
3 Gil-Izquierdo A,et al.Influence of industrial processing on orange juice flavanone solubility and transformation to chalcones under gastrointestinal conditions.J Agric Food Chem,2003,51:3024-3028.
4 Bermúdez-Soto MJ,et al.Stability of polyphenols in chokeberry (Aronia melanocarpa)subjected to in vitro gastric and pancreatic digestion.Food Chem,2007,102:865-874.
5 Rufián-Henares JA,Morales FJ.Effect ofin vitroenzymatic digestion on antioxidant activity of coffee melanoidins and fractions.J Agric Food Chem,2007,55:10016-10021.
6 Shang XY(尚晓娅),et al.The digestion research of starchin vitro.Sci Technol Food Ind(食品工业科技),2007,5:218-220.
7 Hu SW,et al.Integrity and stability of oral liposomes containing bile salts studied in simulated and ex vivo gastrointestinal media.Int J Pharm,2013,441:693-700.
8 Wu YJ(伍妍俊),et al.Synthesis of methylated EGCG and its stability in artificial simulation gastric juice and artificial simulation intestinal juice.J Anhui Agric Univ(安徽农业大学学报),2010,37:688-691.
9 Jin H(金晖),et al.Pumpkin polysaccharidein vitrosimulator under artificial gastric juice.Food Sci Technol(食品科技),2012,37:178-181.
10 Zhou Y(周园),et al.Studies on the stability of nicotinyl salicylic acid in gastric juice,intestinal juice and plasmainvitro.J Shihezi Univ(石河子大学学报,自科版),2005,23:299-301.
11 Xian XM(冼小敏),et al.Study on degradation of protein of the edible birds nest (Aerodramus)in vitro.Chin Med Mat(中药材),2010,33:1760-1763.
12 Chen GQ(陈国庆),et al.Stability research of tetraacetylpuerarin in artificial gastric juice and intestinal juice.Lishizhen Med Mater Med Res(时珍国医国药),2010,21:1709-1710.
13 Rong NN(荣娜娜),et al.Study the stability of Scutellarin on simulated gastric fluid and simulated intestinal fluid.J Yunnan Univ TCM(云南中医学报),2011,34(5):30-33.
14 Ma JM(马剑敏),et al.The stability of HRP in simulated conditions of human stomach and intestine.J Henan Norm Univ(河南师范大学学报,自然科学版),2002,12(5):28-29.
15 Wang JC(汪景长),et al.A study on stability of superoxide dismutasein simulated conditions of human stomach and intestines.J Shanghai Jiaotong Univ(上海交通大学学报),1995,29:153-157.
16 Ye SY(叶盛英),et al.Stability of recombinant human epidermal growth factor in artificial intestinal juice and gastric juice.Acade J Second Mil Med Univ(第二军医大学学报),2003,24:810-811.
17 Mi K(米坤),et al.Study on the stability of fibrinolytic enzyme from Bacillus.J Sichuan Univ,Nat Sci Ed(四川大学学报,自科版),2004,41:852-855.
18 Wang YR(王玉蓉),et al.Investigation of the drug release of pH-dependent Changankang capsulesin vitro.J Beijing Univ TCM(北京中医药大学学报),2004,27:36-38.
19 Lee BJ,et al.Biphasic release characteristics of dual drugloaded alginate beads.Arch Pharm Res,1998,21:645-650.
20 McDougall GJ,et al.Anthocyanins from red wine -Their stability under simulated gastrointestinal digestion.Phytochemistry,2005,2540-2548.
21 Kerstin F,et al.Stability of anthocyanin-rich W/O/W-emulsions designed for intestinal release in gastrointestinal environment.J Food Sci,2012,77:50-57.
22 Liu JP(刘建平).Biopharmaceutics and Pharmacokinetics(生物药剂学与药物动力学).Beijing:People’s Medical Publishing House,2011:39.
23 Wei ZP,et al.Design and evaluation of a two-layer floating tablet for gastric retention using cisapride as a model drug.Drug Dev Ind Pharm,2001,27:469-474.
24 Danckwerts MP.Optimization and development of a core-in-cup tablet for modulated release of theophylline in simulated gastrointestinal fluids.Drug Dev Ind Pharm,2000,26:767-772.
25 Rasool N,et al.Synthesis and characterization of novel pH-,ionic Strength and temperature-sensitive hydrogel for insulin delivery.Polymer,2010,51:1687-1693.
26 Anal AK,et al.Chitosan-alginate multilayer beads for gastric passage and controlled intestinal release of protein.Drug Dev Ind Pharm,2003,29:713-724.
27 He FC(何凤慈),et al.Preparation of slowly released microspheres of dextro-ketoprofen-B-cyclodextrin inclusion.Acta Acade Med Milit Tertiae(第三军医大学学报),2004,26:1655-1657.
28 Zhang YH(张艳华),et al.Preparation andin vitroevaluation of chitosan microspheres containing matrine.Chin Hosp Pharm J(中国医院药学杂志),2006,26:307-310.
29 Attama AA,Nkemnele MO.In vitroevaluation of drug release from self micro-emulsifying drug delivery systems using a biodegradable homolipid fromCapra hircus.Int J Pharm,2005,304(1-2):4-10.
30 Qi XL(祁小乐),et al.Preparation of tablets containing enteric-coated diclofenac sodium pellets.Acta Pharm Sin(药学学报),2008,43:97-101.
31 Sun SF(孙士丰).The metabolism research of the rosemary acid inSalvia miltiorrhiza.J Heilongjiang Univ TCM(黑龙江中医药大学),PhD.2008.
32 Li WL(李文兰),et al.Metabolism of butylbenzyl phthalate in creatural organs.J Harbin Inst Technol(哈尔滨工业大学学报),2005,37:1674-1677.
33 Tang R(谭锐),et al.A comparative study of ephedra soup metabolism in the body.Chin Med Pharmacol Clinic(中药药理与临床),2002,18(2):1-4.
34 Chen XM(陈新梅).Experimental study on metabolism and bio-transformation of ginsenoside Rgl by intestinal enzyme and microflora in rats.Chin J Exp Tradit Med Form(中国实验方剂学杂志),2011,17:210-212.
35 Wang JC(汪景长),et al.A study on stability of superoxide dismutasein simulated conditions of human stomach and intestines.J Shanghai Jiaotong Univ(上海交通大学学报),1995,29:153-157.
36 Zhang M(张明),et al.Survival property of freeze-dried bifidobacterium HJ9211 in non-anaerobic condition.J East China Univ Sci Technol(华东理工大学学报),1999,25:36-38.
37 Song L(宋力),Ping QN(平其能).Study on the stability of 5-aminosalicylyl-glycine in the gastrointestinal tract.Chin J Biochem Pharm(中国生化药物杂志),2003,24:294-296.
38 Peng Y,et al.A protease-resistant exo-polygalacturonase fromKlebsiellasp.Y1 with good activity and stability over a wide pH range in the digestive tract.Biores Technol,2012,123:171-176.
39 Bumsang K,Peppas NA.In vitrorelease behavior and stability of insulin in complexation hydrogels as oral drug delivery carriers.Int J Pharm,2003,266:29-37.
40 Berecz B,et al.Stability of sunflower 2S albumins and LTP to physiologically relevantin vitrogastrointestinal digestion.Food Chem,2013,138:2374-2381.
41 Fu YS(傅钰生),et al.Design and analysis of experiments(实验设计与分析).Beijing:Posts & Telecom Press,2008:152.
42 Graff J,et al.Grastrointestinal mean transit times in young and middle-aged healthy subjects.Clin Physiol,2001,21:253-259.
43 Shi XJ(施祥杰),Zhou JP(周建平).Current advances in gastro-retentive drug delivery system.Progr Pharm Sci(药学进展),2010,34(2):55-60.
