热诱导对麦醇溶蛋白/芦丁相互作用及其乳液流变学特性的影响
2020-09-17李春翼王启明唐瑜婉张宇昊赵吉春
李春翼,王启明,唐瑜婉,张宇昊,赵吉春,2,明 建,2,
(1.西南大学食品科学学院,重庆 400715;2.西南大学食品贮藏与物流研究中心,重庆 400715)
麦醇溶蛋白是小麦面筋蛋白的主要成分之一,是评价小麦粉优劣的主要指标。它富含脯氨酸,具有两亲性,醇溶蛋白能够自我组装产生各种形式的胶体结构(如纳米/微米颗粒),麦醇溶蛋白颗粒已被用于功能成分的包封和稳定水包油型Pickering乳液[1]。芦丁具有优异的抗菌性和抗氧化性,对人体健康有益,其在荞麦中含量丰富。此外,芦丁在水溶液中以不溶性颗粒的形式存在,由于其亲水性和表面活性,易吸附在油水界面上,可作为Pickering乳液中的稳定剂。众所周知,富含脯氨酸的蛋白质和多酚之间具有独特的相互作用,在实际的生产加工过程中,荞麦与小麦的混合食用,不可避免地存在食品组分间复杂的相互作用从而形成复合颗粒结构,对食品体系的理化性质产生影响,已有研究表明麦醇溶蛋白与芦丁具有强烈的相互作用[2]。
加热处理是工业生产中比较常见操作,具有简单方便、经济高效的优势,也是食品加工中常见的不可避免的环节。蛋白经过热处理后稳定分子构象的平衡遭到破坏,因此造成蛋白质共价键、次级键发生改变,致使蛋白质分子之间发生疏水聚集,生成聚集体,结构发生变化,影响食品的功能性质包括蛋白的流变学性质[3]。热处理容易导致芦丁的大量损失,为了防止损失,蛋白质与多酚通过不同化学键形成复合物,多酚通过改变蛋白理化性质而稳定下来,如乳化、起泡和二级结构的变化以及界面性质[4-6]。Kaur等[7]研究报道了高温对β-酪蛋白与对香豆酸的结合,结果表明β-酪蛋白的二级结构由有序向无序结构转变,更易与酚类配体结合。Chen Zhongqin等[8]研究发现经过预热的大豆分离蛋白(soy protein isolate,SPI)与花青素-3-O-葡萄糖苷的相互作用能有效地保护花青素的稳定性。Zhang Yan等[9]发现SPI与富含花青素的黑米提取物的络合作用提高了未加热SPI和加热SPI的消化率。然而关于加工条件下麦醇溶蛋白与芦丁相互作用机理探讨,特别是芦丁影响麦醇溶蛋白功能性质的文献鲜见报道。
本研究通过反溶剂法制备麦醇溶蛋白-芦丁的复合物,旨在评估温度处理麦醇溶蛋白-芦丁复合物后与大豆油制备的乳液流变学性能的影响。研究结果将为麦醇溶蛋白的合理利用,Pickering乳液的制备提供一种新的思路,以期指导小麦粉及荞麦粉类产品的加工生产。
1 材料与方法
1.1 材料与试剂
麦醇溶蛋白 美国Sigma公司;芦丁 北京索莱宝科技有限公司;大豆油 九三粮油工业集团有限公司;其他试剂均为分析纯。
1.2 仪器与设备
ZEN3690激光粒度分析仪 英国马尔文仪器公司;LGJ-10真空冷冻干燥机 北京松原华兴科技有限公司;HH-6数显恒温水浴锅 金坛市富华仪器有限公司;F-2500荧光分光光度计 日本日立公司;MCR302流变仪奥地利安东帕公司;Spectrun100红外光谱仪 美国PerkinElmer公司;BX53荧光正置显微镜 日本Olympus公司;Phenom Pro扫描电子显微镜(scanning electron microscope,SEM) 荷兰Phenom Pro公司;LSM800激光共聚焦显微镜(confocal laser scanning microscope,CLSM) 德国卡尔蔡司公司。
1.3 方法
1.3.1 复合物的制备
参考文献[10]的方法,利用反溶剂法制备纳米复合物,分别将麦醇溶蛋白、芦丁分散于10 mmol/L乙酸与60%乙醇溶液中,以1∶1的体积比混合后逐滴滴入去离子水中,使终蛋白质量浓度为0.25 mg/mL,多酚质量浓度为0.025 mg/mL。样品于25、60、80、100 ℃水浴加热30 min后冰水浴冷却至室温。
1.3.2 荧光光谱
吸取1 mL 1.3.1节制备好的样液于荧光比色皿中,采用荧光分光光度计进行实验测定。测量条件:激发波长282 nm,发射光谱波长范围300~500 nm,电压400 V,激发狭缝与发射狭缝均为5.0 nm。
1.3.3 傅里叶变换红外光谱(Fourier transform infrared spectrum,FTIR)
准确称量1 mg冻干的麦醇溶蛋白与多酚复合物固体样品以及50 mg KBr于玛瑙研钵中研磨均匀,压片成膜。测定条件:扫描波数4 000~500 cm-1,扫描次数为32 次,分辨率为4 cm-1,平行测定3 次,光谱数据使用OMNIC 8.2进行软件处理。
1.3.4 表面疏水性
参考文献[11]的方法测定。吸取1 mL样品于离心管中,加入200 μL 1 mg/mL溴酚蓝溶液,涡旋混匀后在8 000 r/min离心10 min,将所得上层清液用去离子水稀释10 倍后于595 nm波长处测定吸光度A。表面疏水性计算公式如下:
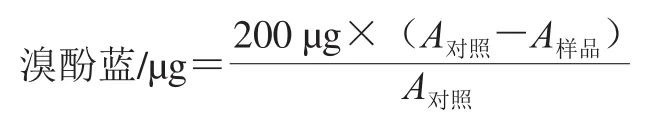
1.3.5 SEM分析
取适量真空冷冻干燥后的麦醇溶蛋白-芦丁复合物试样,在10 kV加速电压条件下通过SEM扫描,观察被测样品的微观结构差异。
1.3.6 乳液制备
不同温度处理后的麦醇溶蛋白溶液以及麦醇溶蛋白-芦丁复合物溶液分别与大豆油以体积比5∶9混合后使用高速分散机在10 000 r/min的转速下均质分散3 min。
1.3.7 乳液电位
1.3.6 节制备的乳液用纯水稀释50 倍后,加入Zeta电位样品池中,选择Nano-ZS 90 Malvern粒径分析仪,25 ℃测定试样的Zeta电位,每个样品重复测定3 次。
1.3.8 光学显微镜
取10 μL乳液滴于干净载玻片上,盖上盖玻片后,放置于光学显微镜下,在10 倍目镜、40 倍物镜的条件下,观察拍照。
1.3.9 CLSM分析
乳状液样品(1 mL)与20 μL尼罗蓝(1 mg/mL)和尼罗红20 μL(1 mg/mL)的荧光染料混合物混合。涡旋混合均匀后将混合物放置于凹面共焦显微镜载玻片上,用盖玻片覆盖,在50 倍放大镜,激发线为488 nm的氩/氪激光和激发波长为633 nm的He-Ne激光器条件下观察。
1.3.10 流变学特性
使用直径为50 mm的平行板,间隙设为0.104 mm。剪切速率范围为0.1~100 s-1以对数变化规律扫描黏度曲线;固定频率为1 Hz,剪切应变起始值0.001%,最终值1 000%,使剪切应变以对数变化规律进行振幅扫描;固定振幅0.5%,以对数变化规律从0.01~10 Hz范围进行频率扫描。
1.4 数据统计及分析
每组数据3 次重复,利用Origin 9.0软件处理数据与作图。使用SPSS 19.0软件对数据进行ANOVA差异显著性分析与t检验。
2 结果与分析
2.1 内源荧光分析
荧光猝灭是一种光谱方法,蛋白质由于与猝灭剂的分子相互作用而导致其荧光强度降低,已被广泛用于研究蛋白质与多酚的相互作用。蛋白质内在荧光主要来源于色氨酸和酪氨酸残基。
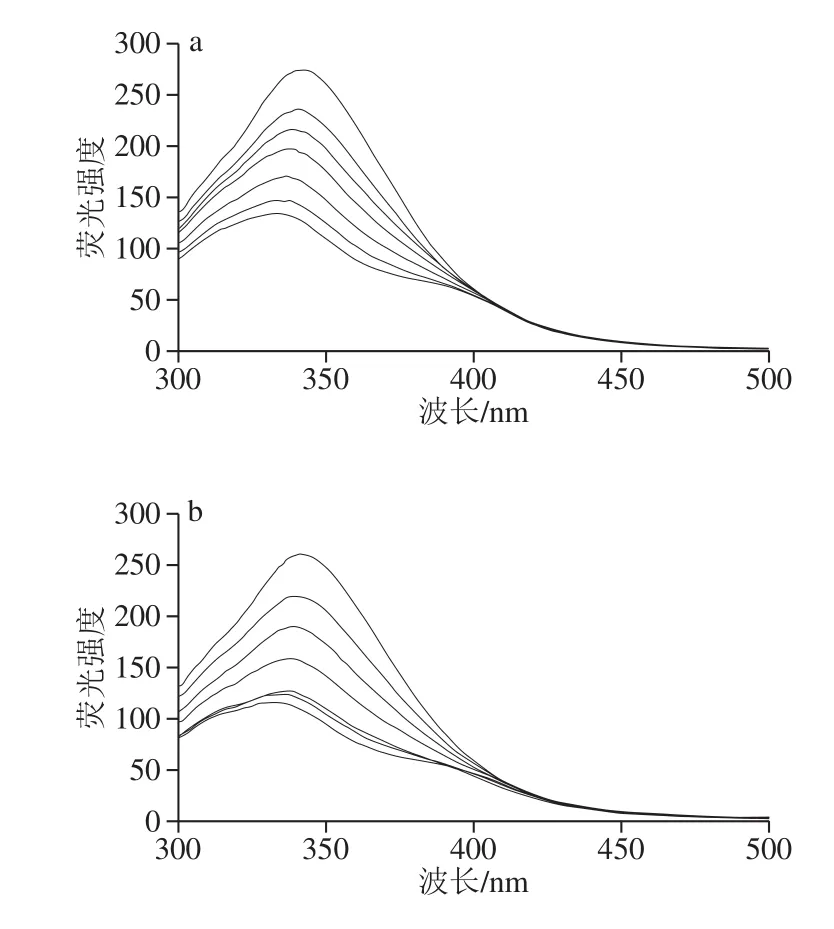
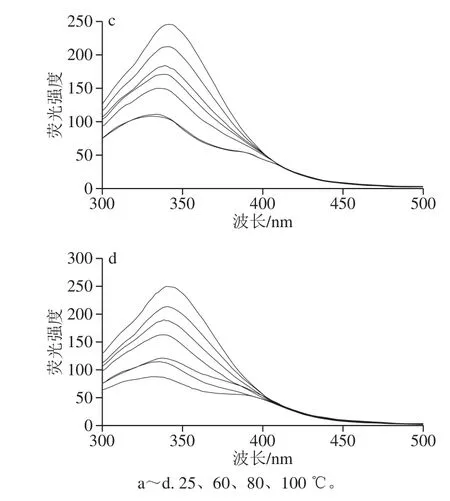
图1 荧光猝灭光谱图Fig.1 Fluorescence quenching spectra
如图1所示,不同温度处理后,麦醇溶蛋白与芦丁复合物的荧光强度随着多酚浓度的增加而降低,这可能是由于芦丁对麦醇溶蛋白的猝灭作用,说明麦醇溶蛋白与芦丁之间存在相互作用。未经温度处理的麦醇溶蛋白荧光发射最大值(λm)为342.5 nm。芦丁的加入引起了麦醇溶蛋白λm的蓝移,表明Trp生色团的微环境变得更加疏水,其他研究也有类似的结果[12]。随着加工温度的升高,荧光强度基本呈下降趋势。这一现象可以解释为热处理增强了蛋白与芦丁芳香环的疏水作用,导致Trp荧光的强猝灭作用[13]。
小分子与蛋白质在反应、能量转移、络合物形成和碰撞猝灭等过程中可对蛋白质产生荧光猝灭作用,发生荧光猝灭机理大致可分为静态猝灭和动态猝灭[14]。Stern-Volmer图中的线性范围可用于确定静态或动态猝灭机制。对于动态猝灭过程,猝灭常数随温度升高而增加,这是由于在较高温度下扩散和碰撞的频率较高,但形成了稳定性较低的配合物,会发生静态猝灭,并且静态猝灭常数随温度的升高而降低[15-16]。Stern-Volmer曲线和猝灭参数如图2和表1所示。
由图2可知,Stern-Volmer曲线部分呈非直线关系(R2<0.98),表明热加工处理下芦丁对麦醇溶蛋白的猝灭并非主要由动态猝灭,可能是由猝灭剂与荧光体分子间形成复合物的静态猝灭[17]或者静态和动态猝灭共同存在[18]的猝灭导致。由表1可看出,芦丁与麦醇溶蛋白在不同热处理条件下的Ksv并不是随着温度的升高而增大,有些呈现出随温度升高而降低的趋势;Kq值约为1.0×1012L/(mol·s),大于最大动态猝灭速率2.0×1010L/(mol·s),说明麦醇溶蛋白与芦丁之间存在复杂的静态猝灭[19]。结合位点数n均在1左右,表明麦醇溶蛋白均提供一个位点与芦丁结合形成复合物。
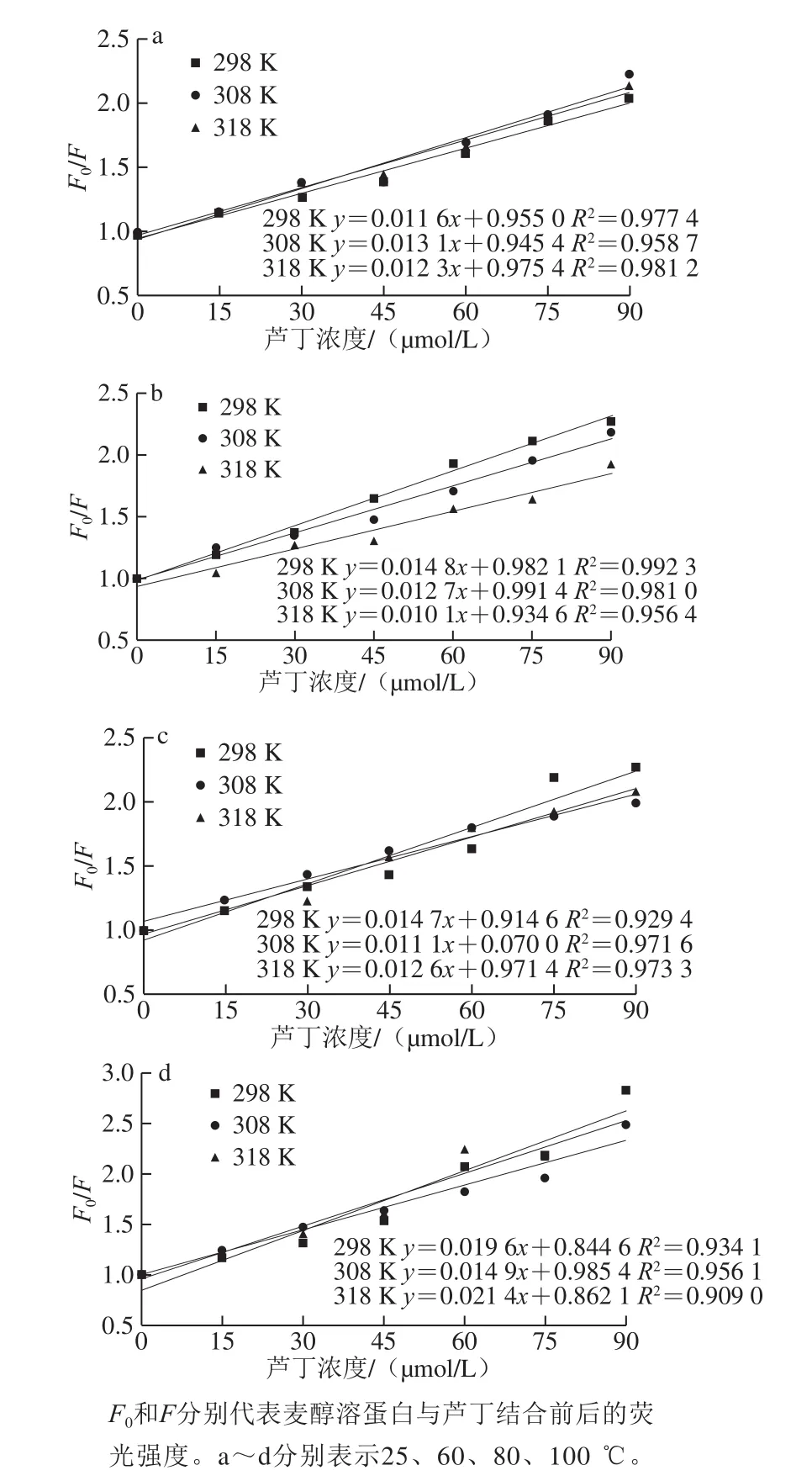
图2 不同温度下麦醇溶蛋白与芦丁相互作用的Stern-Volmer曲线Fig.2 Stern-Volmer curves for fluorescence quenching of gliadin by rutin with different heat treatment temperatures at 298, 308 and 318 K
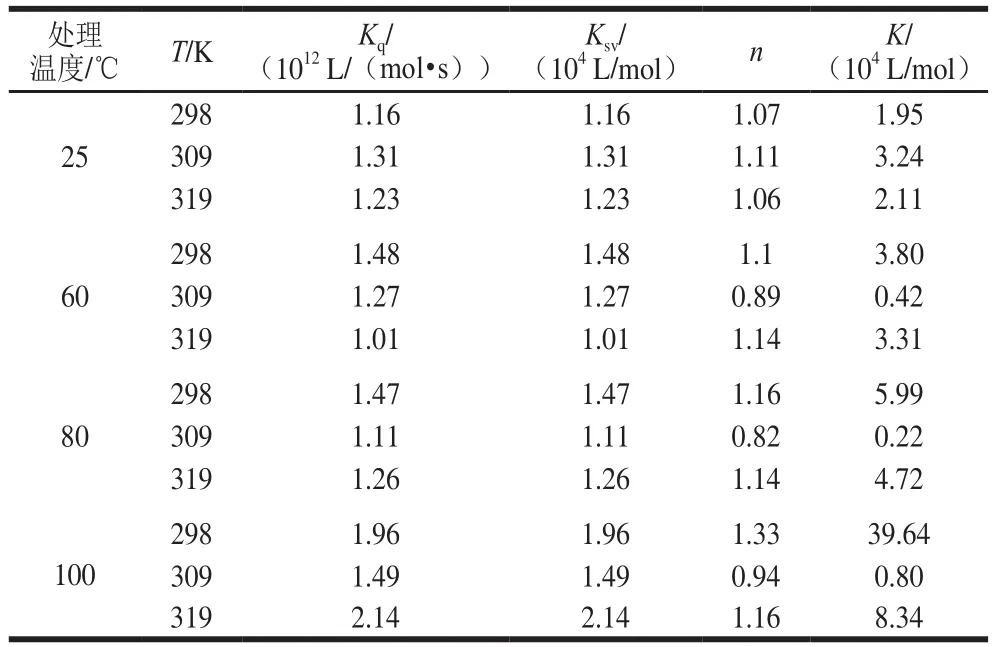
表1 不同温度下麦醇溶蛋白与芦丁的猝灭参数、结合常数以及结合位点Table 1 Quenching parameters, binding constants and binding sites of gliadin with rutin at different heat treatment temperatures
2.2 FTIR分析
蛋白质的红外干涉图具有不同的酰胺区域,可反映多肽链的不同振动,其中酰胺I带(1 700~1 600 cm-1,主要由肽链的C=O拉伸振动引起)和酰胺II带(1 600~1 500 cm-1,起源于C—N拉伸振动和N—H弯曲)对样品的分析鉴定非常有用[7]。这2 个波段的光谱位移和强度变化可用来监测蛋白与多酚相互作用后蛋白质的二级结构变化[20]。
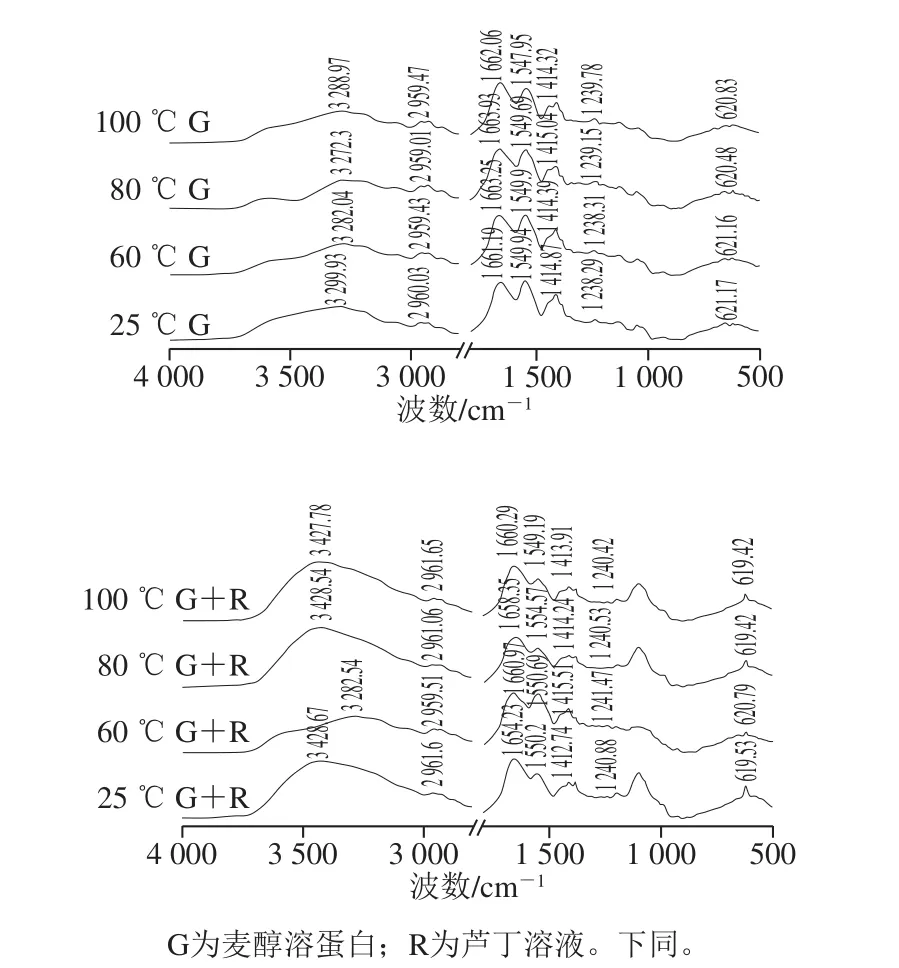
图3 不同温度下麦醇溶蛋白与芦丁相互作用的FTIR图Fig.3 FTIR spectra showing interaction between gliadin and rutin at different heat treatment temperatures
3 500 cm-1左右的宽频带表明O—H拉伸或N—H拉伸振动,这可能是由于游离和结合的O—H或N—H基团能够与蛋白质中肽链的羰基形成氢键[21]。光谱的谱带强度出现变化,可能是因为O—H或N—H基团的暴露,在蛋白中形成了氢键。如图3所示,温度处理后麦醇溶蛋白酰胺I带的变化趋势由1 661.19、1 663.25、1 663.93、1 662.06 cm-1,与芦丁形成复合物后,酰胺I带的随着温度的升高变化趋势为从1 654.23 cm-1变为1 660.97、1 658.35、1 660.29 cm-1,说明热处理引起了麦醇溶蛋白二级结构变化。温度处理后麦醇溶蛋白以及其与芦丁复合后酰胺I和II带的强度减少,表明蛋白质结构中的α-螺旋含量降低[22]。由酰胺I带分析二级结构结果可知(图4),未经热处理的麦醇溶蛋白的二级结构中β-折叠含量最高,随着热处理温度的升高,蛋白质二级结构中各组分含量的变化比较复杂,α-螺旋与无规卷曲的含量有所降低。光谱结果表明芦丁可能与麦醇溶蛋白的疏水空腔结合,这导致了多肽羰基氢键网络的重排和麦醇溶蛋白α-螺旋结构的还原。这可能是由于复合物在不同温度下的结构变化不同,进而对芦丁产生不同的稳定作用[8]。
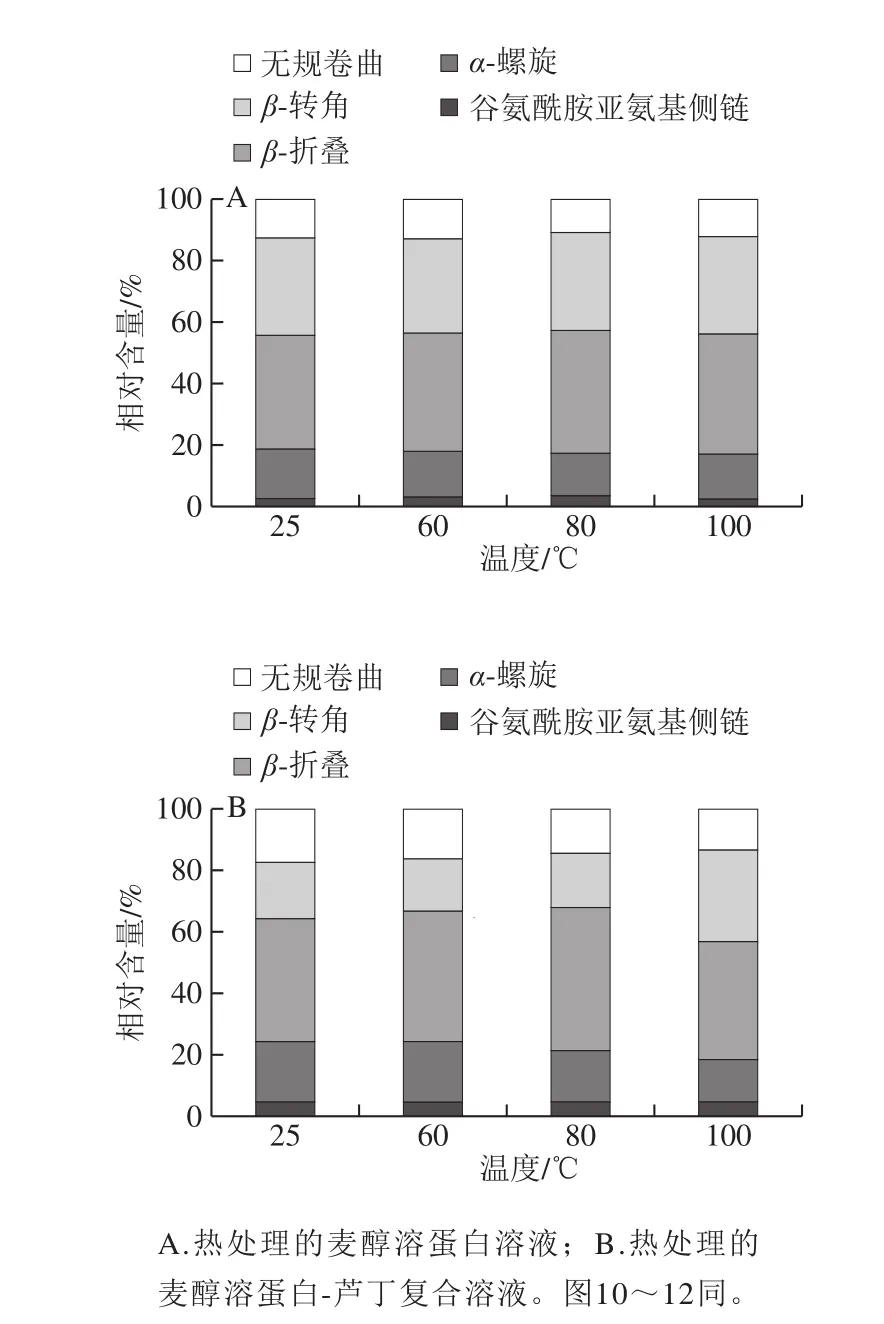
图4 不同温度下麦醇溶蛋白与芦丁相互作用的二级结构Fig.4 Secondary structures of gliadin interacting with rutin at different heat treatment temperatures
2.3 表面疏水性
蛋白质的表面疏水性是蛋白质表面与极性溶剂接触的疏水基团数量的指标[23]。加热导致变性蛋白热聚集,使疏水基团逐渐埋藏于蛋白质疏水腔内部,进而使得表面疏水性随着温度的升高而减小。由图5可知,加热处理后麦醇溶蛋白的表面疏水性除60 ℃处理无显著性差异以外,其余条件均显著降低。芦丁的加入使得表面疏水性增加,这与荧光发射光谱的分析结果一致。温度处理后麦醇溶蛋白-芦丁复合物的表面疏水性显著降低,60 ℃与80 ℃处理的复合物表面疏水性无显著性差异。
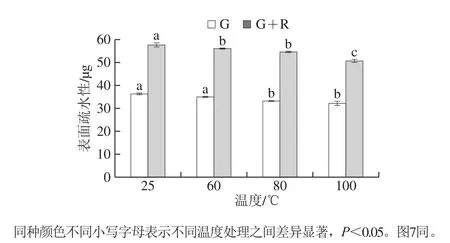
图5 不同温度下麦醇溶蛋白与芦丁相互作用的表面疏水性Fig.5 Surface hydrophobicity of gliadin interacting with rutin at different heat treatment temperatures
2.4 SEM分析
样品经冷冻干燥冻干后会形成裂纹或气孔。从图6可知,随着温度的升高,观察到疏松多孔结构,可能是由于蛋白质变性形成明显的蛋白质交联[24],由于芦丁与麦醇溶蛋白之间的相互作用使得复合物相较麦醇溶蛋白的电镜图像有明显的区别。不同温度下复合物均呈现致密多孔的蜂窝状结构,随着温度的升高,孔隙变大。相比较而言,其中麦醇溶蛋白-芦丁复合物经过80 ℃处理后的SEM图像致密多孔,呈现蜂窝状,说明其物理截留作用良好[25]。结果表明芦丁的加入以及经过不同温度处理导致了麦醇溶蛋白结构发生了变化。
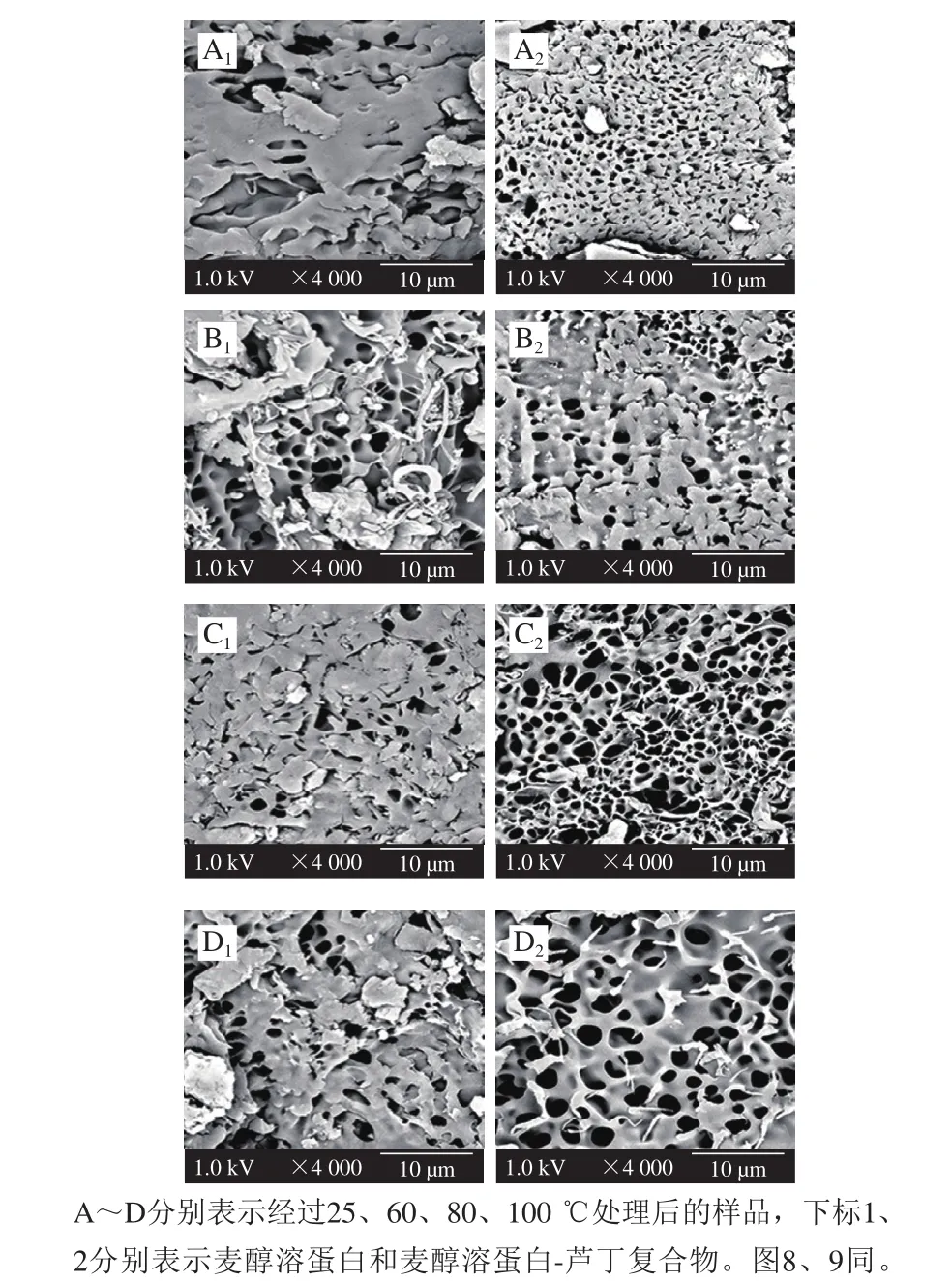
图6 不同温度下麦醇溶蛋白与芦丁复合物的SEM图Fig.6 Scanning electron micrographs of gliadin-rutin complex at different heat treatment temperatures
2.5 乳液电位
乳液的电位能反映稳定性的大小,正电位值表示乳化液滴表面周围的正离子分子[26],如图7所示,绝对Zeta电位值显著升高(P<0.05),表明其电负性更强。麦醇溶蛋白经过适当的温度处理(60、80 ℃)在乳状液滴之间提供高能量屏障,从而提供良好的静电斥力,可显著提高稳定性,100 ℃麦醇溶蛋白与未经温度处理稳定的乳液电位无显著性差异。复合物稳定的乳液电位较麦醇溶蛋白颗粒稳定的乳液电位高,说明芦丁与麦醇溶蛋白形成复合物后能提高乳液的稳定性,80 ℃条件下的乳液稳定性最高。
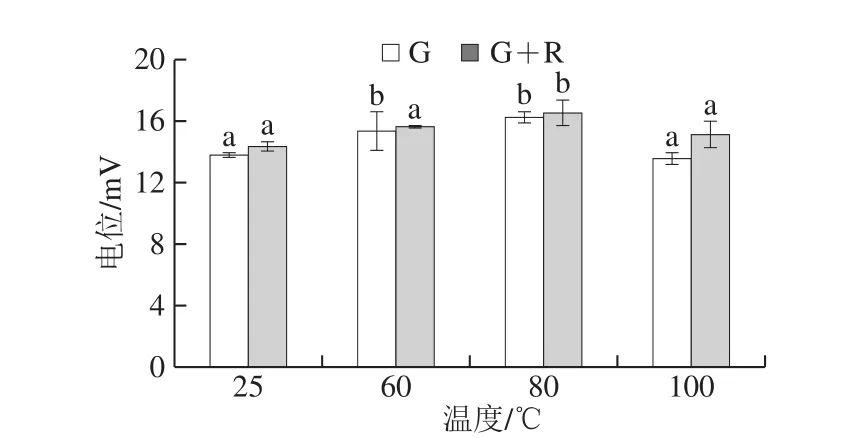
图7 不同温度下麦醇溶蛋白与芦丁复合物稳定的乳液电位Fig.7 Potential of emulsions stabilized with gliadin and its complex with rutin at different heat treatment temperatures
2.6 光学显微镜
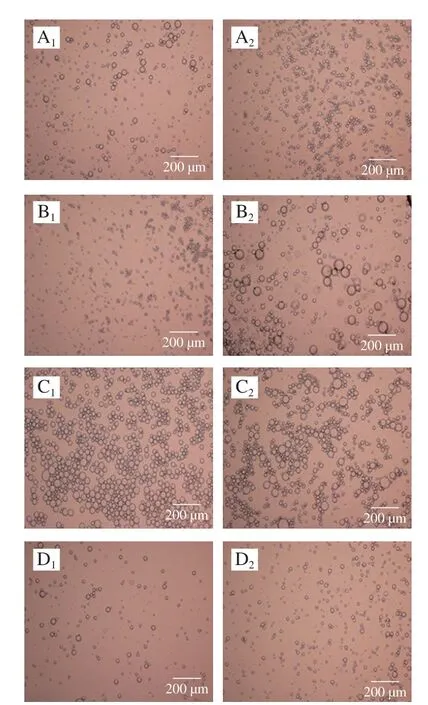
图8 不同温度下麦醇溶蛋白与芦丁复合物稳定的乳液光学显微镜图Fig.8 Optical microscope images of emulsions stabilized with gliadin and its complex with rutin at different heat treatment temperatures
由图8可知,温度对乳液的显微结构影响很大。60 ℃和80 ℃处理的溶液制得的乳化液体系液滴颗粒分布不均匀,出现明显聚集现象,100 ℃处理的样品乳化液的液滴颗粒较小,分散相比例增加,无明显液滴聚集现象。相较麦醇溶蛋白稳定的乳液,麦醇溶蛋白与芦丁形成复合物后稳定的乳液连续相占比减小,油滴数量增多。
2.7 CLSM分析
如图9所示,粒子出现在界面上提供界面粒子网络,这表明乳状液是由Pickering稳定剂稳定的,CLSM图像清楚地显示了不同温度处理下样品的不同结构。界面面积越大,液滴越小,形成的油滴网络越稳定[27]。麦醇溶蛋白及其与芦丁的复合物稳定的乳液经60、80 ℃处理后,界面吸附的蛋白含量增加,乳液稳定性提高,100 ℃处理后能够覆盖油滴表面的颗粒减少。因此,油滴变大,稳定性变低。
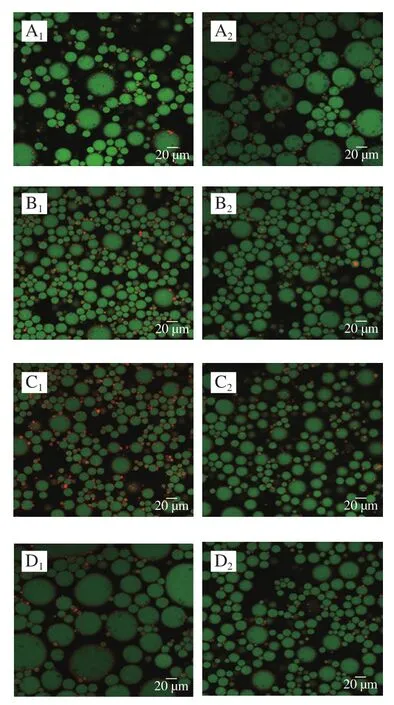
图9 不同温度下麦醇溶蛋白与芦丁复合物稳定的乳液CLSM图Fig.9 CLSM images of emulsions stabilized with gliadin and its complex with rutin at different heat treatment temperatures
2.8 黏度曲线
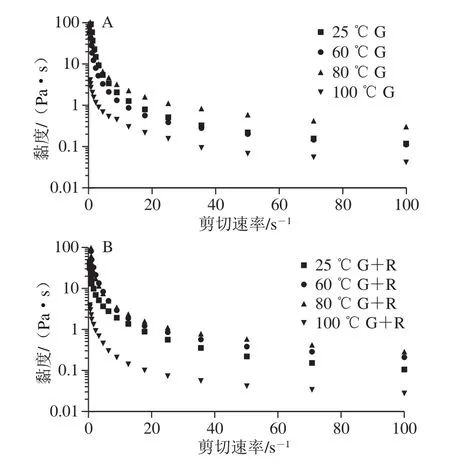
图10 不同温度下麦醇溶蛋白与芦丁复合物稳定的乳液黏度曲线图Fig.10 Viscosity curves of emulsions stabilized with gliadin and its complex with rutin at different heat treatment temperatures
明显的剪切稀化行为是乳液的一个典型特征,它与聚合乳液中剪切作用引起的絮凝体大小和形状的变化有关。由图10可知,适度的热处理(60、80 ℃)导致蛋白的表观黏度增加,表现出优越的黏弹性[28],热处理改性后蛋白产物的表观黏度由于热变性聚集,分子结构由原来有序变为无序,蛋白形状不规则、不对称性增大,蛋白分子间摩擦性增大,阻碍流动,表观黏度普遍增大,表现为剪切变稀的非牛顿流体性质[3]。100 ℃时表观黏度小于其他温度处理的乳液,这种行为可能是由于剪切过程中纠缠聚合物网络的断裂,其中分子间的分裂纠缠率大于重组纠缠率,使分子间流动阻力降低,表观黏度降低。
2.9 振幅扫描
在实际生产中,乳液的变形程度大且迅速,仅在小变形(线性黏弹性区)范围内进行表征,不足以从实际角度出发充分地探究乳液性质变化。因此有必要对样品进行振幅扫描,在低应变振幅下(应力<1%),储能模量G’大于损耗模量G”,两个模量几乎与小变形的应变无关。从图11可以看出,随着应变幅度的进一步增大,模量都开始减小且G’比G”下降得更快,随后观察到G’与G”交叉现象。由于粒子网络的结构破坏,乳状液表现出更具黏度优势的性能。交点预示结构破坏和流动特性的开始[29]。由图11可知,当温度达到100 ℃,乳液凝胶的强度不及其他实验组。
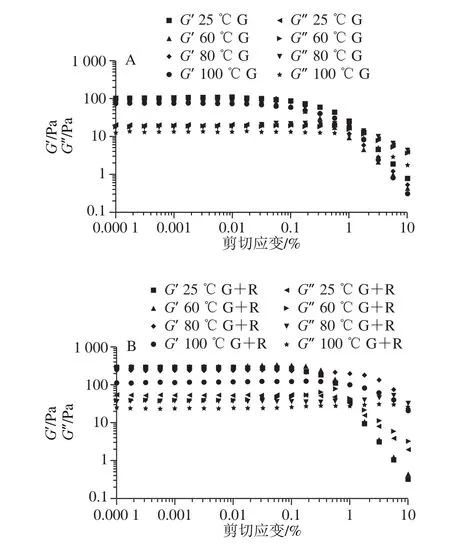
图11 不同温度下麦醇溶蛋白与芦丁复合物稳定的乳液振幅扫描图Fig.11 Amplitude sweeps of emulsions stabilized with gliadin and rutin gliadin rutin after thermal processing
2.10 频率扫描
G’大于G”表明弹性性能占主导地位,黏弹体系中的黏弹性性质,G’反映弹性行为,在频率扫描范围内,G’总是高于G”,这表明所有的样品都有凝胶状的性质,网络结构良好[27]。如图12所示,热处理后样品的凝胶弹性模量值都随频率的增大变大,表现为依赖于频率的流变学特性,经过60 ℃与80 ℃处理后的G’和G”逐渐增加,表明形成了较强的凝胶状结构。可能与蛋白质在其热变性温度附近的展开和聚集[30],连续相中,颗粒通过提供颗粒网络对凝胶性质有很大贡献。由于蛋白质包裹的油滴可以通过液滴界面吸附颗粒与连续相非吸附蛋白质之间的相互作用而形成凝胶网络,油滴在乳化凝胶网络中起到“活性填料”的作用,有助于加强凝胶网络。不同温度处理后的麦醇溶蛋白-芦丁复合颗粒稳定的乳液的G’和G”均大于同等温度处理的麦醇溶蛋白颗粒稳定的乳液,说明麦醇溶蛋白-芦丁复合物的凝胶性更强,芦丁起着重要的作用。100 ℃的G’均小于其余实验组,这与2.6节以及2.8节的结果一致。
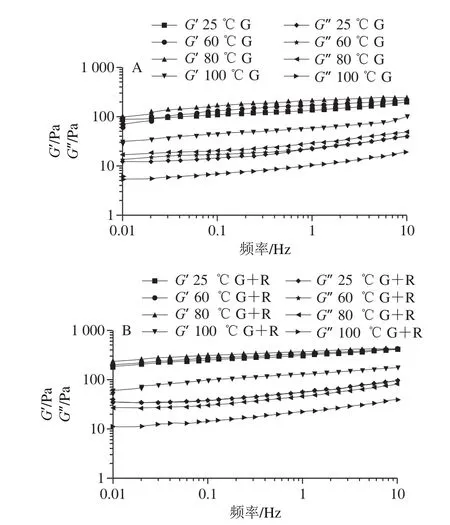
图12 不同温度下麦醇溶蛋白与芦丁复合物稳定的乳液频率扫描图Fig.12 Frequency sweeps images of emulsions stabilized with gliadin and its complex with rutin at different heat treatment temperatures
3 结 论
本实验所采用的温度处理能对麦醇溶蛋白以及蛋白与芦丁的复合物结构产生影响,热处理增强了麦醇溶蛋白与芦丁的疏水作用,使得麦醇溶蛋白的二级结构发生了改变,α-螺旋含量降低,疏水基团埋藏,进而影响两者稳定的乳液的流变学性质。80 ℃处理的复合物稳定的Zeta电位最高,液滴形成的网络结构稳定。处理温度为60 ℃以及80 ℃时,试样乳液的稳定性、黏度、G’均大于常温组与100 ℃处理组,此结论为麦醇溶蛋白的合理利用和麦醇溶蛋白-芦丁复合物稳定的Pickering乳液产品的开发提供了理论依据,对于麦醇溶蛋白的乳制品市场潜力和应用前景及提高麦醇溶蛋白的经济效益具有积极意义。
