过氧化物氧化还原酶蛋白1在乳腺癌组织中表达及对乳腺癌细胞生长调控机制的研究
2020-09-15王桂臣薛鸣高阳
王桂臣,薛鸣,高阳
乳腺癌是女性最常见的恶性肿瘤之一。在欧美国家,每年新检出约6万例原位癌患者及24万例浸润性癌患者,死亡率接近1/6[1-2]。在我国,随着社会经济的发展,人们的性观念、生活习惯发生改变,乳腺癌的发病率也呈逐渐上升趋势[3]。目前认为,乳腺癌的发生是一个多阶段、多步骤并且多种分子参与的发病过程[4]。过氧化物氧化还原酶蛋白1(peroxiredoxin1,PRDX1)是一类具有调节细胞活性氧、维持细胞稳态作用的蛋白[5]。近年来有研究发现,PRDX1具有原癌基因的特征,在胃癌[6]、肝细胞癌[7]等多种恶性肿瘤中存在表达异常,但在乳腺癌中报道很少。
1 材料与方法
1.1 实验试剂 人正常乳腺上皮细胞MDA-kb2购于南京诺唯赞生物科技有限公司;乳腺癌细胞系MCF7、MDA-MB-453、MDA-MB-231由本实验室传代培养。PCR引物、RT-PCR试剂盒购于美国瑞普斯生物科技有限公司;PI3K、AKT抗体购于美国BioInnovatise生物技术公司;PRDX1小干扰 RNA(PRDX1 siRNA)、小干扰 RNA 阴性对照(siRNA control)均购于美国Selleck生物科技有限公司。
1.2 组织样本来源 选择2017年4月至2019年2月在北大医疗鲁中医院进行手术治疗的86例乳腺癌患者为研究对象。纳入标准:①患者为首次诊断;②在我院行手术治疗,术后病理确诊为乳腺癌;③标本保存于我院病理科,且包括癌组织、癌旁组织。排除标准:①术前曾行放疗、化疗、靶向治疗等抗肿瘤治疗;②临床资料不完全。同时,收集同时期82例因乳腺腺瘤等良性疾病行手术治疗的患者为阴性对照。本研究通过我院伦理委员会审查通过,患者对本研究知情同意。
1.3 免疫组化 组织均经甲醛固定后,石蜡包埋,切片。对组织切片进行常规脱蜡、水化,H2O2去离子水孵育。高温修复抗原,PBS冲洗,滴加100 μl鼠抗人PRDX1单克隆抗体(浓度1∶100),4 ℃冰箱孵育过夜。PBS冲洗3次,每次2 min。滴加二抗,37 ℃孵育20~30 min。PBS冲洗3次,每次2 min。DAB显色,苏木素复染,脱水,二甲苯透明,中性树胶封片。以出现棕色颗粒作为PRDX1阳性标准。
1.4 细胞培养及转染 将乳腺癌细胞株MCF7、MDA-MB-453、MDA-MB-231置于完全培养基中进行培养,在37℃、5% CO2孵箱中孵育,经胰酶数次消化传代后,取对数生长期细胞进行实验。接种于24孔板,当细胞汇合度达约60%时,应用 LipofectinTM2000进行转染,根据实验方案,分为:①未转染的空白对照组;②siRNA-NC(阴性对照)组;③PRDX1-siRNA转染组。转染4 h后在新培养基中继续培养。
1.5 MTT检测 根据实验分组方案,分别更换空白对照组、siRNA-NC组和PRDX1-siRNA转染组的细胞培养液,同时培养至24 h、48 h、72 h。培养结束后,于每孔细胞加入20 μl MTT溶液,孵育4 h,检测570 nm波长处的吸光度(A值)。生长抑制率=1-药物组A570 nm值/对照组A570 nm值。实验均重复3次。
1.6 RT-PCR检测 根据操作说明书步骤,提取细胞总RNA,进行逆转录反应。PRDX1引物序列:上游5’-CATCAAGAATGTTGCAGCCAAA-3’,下游5’-TTTCGCGTACACTGCTTAGATCA-3’,以β-actin作为内参。所有引物序列均由南京诺唯赞生物科技有限公司合成。RT-PCR反应条件如下:95 ℃预变性10 min,然后95 ℃变形30 s,50 ℃退火30 s,40个循环,最后70 ℃延伸10 min结束。
1.7 Western blot检测 收集各分组的实验细胞,应用RIPA裂解液裂解细胞样品并提取总蛋白,BCA法测定蛋白浓度。混合上样缓冲液,煮沸变性,电泳、转膜、封闭、一抗、二抗孵育、ECL法显影定影。通过Quantity One软件分析条带强度,以β-actin为内参,检测PI3K蛋白、AKT蛋白表达。
1.8 流式细胞检测 细胞传代、消化后,转移至离心管,室温下,1 000 g,离心10 min,弃去上清。添加细胞培养液,调整细胞浓度约为106/ml,分别加入Buffer 200 μl、Annexin V-FITC 10 μl及PI 10 μl,避光反应15 min。再次加入Buffer 300 μl,上机,流式细胞仪检测凋亡率,每组细胞重复检测3次,取平均值。
1.9 统计学方法 应用SPSS2 0.0软件进行统计分析。计量资料采用均数±标准差表示,组间比较的统计分析采用方差分析检验,两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 PRDX1在乳腺癌组织、癌旁组织、正常组织中的表达 免疫组化染色显示,PRDX1在乳腺癌及癌旁组织中的阳性率为58.1%(50/86)、23.3%(20/86),在正常组织中的阳性率为3.7%(3/82),PRDX1在乳腺癌组织中的阳性率最高,见图1。

1A:正常组织;1B:癌旁组织;1C:胃癌组织图1 PRDX1在正常组织、癌旁组织、乳腺组织的表达(SP ×200)
2.2 PRDX1表达对乳腺癌临床特征的影响 PRDX1阳性表达与乳腺癌患者的TNM分期、病理分级有关(P<0.05),但对患者雌激素受体、孕激素受体表达与否无关(P>0.05),见表1。
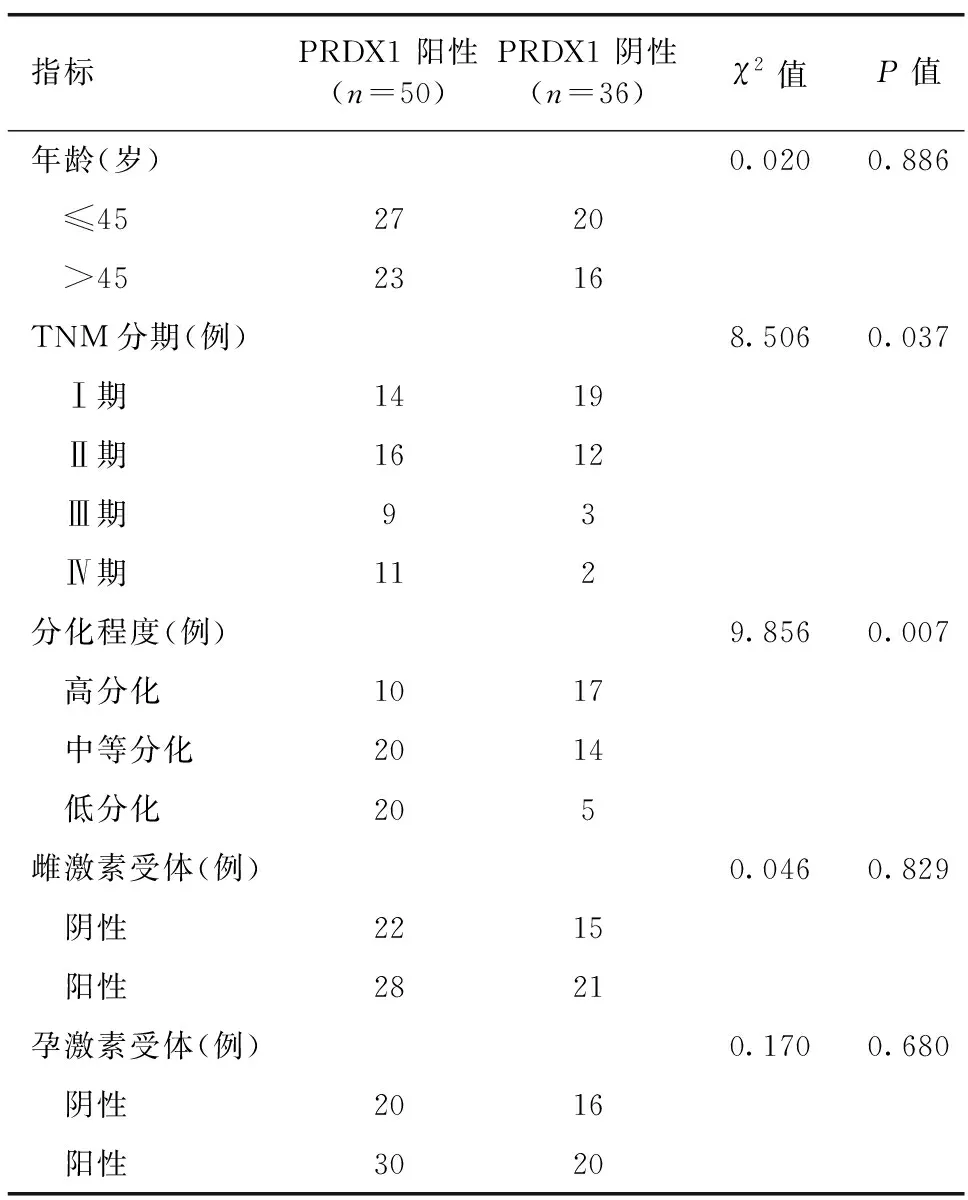
表1 PRDX1表达对乳腺癌临床特征的影响
2.3 PRDX1 mRNA在胃癌细胞系及正常胃上皮细胞中的表达 RT-PCR检测结果显示,PRDX1 mRNA在乳腺癌细胞系MCF7、MDA-MB-453、MDA-MB-231中的表达水平高于正常乳腺上皮细胞MDA-kb231(P<0.05)。而PRDX1 mRNA在乳腺癌细胞系MCF7中的表达水平最高,因此选择MCF7细胞进行后续实验(图2)。

图2 各组细胞中PRDX1 mRNA相对表达量
2.4 转染PRDX1 siRNA后MCF7细胞中PRDX1表达 Western blot检测结果显示,空白组与siRNA-NC组的PRDX1蛋白表达水平,差异无统计学意义(P>0.05),而PRDX1-siRNA组细胞中PRDX1蛋白表达水平下降(P<0.05),见图3。乳腺癌细胞系MCF7中的表达水平最高,因此选择MCF7细胞进行后续实验。

图3 Western blot检测各组细胞PRDX1蛋白表达
2.5 三组细胞增殖活性及凋亡率比较 MTT检测结果显示,在24 h、48 h、72 h时,siRNA-NC组的细胞抑制率分别为1.6%、1.7%、2.4%,RDX1-siRNA组分别为5.6%、15.3%、38.4%,RDX1-siRNA组的细胞抑制率高于空白组与siRNA-NC组(P<0.05)。流式细胞检测显示,空白组、siRNA-NC组、RDX1-siRNA组的凋亡率分别为(7.7±1.3)%、(7.4±1.5)%、(25.7±4.2)%,RDX1-siRNA的肿瘤凋亡率最高(P<0.05),见图4。

图4 流式细胞检测细胞凋亡
2.6 PI3K/AKT信号通路相关蛋白表达 Western blot检测显示,siRNA-NC组的PI3K蛋白、AKT蛋白表达量与空白组相比,差异无统计学意义(P>0.05),但RDX1-siRNA组中PI3K蛋白、AKT蛋白的表达量下降(P<0.05),见图5。

图5 Western blot检测PI3K/AKT信号通路相关蛋白表达
3 讨论
由于乳腺癌筛查的逐渐普及,乳腺癌在特定人群中的检出率有所提高,低危肿瘤、癌前病变和导管原位癌的发病率均有所升高[8]。有研究显示,由于绝经后激素治疗和乳腺钼靶应用广泛,导管原位癌和浸润性乳腺癌的发病率开始升高[9]。尽管内分泌治疗可以降低对侧乳腺癌的风险,但确诊10年后对侧出现原发乳腺癌的风险为3%~10%。PRDX1在胃癌、结肠癌等消化道癌症中的研究较多,但在乳腺癌中研究较少。
PRDX1作为一种过氧化物酶,在维持体内过氧化氢水平方面起着关键作用;同时,PRDX1还可通过调控蛋白激酶的氧化还原状态参与细胞信号转导的调控过程[10]。目前的研究发现,PRDX1具有某些原癌基因的特征,在正常组织内低表达或不表达,并发挥一些重要的生理功能。但在特定条件下,PRDX1基因可被异常激活,诱导细胞癌变[11]。在本研究中,我们首先对患者临床标本中PRDX1的表达进行了检测,结果发现,PRDX1在乳腺癌癌组织中的阳性率较高;同时,PRDX1阳性表达对乳腺癌患者的TNM分期、病理分级有影响。这表明,PRDX1参与了乳腺癌的发生发展过程,并对患者的临床病理特征产生了不良影响。
RNA干扰是指在进化过程中高度保守的、由双链RNA诱发的、同源mRNA高效特异性降解的现象。RNA干扰技术提供了一种经济、快捷、高效的抑制特异基因表达的技术手段,有助于研究该基因在生物模型系统中的作用,并逐步成为遗传性疾病、肿瘤疾病等基因治疗研究的一种手段[12]。在本研究中,我们利用RNA干扰技术敲低了乳腺癌细胞株中PRDX1基因的表达,将乳腺癌细胞分为空白组、siRNA-NC组及PRDX1-siRNA组,通过MTT检测发现,PRDX1-siRNA组的细胞抑制率高于空白组与siRNA-NC组。这表明,PRDX1基因的表达缺失对肿瘤细胞的生长起到了的消极作用,生长速度明显下降。进一步的流式细胞检测发现,空白组、siRNA-NC组、PRDX1-siRNA组的凋亡率分别为(7.7±1.3)%、(7.4±1.5)%、(25.7±4.2)%,PRDX1-siRNA的肿瘤凋亡率最高。“细胞凋亡”是指由基因控制的细胞自主的有序死亡,其意义在于细胞可主动清除多余的特异性或分化能力与机体PRDX1基因表达有利于诱导肿瘤细胞凋亡。
不相适应的、以及已经完成功能而又不再应用的细胞,临床使用的放射疗法和化疗药物主要就是通过诱导肿瘤细胞凋亡而发挥疗效[13]。这表明,降低PI3K-AKT是一条经典的信号通路,主要作用包括[14-15]:①诱导缺氧诱导因子1的表达和活性;②作为细胞内非常重要的信号转导途径;③在细胞的生长、存活、增殖、凋亡、血管生成、自吞噬等过程中发挥着极其重要的生物学功能。在本研究中,通过Western blot检测发现,与空白组相比,PRDX1-siRNA组中PI3K蛋白、AKT蛋白的表达量下降。这表明,PRDX1是通过降低PI3K-AKT信号通路活性发挥效应。
综上所述,本研究发现,PRDX1在乳腺癌患者中的阳性率明显提高。在MCF7乳腺癌细胞株中,抑制PRDX1表达水平可通过降低PI3K/AKT信号通路活性,促进乳腺癌细胞凋亡。
