三氧化二砷对肝癌细胞顺铂化疗敏感性的调节作用
2020-09-14朱沛枫唐成武费卯云
朱沛枫 唐成武 费卯云

[摘要] 目的 探讨三氧化二砷(ATO)对肝癌(HCC)细胞对顺铂(CDDP)化疗敏感性的调节作用。 方法 采用HCC细胞(HepG2细胞),根据处理方法,将细胞分为3组:采用5 μM的ATO 联合20 μM 的CDDP联合(联合组)或单独采用20 μM 的CDDP处理(CDDP组)HCC细胞(HepG2细胞)48 h,对照组采用生理盐水处理细胞。采用MTT法检测各组HepG2细胞的增殖率。采用流式细胞仪检测各组HepG2细胞凋亡情况。比较ATO对CDDP处理后肝癌细胞增殖率及凋亡率的影响。 结果 经过48 h处理,联合组细胞增殖率明显低于CDDP组[(0.48±0.05)vs.(0.62±0.06)] (P=0.0002)。经过48 h处理,联合组细胞凋亡率明显高于CDDP组[(44.32±3.59) vs.(34.63±3.25)](P=0.0001)。 结论 ATO联合CDDP处理可以通过降低HCC细胞增殖率并促进细胞凋亡增加HCC细胞对CDDP化疗的敏感性,增强CDDP对肝癌细胞的杀伤力。
[关键词] 肝细胞癌;顺铂;化疗敏感性;三氧化二砷
[中图分类号] R735.7 [文献标识码] A [文章编号] 1673-9701(2020)19-0029-04
Regulatory effect of arsenic trioxide on cisplatin chemotherapy sensitivity of hepatocarcinoma cells
ZHU Peifeng TANG Chengwu FEI Maoyun
Department of Surgery, the First People's Hospital Affiliated to Huzhou Teachers College, Huzhou 313000, China
[Abstract] Objective To investigate the regulatory effect of arsenic trioxide(ATO) on the sensitivity of liver cancer(HCC) cells to cisplatin(CDDP) chemotherapy. Methods HCC cells(HepG2 cells) were divided into 3 groups according to the treatment method: HCC cells treated with 5 μM ATO combined with 20 μM CDDP(the combined group) or HCC cells treated with 20 μM CDDP alone(HepG2 cells)(CDDP group) for 48 hours. The control group was treated with physiological saline. The proliferation rate of HepG2 cells in each group was detected by MTT assay. Flow cytometry was used to detect the apoptosis of HepG2 cells. The effect of ATO on the proliferation rate and apoptosis of hepatoma cells after CDDP treatment were compared. Results After 48 hours of treatment, the cell proliferation rate of the combined group was significantly lower than that of the CDDP group(0.48±0.05) vs.(0.62±0.06), (P=0.0002). After 48 hours of treatment, the apoptosis rate of the combined group was significantly higher than that of the CDDP group(44.32±3.59) vs.(34.63±3.25), (P=0.0001). Conclusion ATO combined with CDDP treatment can increase the sensitivity of HCC cells to CDDP chemotherapy by reducing the proliferation rate of HCC cells and promote apoptosis, and enhance the lethality of CDDP on liver cancer cells.
[Key words] Hepatocellular carcinoma; Cisplatin; Chemosensitivity; Arsenic trioxide
肝細胞肝癌(Hepatocellular carcinoma,HCC)是我国目前发病率第三、致死率第二的恶性肿瘤,已经成为严重危害国民健康的公共卫生难题[1-3]。手术切除是除肝移植之外针对肝癌目前最有效的治疗手段[4]。虽然目前对肝癌的诊治手段有了长足的发展,但是在新确诊的肝癌患者中约有2/3属于晚期,已失去根治性手术的机会,这部分患者需要接受化疗为主的非手术治疗[5]。顺铂(Cisplatin,CDDP)是第一代铂类广谱抗肿瘤药物,是消化道肿瘤最常用的化疗用药,在胃癌、结直肠癌、肝癌等肿瘤的辅助治疗中具有重要的地位[6-8]。然而HCC极易对CDDP产生耐药,导致化疗失败,缩短了肝癌患者预后[9,10]。因此需要探索一种新的治疗策略,减少HCC的化疗耐药,从而改善HCC患者预后。三氧化二砷(Arsenic trioxide,ATO)为砒霜的提取物,已有研究证明其在肝癌治疗中能提升化疗效果[11],但其机制尚不明确,本研究拟通过ATO联合CDDP联合处理HCC细胞,观察其对HCC细胞增殖率及凋亡情况的影响,阐明其作用机制。现报道如下。
1 材料与方法
1.1 细胞系
人肝细胞肝癌HepG2 购自上海细胞库。
1.2 主要试剂
胎牛血清、L-谷氨酰胺、二甲基亚砜、5%BSA封闭液、MTT试剂盒和三氧化二砷购自美国Sigma公司,DMEM-F12培养基、0.25%胰蛋白酶、10 000 U/mL青霉素/10 000 U/mL链霉素购自美国Gibco公司,细胞培养皿及培养板购自美国Coming公司,Annexin Ⅴ凋亡试剂盒购自德国Miltenyi Biotec公司。
1.3 方法
1.3.1 MTT法检测细胞增殖率 将常规培养的HepG2肝癌细胞株制成细胞悬液,调整浓度为2×105个/mL,接种于96孔板,每孔100 μL。将对照组、联合组和CDDP组的HepG2细胞分别用生理盐水、5 μM的ATO 联合20 μM 的CDDP和单独20 μM 的CDDP 处理48 h后终止培养,用PBS清洗3次,加入10 μL MTT溶液,37℃,避光孵育2 h。以酶标仪测定450 nm波长处的吸光度(OD)值(A值)。
1.3.2 细胞凋亡检测 将常规培养的HepG2肝癌细胞株制成细胞悬液,接种于96孔板,每孔100 μL。将对照组、联合组和CDDP组的HepG2细胞分别用生理盐水、5 μM的ATO 联合20 μM 的CDDP和单独20 μM的CDDP 处理48 h后,用0.25%的胰酶消化收集细胞,加入完全培养基终止消化,2000 g/min离心3 min,弃上清。用0.01 M PBS清洗细胞,2000 g/min离心3 min,弃上清,重复两次。吸干PBS,加入Binding Buffer调整细胞浓度,使之成为细胞浓度约为1×106 cells/mL的悬浮液。向调整好的100 μL细胞悬浮液加入2 μL Annexin Ⅴ和2 μL PI,混合后室温避光孵育15 min。加入400 μL稀释好的Binding Buffer,用流式细胞仪分析细胞的凋亡情况。
1.4 统计学方法
所有统计均由SPSS 21.0统计学软件完成,计量资料以均数±标准差(x±s)表示,组间比较采用t检验;P<0.05为差异有统计学意义,直方图均采用Sigma Plot 10.0绘制。所有实验均在同等条件下设置8个复孔,保证实验可重复性。
2 结果
2.1 ATO对肝癌细胞增殖率的影响
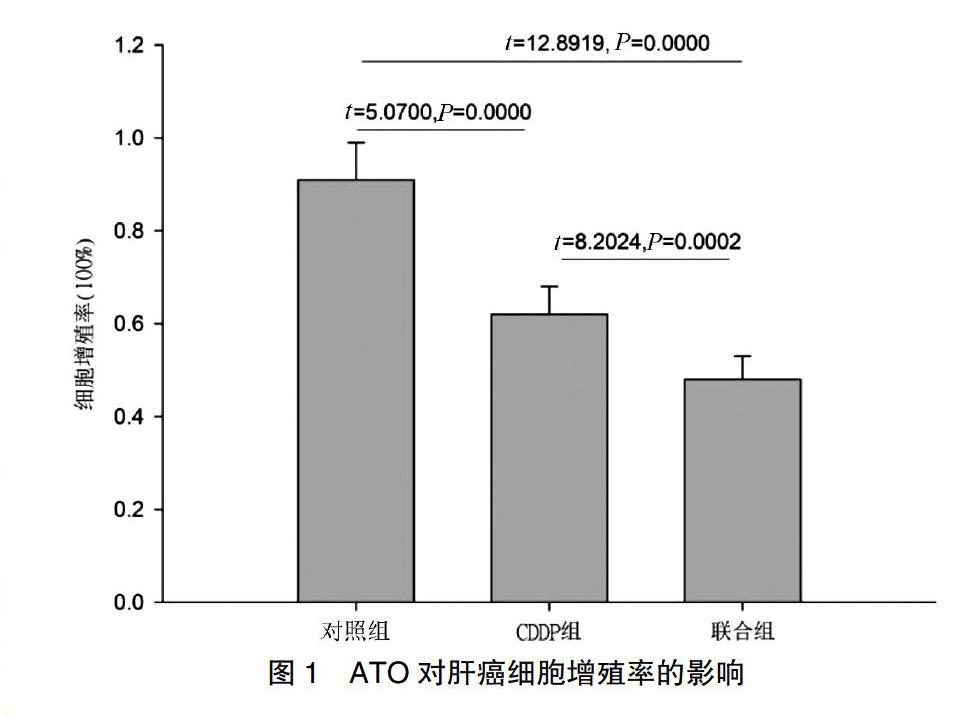
经过48 h处理,联合组细胞增殖率(100%)明显低于对照组[(0.48±0.05) vs.(0.91±0.08)],(t=12.8919,P=0.0000);CDDP组细胞增殖率明显低于对照组[(0.62±0.06)vs.(0.91±0.08)](t=8.2024,P=0.0000);联合组细胞增殖率明显低于CDDP组[(0.48±0.05)vs.(0.62±0.06)](t=5.0700,P=0.0002),表明ATO能明显增加肝癌细胞对CDDP的敏感性,使肝癌细胞增殖率明显下降(图1)。
2.2 ATO对肝癌细胞凋亡率的影响
经过48 h处理,联合组细胞凋亡率明显高于对照组[(44.32±3.59)vs.(15.22±1.61)](t=20.9194,P=0.0000);CDDP组细胞凋亡率明显高于对照组[(34.63±3.25)vs.(15.22±1.61)](t=15.1367,P=0.0000);联合组细胞凋亡率明显高于CDDP组[(44.32±3.59)vs.(34.63±3.25)](t=5.6597,P=0.0001),表明ATO能明显增加CDDP对肝癌细胞的杀伤力,使肝癌细胞凋亡率明显升高(图2)。
3 讨论
肝癌是我国目前最常见的恶性肿瘤之一,在我国肝癌发病率约为26.63/10万,每年死于肝癌的人数约为31.6万,占据全世界肝癌死亡人数的一半以上[1]。手术切除是目前除肝移植之外针对肝癌最有效的治疗手段[4]。虽然目前对肝癌的诊治手段有了长足的发展,但是在新确诊的肝癌患者中约有2/3属于晚期,已失去根治性手术的机会,这部分患者需要接受化疗为主的非手术治疗[5]。
对于失去手术机会的患者,经动脉化疗栓塞(Transarterial chemoembolization,TACE)已被确立为不可切除肝癌患者的标准治疗方法[12]。TACE通过结合靶向化疗和动脉栓塞引起的缺血性壞死的疗效,可以减缓肿瘤进展,提高生存率。TACE治疗的生存优势已被多项随机临床试验证实[13,14]。顺铂(CDDP)是治疗消化道恶性肿瘤最有效的药物之一,广泛应用于临床。通过TACE将CDDP与碘油的混合乳剂用于不可切除肝癌的治疗,能显著改善患者预后。然而HCC极易对CDDP产生耐药,导致化疗失败,缩短了肝癌患者预后[9,10]。因此需要探索一种新的治疗策略,减少HCC的化疗耐药,从而改善HCC患者预后。
近期研究发现,部分HCC患者在化疗初期就出现化疗耐药,而不是在重复化疗后,这表明HCC可能拥有天然的高度耐药属性[15]。有研究发现支链氨基转移酶(Branched chain aminotransferase-1,BCAT1)在HCC组织和细胞系中表达明显上调,对细胞周期有调节作用,参与细胞增殖、分化和凋亡,而且能上调介导HCC的CDDP耐药[16,17]。BCAT1目前已被证实参与肝癌、胃癌、结肠癌等肿瘤的发生和发展进程[18-20]。在肝癌中,BCAT1的过表达往往预示着较差的预后和较早的术后转移,其机制可能是BCAT1能起到促肝癌细胞增殖和CDDP化疗耐药的作用,通过阻断BCAT1表达能明显改善肝癌细胞的化疗耐药[21]。
ATO为砒霜的提取物,已广泛用于急性早幼粒细胞白血病的治疗[22],目前已有研究证明其在多种肿瘤中起到治疗作用[23-25]。在肝癌中,ATO同样能起到提升化疗效果的作用[11]。有学者将三氧化二砷与TACE联合治疗晚期HCC,显著提高了化疗疗效,改善了患者预后[26]。目前,针对ATO提高肝癌细胞化疗敏感性的研究仍处于起步阶段,有学者发现,ATO能抑制肝癌细胞BCAT1表达,从而提升肝癌细胞对CDDP的化疗敏感性[27]。本研究发现,ATO联合CDDP处理肝癌细胞后显著降低了肝癌细胞增殖率,并提高了肝癌细胞凋亡率,这表明ATO能显著增加肝癌细胞对CDDP的化疗敏感性。因此,本研究结果进一步证实了ATO在肝癌治疗中的作用,为克服HCC对CDDP耐药、改善CDDP化疗的效果,提供了新的理论依据和策略,具有重要的临床意义
[参考文献]
[1] 陈万青,郑荣寿,张思维,等. 2013年中国恶性肿瘤发病和死亡分析[J]. 中国肿瘤,2017,26(1):1-7.
[2] 中华人民共和国卫生和计划生育委员会医政医管局. 原发性肝癌诊疗规范(2017年版)[J]. 中华消化外科杂志,2017,16(7):635-647.
[3] 王黎君,殷鹏,刘韫宁,等. 1990年与2013年中国人群肝癌疾病负担研究[J]. 中华流行病学杂志,2016,37(6):758-762.
[4] 陈孝平,张志伟. 《肝细胞癌外科治疗方法的选择专家共识》解读[J]. 中华外科杂志,2017,55(1):7-10.
[5] 中国医师协会肝癌专业委员会. 肝细胞癌合并门静脉癌栓多学科诊治中国专家共识(2018年版)[J]. 中华医学杂志,2019,99(8):579-586.
[6] 易文轶,韦玲,刘正金. 吉西他滨联合顺铂类经TACE对中晚期肝癌患者血清CTGF、VEGF的影响[J]. 实用药物与临床,2018,21(8):880-884.
[7] Fujitani K,Yang HK,Mizusawa J,et al. Gastrectomy plus chemotherapy versus chemotherapy alone for advanced gastric cancer with a single non-curable factor (REGATTA):A phase 3,randomised controlled trial[J]. The Lancet Oncology,2016,17(3):309-318.
[8] 丁成明,贺更生,韩东,等. 伊立替康联合顺铂对晚期结肠癌的治疗效果[J]. 北方药学,2018,15(4):144.
[9] 李辉宇,付西峰,贺杰峰,等. 核磷蛋白在肝癌细胞多药耐药中的作用[J]. 中华实验外科杂志,2018,35(10):1852-1854.
[10] 常杏,胡长江,邓盛瑜,等. 端粒酶逆转录酶线粒体转位促进肝癌细胞干性及耐药的研究[J]. 第三军医大学学报,2017,39(8):781-786.
[11] 季峻松,陈婷,王辉,等. 肝动脉化疗栓塞联合灌注三氧化二砷治疗原发性肝癌[J]. 实用医学杂志,2018, 34(2):251-253.
[12] Tang C,Shen J,Feng W,et al. Combination therapy of radiofrequency ablation and transarterial chemoembolization for unresectable hepatocellular carcinoma:A retrospective study[J]. Medicine,2016,95(20):e3754.
[13] Pokuri VK,Tomaszewski GM,Ait-Oudhia S,et al. Efficacy,safety,and potential biomarkers of sunitinib and transarterial chemoembolization (TACE) combination in advanced hepatocellular carcinoma (HCC):Phase Ⅱ Trial[J]. American Journal of Clinical Oncology,2018,41(4):332-338.
[14] Zhang X,Wang K,Wang M,et al. Transarterial chemoembolization(TACE) combined with sorafenib versus TACE for hepatocellular carcinoma with portal vein tumor thrombus:A systematic review and meta-analysis[J]. Oncotarget,2017,8(17):29416-29427.
[15] Marin JJG,Cives-Losada C,Asensio M,et al. Mechanisms of anticancer drug resistance in hepatoblastoma[J].Cancers,2019,11(3):E407.
[16] Xu M,Liu Q,Jia Y, et al. BCAT1 promotes tumor cell migration and invasion in hepatocellular carcinoma[J]. Oncology Letters,2016,12(4):2648-2656.
[17] Ji D,Jiang C,Zhang L,et al. LncRNA CRNDE promotes hepatocellular carcinoma cell proliferation,invasion,and migration through regulating miR-203/BCAT1 axis[J]. Journal of Cellular Physiology,2019,234(5):6548-6560.
[18] 王宏剛,谢睿,沈鹏,等. BCAT1蛋白在肝癌中的表达及与预后的关系[J]. 山西医科大学学报,2016,47(6):502-504,561.
[19] Xu Y,Yu W,Yang T,et al. Overexpression of BCAT1 is a prognostic marker in gastric cancer[J]. Human Pathology,2018,75(5):41-46.
[20] Symonds EL,Pedersen SK,Baker RT,et al. A blood test for methylated BCAT1 and IKZF1 vs. A fecal immunochemical test for detection of colorectal neoplasia[J]. Clinical and Translational Gastroenterology,2016,7(1): e137.
[21] Zheng YH,Hu WJ,Chen BC,et al. BCAT1 a key prognostic predictor of hepatocellular carcinoma,promotes cell proliferation and induces chemoresistance to cisplatin[J]. Liver International:Official Journal of the International Association for the Study of the Liver,2016,36(12):1836-1847.
[22] 郝睿,苏力德,邵一鸣,等. PML蛋白参与三氧化二砷治疗急性早幼粒细胞白血病的分子生物学机制研究[J].浙江大学学报(医学版),2018,47(5):541-551.
[23] 柏金,于若曦,宋慧聪,等. 利用网络分析预测As2 O3治疗结直肠癌的靶基因[J]. 现代肿瘤医学,2018,26(21):3437-3440.
[24] 滕松齡,陈兵,李崇杰. 三氧化二砷联合小白菊内酯诱导人骨肉瘤细胞凋亡的实验研究[J]. 实用手外科杂志,2018,32(4):455-457.
[25] 丁涛,李腾越,李春宇,等. 三氧化二砷对肝癌治疗的新进展[J]. 吉林医药学院学报,2018,39(5):383-385.
[26] Hu HT,Yao QJ,Meng YL,et al. Arsenic trioxide intravenous infusion combined with transcatheter arterial chemoembolization for the treatment of hepatocellular carcinoma with pulmonary metastasis: Long-term outcome analysis[J]. Journal of Gastroenterology and Hepatology,2017,32(2):295-300.
[27] Ju H,Tang C,Dong X,et al. BCAT1-inducing chemoresistance to cisplatin was partially suppressed by ATO in HCC cells[J]. Int J Clin Exp Pathol,2017,10(1):453-459.
(收稿日期:2019-07-17)
