天麻萌发菌胞外酶活性变化规律研究△
2020-09-14叶梦娜陈向东王忠巧兰进张薇薇宋明海王宪楠马琳
叶梦娜,陈向东,王忠巧,兰进,张薇薇,宋明海,王宪楠,马琳
1.天津中医药大学,天津 301617;2.中国医学科学院 北京协和医学院 药用植物研究所,北京 100193;3.彝良县天麻产业开发办公室,云南 昭通 657600;4.抚松县参王植保有限责任公司,吉林 抚松 134500
天麻GastrodiaelataBl.是兰科(Orchidaceae)天麻属(Gastrodia)多年生草本植物,是一种高度退化的兰科植物。其种子细小量大、无胚乳,研究发现天麻种子萌发是由种子萌发菌提供营养。萌发菌侵入天麻种子后,天麻种子消化侵入的菌丝获得营养,进而萌发形成原球茎。目前,天麻种子萌发率较低,萌发菌多代繁殖不断退化,直接影响天麻产量和质量。因此,筛选优质萌发菌是亟待解决的问题。胞外酶是萌发菌在其生长发育过程中参与培养基中养分的分解和吸收的高效工具,不同胞外酶活性的变化在一定程度上反映培养过程中菌丝体生长及相关产物代谢的情况[1]。本研究通过对03、06萌发菌不同时期的胞外酶活性测定及菌株生长量测量,为天麻有性繁殖生产筛选优良菌株提供参考。
1 材料
1.1 供试菌株
天麻萌发菌菌株03、06,由中国医学科学院北京协和医学院药用植物研究所生物技术中心提供。
1.2 试剂
2,2-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS,上海阿拉丁生化科技股份有限公司,批号:L1803054);苯酚(西陇化工股份有限公司,批号:1703042);所有试剂均为分析纯。
1.3 仪器
TG16G型离心机(天津广丰科技有限公司);BioSpectrometerfluorescence型分光光度计(德国Eppendorf);PHS-3C型pH计(上海仪电科学仪器股份有限公司)。
2 方法
2.1 菌丝培养皿培养
菌丝培养采用改良固体PDA培养基,培养基配制后高压灭菌,定量倒入120 mm无菌培养皿中,定量接种。25 ℃暗培养,观察菌落形态,采样供内转录间隔区(ITS)分子鉴定用。
2.2 菌丝试管培养
试管菌丝培养采用木屑-麦麸培养基,按料水比1∶1.5制作培养基,定量装入大试管中,高压灭菌。
2.3 生长速度的测定
接种第5天起测量菌丝生长量,除以生长天数得到菌株的平均生长速度,每5 d测量1次至长满试管为止,每菌株测量3个试管,取平均数。
2.4 菌株菌落形态及ITS分子鉴定
采用Plant Genomic DNA Kit试剂盒(离心柱型)提取03菌株和06菌株的DNA,采用真菌通用引物ITS-1(5′ TCCGTAGGTGAACCTGCGG-3′)和ITS-4(5′ TCCTCCGCTTATTGATATGC-3′)对ITS序列进行PCR扩增。PCR 反应体系50 μL:2×TaqMaster Mix 25 μL,引物ITS-1 2 μL,引物ITS-4 2 μL,模板DNA 1 μL,ddH2O补齐至50 μL。反应条件:94 ℃预变性3 min;94 ℃ 30 s,53 ℃退火30 s,72 ℃ 55 s,30个循环;72 ℃延伸 2 min,4 ℃保存。将试验阳性PCR产物送至北京六合华大基因科技有限公司进行测序,将测序结果整理后提交National Center for Biotechnology Information 数据库,利用BLAST进行序列比对,下载相似序列后利用Mega 7.0的邻接(NJ)法(Bootrap:1000;Gaps/Missing Data Pairwise Deletion;Model:Kmura 2-parameter;Substiutions to Include:Tranations+Transversion)构建系统发育树。
2.5 萌发试验
将03菌株和06菌株分别与4 ℃贮藏30 d的红天麻种子进行拌播,以紫萁小菇作为对照,并在MS培养基上进行无菌萌发实验,60 d时统计萌发率。
2.6 胞外酶活性测定
随机取菌丝生长线下的培养基1.0 g,加入5 mL磷酸氢二钠-柠檬酸缓冲液(pH=4.0,0.2 mol·L-1),室温浸提4 h,12 000 r·min-1(离心半径为8.8 cm)离心15 min,吸出1 mL上清液于10 mL量瓶中定容至刻度,用于胞外酶活性测定。
采用2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)法[2]测定漆酶活性,3,5-二硝基水杨酸(DNS)法[3]分别测定纤维素酶活性、木聚糖酶活性、果胶酶活性及淀粉酶活性。
ABTS法:将0.5 mL 0.5 mmol·L-1ABTS与1.0 mL Na2HPO4-C6H8O7缓冲液混合均匀,加入0.5 mL稀释后的酶液。记录420 nm处3 min内的吸光度变化,1个酶活单位定义为反应体系中每分钟催化1 μmol ABTS所需酶量。
DNS法:在刻度试管中分别加入1.5 mL用0.1 mol·L-1的醋酸缓冲液(pH=4.6)配制的1% CMC-Na溶液,0.1 mL稀释后的酶液,40 ℃水浴保温30 min,取出后立即加入1.5 mL DNS试剂,沸水浴加热5 min,待冷却后用蒸馏水稀释至10 mL,于500 nm测定吸光度。1%木聚糖溶液、1% 果胶溶液、1% 淀粉溶液,与1% CMC-Na溶液配制方法和测定方法相同。不同的是,测定木聚糖酶活力时,稀释至20 mL后测定吸光度;测定淀粉酶活力时,于50 ℃水浴保温30 min。
以上测定过程中空白对照均为加热灭活后的稀释酶液,分别按葡萄糖、木糖和半乳糖醛酸标准曲线,计算底物被酶分解的葡萄糖、木糖及半乳糖醛酸的含量,1个酶活单位定义为每分钟生成1 μmol葡萄糖、木糖及半乳糖醛酸所需要的酶量。
2.7 绘制标准曲线
葡萄糖标准曲线:移取0~1.0 mL的0.1 mg·mL-1葡萄糖标准液至10 mL量瓶中,用蒸馏水补充至2.0 mL,空白对照为2.0 mL蒸馏水。采用苯酚-浓硫酸法[3]测定420 nm的吸光度,绘制葡萄糖标准曲线为Y=41.986X+0.002 2(r=0.999 8)。
木糖标准曲线:移取0~1.0 mL的5.0 mg·mL-1木糖标准液至25 mL量瓶中,用醋酸缓冲液补充至1.0 mL,空白对照为1.0 mL醋酸缓冲液。加入2.0 mL DNS试剂,沸水浴5 min后用醋酸缓冲液定容至20 mL。测定500 nm下的吸光度,绘制木糖标准曲线为Y=2.366 9X-0.008 5(r=0.999 1)。
半乳糖醛酸标准曲线:半乳糖醛酸标准液质量浓度为1 mg·mL-1,除定容至10 mL后测定吸光度,其余步骤同木糖标准曲线,测得半乳糖醛酸标准曲线为Y=12.206X-0.017 6(r=0.999 1)。
2.8 酶活性计算
漆酶活性用公式(1)计算,其他酶活性用公式(2)计算。
(1)
(2)
式中:ε:ABTS吸光系数36 000 L·mol-1·cm-1;V酶:加入酶液的体积(L);V总:反应体系总体积(L);m:根据标准曲线算得的质量(μg);M:摩尔质量;t:反应时间;n:稀释倍数;单位:U·L-1。
2.9 数据处理
运用Excel表格统计处理数据结果,采用SPSS 17.0进行独立样本t检验以比较数据差异性。
3 结果与分析
3.1 菌株菌落形态及ITS分子鉴定
2种菌株菌丝呈绒毛状、边缘整齐,06菌株菌丝较03菌株菌丝洁白、浓密(见图1),03菌株生长速度快于06菌株。

注:A.03菌株;B.06菌株。图1 2株萌发菌菌株菌落形态
2株萌发菌ITS的PCR扩增结果显示其序列大小在750 bp 左右。菌株与Mycena中的ITS序列具有99%的高度相似性,结合菌株菌落形态认为,03菌株和06菌株均为小菇属萌发菌。系统发育树见图2。
3.2 萌发实验
培养60 d时,03、06菌株与紫萁小菇的萌发率分别为64.0%、42.4%和52.8%,MS培养基上未观察到种子萌发(见图3)。

图2 2株萌发菌菌株系统发育树

注:A.03菌株拌播种子;B.06菌株拌播种子;C.紫萁小菇;D. MS培养基播种天麻种子。图3 3株萌发菌及MS培养基上种子萌发情况
3.3 萌发菌生长速度
接种第5天开始,每5 d测量生长量,并换算成生长速度(见表1),2株萌发菌均在第25天达到生长的高峰,03、06菌株的生长速度分别为0.303、0.295 cm·d-1。第25天以后生长放缓,在生长过程中03菌株的生长速度均大于06菌株,且差异有统计学意义(P<0.05),结果表明03菌株在生长速度上优于06菌株。
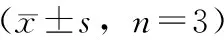
表1 03、06菌株不同时期生长速度 cm·d-1
3.4 不同时期萌发菌胞外酶活性变化
3.4.1漆酶活性 03、06菌株漆酶活性均表现为先增长的趋势(见图4),并在第15天时达到最高值,分别为19.50、19.44 U·g-1;在第20天均降至最低值。培养第21天后06菌株漆酶活性又开始上升,第30天出现第2次高峰,此时06菌株漆酶活性为13.42 U·g-1,是03菌株漆酶活性的1.5倍。第25天以后,06菌株漆酶活性均高于03菌株,差异有统计学意义(P<0.01)。
3.4.2纤维素酶活性 从图4可见,06菌株纤维素酶活性第10天达到最高值(见图5),而03菌株纤维素酶活性则在第15天达到最高值;纤维素酶活性分别为0.54、0.63 U·g-1。达到最高值后纤维素酶活性均开始降低,到第40天时06、03菌株的纤维素酶活性分别降至0.27、0.19 U·g-1,此时06菌株纤维素酶活性比03菌株高42.1%。

注:*P<0.05;**P<0.01;下同。图4 03、06菌株不同时期胞外漆酶活力变化

图5 03、06不同时期胞外纤维素酶活力变化
3.4.3木聚糖酶活性 03、06菌株萌发菌木聚糖酶活性变化趋势与纤维素酶活性相近,也是随着培养时间的增加呈现先增高后降低的趋势(见图6)。不同于纤维素酶活性变化趋势的是03菌株木聚糖酶活性在第10天达到最高值,而06菌株在第15天达到最高值;在第15天,06菌株的木聚糖酶活性约为03菌株的1.6倍。在培养过程中06菌株的木聚糖酶活性均高于03菌株,统计分析显示03、06菌株萌发菌木聚糖酶活性差异有统计学意义(P<0.05)。

图6 03、06不同时期胞外木聚糖酶活力变化
3.4.4果胶酶活性 03、06菌株果胶酶活性变化趋势与其他酶活力变化趋势相似(见图7),但是达到最高酶活性时间均推迟到培养第25天,03菌株果胶酶活性为2.73 U·g-1,比06菌株高12.3%。在培养不同阶段03菌株果胶酶活性均高于06菌株,差异有统计学意义(P<0.05)。
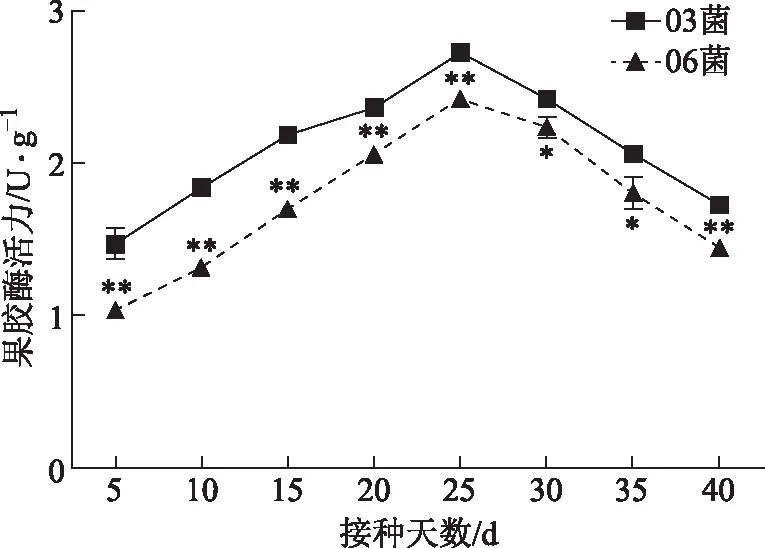
图7 03、06不同时期胞外果胶酶活力变化

图8 03、06不同时期胞外淀粉酶活力变化
3.4.5淀粉酶活性 03、06菌株淀粉酶活性均在培养第15天时达到最高值(见图8),06菌株的淀粉酶活性是0.560 U·g-1,比03菌株高41.1%;淀粉酶活性培养第40天时为最低,03、06菌株的淀粉酶活性分别是0.193、0.264 U·g-1;从曲线图可见在03、06菌株生长过程中,06菌株的淀粉酶活性均高于03菌株,且差异有统计学意义(P<0.05)。
4 讨论
ITS序列分析技术是常用的分子生物学鉴定方法,可以检测和对比传统形态学无法区分鉴别的相似菌株种间或种内的差别,具有快速、灵敏、准确的优点。本研究将03、06菌株的ITS序列测序后,提交至GenBank数据库中,建立系统发育树,结合菌株菌落形态认为03、06菌株为2种不同的小菇属萌发菌。萌发实验表明03、06菌株均有促进天麻种子萌发的作用。
在培养前期,2株萌发菌生长速度逐渐增加,均在第25天达到生长的高峰,后期2种菌株生长速度有所减缓。03菌株先于06菌株长满试管,两者生长速度存在差异。
萌发菌为木腐菌,其生长与胞外酶活性密切相关。目前对萌发菌胞外酶活性变化规律的研究报道较少,并且只是在液体发酵培养方面,木屑培养基菌株胞外酶活性研究未见报道。一般木材中纤维素、半纤维素和木质素的含量分别为40%~ 50%、10%~ 30%、20%~ 30%,萌发菌生长过程中向胞外分泌的漆酶能加速木质素芳香族高分子化合物的分解;胞外纤维素酶将纤维素分解为纤维二糖和寡糖,最终水解为葡萄糖被萌发菌吸收利用;木聚糖是植物半纤维素的主要组成部分,胞外木聚糖酶可以使其分解[4-8]。在生长阶段,两株萌发菌均分泌了漆酶、纤维素酶、木聚糖酶、果胶酶和淀粉酶,这5种胞外酶活性变化规律基本一致,但表现出明显的阶段性。不同菌株的同种胞外酶酶活性大小有所差异,03菌株各个时期的木聚糖酶和淀粉酶活性低于06菌株,说明06菌株分解培养基半纤维素类成分的能力强于03菌株。在培养后期06菌株的漆酶活性不降反升,可能是因为前期贮存的营养物质已经不能满足菌丝迅速生长的需要,从而诱导分泌木质素分解酶以分解利用培养基中的木质素物质获得营养。在实际生产过程中,萌发菌生长速度缓慢,针对不同的萌发菌菌株,可以采用不同的培养基,以加快菌丝生长和缩短菌种培养周期。
本研究根据2种菌株的生长量、不同时期的胞外酶活性及萌发实验的研究结果,初步筛选出03为优势菌株,可为实际生产中对萌发菌培养基进行改进及优质萌发菌的选择提供科学依据。对于不同萌发菌分解吸收培养基中营养成分的调控机制还需进一步深入研究。
