乳腺癌保乳术后调强放射治疗不同配准方法摆位精度的临床研究△
2020-09-14艾秀清王雪唐成琼刘浩陈春丽曹耀峰刘江平王义海
艾秀清,王雪,唐成琼,刘浩,陈春丽,曹耀峰,刘江平,王义海#
新疆医科大学第三临床医学院附属肿瘤医院1乳腺放疗科,2放射物理技术科,乌鲁木齐830011
乳腺癌是严重危害女性健康的恶性肿瘤,乳腺癌的手术正朝着切除范围不断缩小的方向发展,早期浸润性乳腺癌的治疗策略从先前的根治术和改良根治术为主逐渐向乳房保留为主过渡。多项随机分组研究结果已证实,对于早期乳腺癌患者,保乳手术与改良根治术具有相似的局部控制率和长期生存率,且保乳手术具有更好的美容效果,因此成为越来越多早期乳腺癌患者的首选。乳腺癌保乳术后全乳放疗的模式日益增多,调强放射治疗(intensity-modulated radiotherapy,IMRT)是近年来逐渐普及且较为典型的一种放疗模式[1-2]。但在IMRT的过程中,靶区位移是需要重点考虑的因素,可在一定程度上对全乳IMRT的剂量体积参数产生影响,而且增加肿瘤靶区边界时,易导致正常组织的受照射剂量随之增加。图像引导放疗(image-guided radiation therapy,IGRT)已在乳腺癌保乳术后放疗中得到普及。IGRT是一种新型的、通过一系列影像系统进行靶区定位和患者摆位的肿瘤放疗技术。准确摆位是开展精确放疗的重要保证,摆位误差会造成靶区剂量的变化。针对这一情况,锥形束计算机断层扫描(cone-beam computer tomography,CBCT)进行了改善,逐渐在放疗中得到了推广,在这一技术的引导下,肿瘤患者的摆位误差可以得到有效校正,从而降低外扩边界的范围,在放疗中具有重要意义[3-6]。本研究对CBCT引导下乳腺癌保乳术后IMRT不同配准方法的摆位精度进行分析和研究,现报道如下。
1 对象与方法
1.1 研究对象
选取2017年10月至2018年4月新疆医科大学第三临床医学院附属肿瘤医院收治的50例乳腺癌保乳术后患者。纳入标准:①经病理检查确诊为原发性乳腺癌;②接受乳腺癌保乳术,且术后需行全乳精确放疗;③TNM分期为I~Ⅱ期;④患者双侧上肢上举和外展功能良好,能满足手臂支撑与握杆要求。排除标准:①合并通气功能障碍;②合并慢性心肺疾病。50例患者的年龄为25~82岁,中位年龄为53岁;26例为左侧乳腺癌,24例为右侧乳腺癌。所有患者均实施全乳IMRT,分别采用自动灰度配准、自动骨性标志配准和自动灰度配准结合手动骨性标志配准的方法,对第一次放疗前及每周一次的CBCT引导下图像与原计划计算机断层扫描(CT)图像进行配准,收集获取的摆位数据。本研究经医院伦理委员会审批通过,所有患者及家属均对本研究知情并签署知情同意书。
1.2 定位方式
首先,患者仰卧于乳腺托架上,上举患侧上肢,呈外展状,确保同侧乳腺可充分暴露后,三维激光线对准于患者体中线及左右体侧处,同时放置定位参考铅点,并对乳腺托架数值进行记录。然后,以大孔径CT作为辅助工具,完成螺旋扫描,将层厚设置为5 mm,图像分辨率设置为1024×1024。针对靶区范围进行扫描后,利用计算机网络将图像数据传送至Varian Eclipse 11.0治疗计划系统,由副主任医师进行靶区勾画,主任医师进行靶区修改及确认。
1.3 计划设计
选取Varian Eclipse 11.0系统的6MV-X线,使95%等剂量线尽量全部包绕计划靶区,行IMRT计划设计,尽量使治疗计划中心与定位中心一致,各器官满足以下条件:心脏V25<10%,V30<5%;双肺V20<14%;患侧肺V30<10%,V20<25%;计划靶区体积(planning target volume,PTV)D95=50 Gy,V53.50<10%,V55<5%;健侧乳腺 Dmax<8 Gy,且 Dmean<1 Gy。给予患者IMRT 25次,靶区总剂量为50 Gy,每次2 Gy,每日1次,每周治疗5次。
1.4 扫描与图像配准
将治疗计划传输至Varian Clinac Trilogy Rapid ARC加速器4 DTC OBI工作站。放疗计划实施前,由2位放疗师、1位临床医师及1位物理师共同进入机房进行摆位验证,根据相关标准执行操作,摆位误差在允许±5 mm内,采集CBCT图像,将重建好的CBCT图像与计划CT图像通过自动灰度配准、自动骨性标志配准、自动灰度配准结合手动骨性标志配准的方式进行图像配准,之后每周拍摄一次验证图像进行对比验证,共150组数据。记录每次X(左右方向)、Y(头脚方向)、Z(腹背方向)的位移值。
1.5 观察指标
比较自动灰度配准、自动骨性标志配准、自动灰度配准结合手动骨性标志配准方法在X、Y、Z方向上的摆位误差情况。
1.6 统计学分析
采用SPSS 20.0软件-对数据进行统计分析,计量资料以均数±标准差(x±s)表示,组间比较采用配对样本t检验。以P<0.05为差异有统计学意义。
2 结果
自动灰度配准在X方向上的摆位误差小于自动骨性标志配准,差异有统计学意义(t=2.100,P<0.05);自动灰度配准和自动骨性标志配准在Y、Z方向上的摆位误差比较,差异均无统计学意义(P>0.05)。自动灰度配准在X、Y方向上的摆位误差均大于自动灰度配准结合手动骨性标志配准,差异均有统计学意义(t=3.306、2.339,P<0.05);自动灰度配准与自动灰度配准结合手动骨性标志配准在Z方向上的摆位误差比较,差异无统计学意义(P>0.05)。自动骨性标志配准在X、Y方向上的摆位误差均大于自动灰度配准结合手动骨性标志配准,差异均有统计学意义(t=3.777、3.016,P<0.05);自动骨性标志配准与自动灰度配准结合手动骨性标志配准在Z方向上的摆位误差比较,差异无统计学意义(P>0.05)。(表1)
表1 3种不同配准方法在 X、 Y、 Z方向上的摆位误差(mm, ±s)
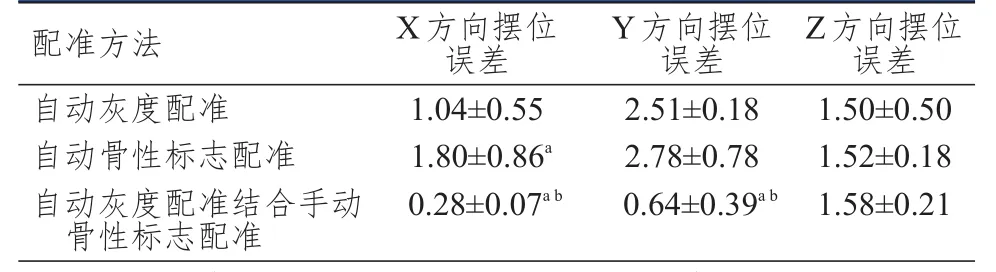
表1 3种不同配准方法在 X、 Y、 Z方向上的摆位误差(mm, ±s)
注:a与自动灰度配准比较,P<0.05;b与自动骨性标志配准比较,P<0.05
配准方法自动灰度配准自动骨性标志配准自动灰度配准结合手动骨性标志配准1.04±0.55 1.80±0.86a 0.28±0.07a b 2.51±0.18 2.78±0.78 0.64±0.39a b 1.50±0.50 1.52±0.18 1.58±0.21 X方向摆位误差Y方向摆位误差Z方向摆位误差
3 讨论
准确摆位是开展精确放疗的重要保证,摆位误差会造成靶区剂量的变化[7-8]。摆位造成的误差包括定位系统的扫描误差、机械误差及加速器的机械误差等,具有规律性和重复性,对某一患者来说在整个治疗过程中是恒定的。对于乳腺癌保乳术患者而言,放疗具有重要的治疗价值[9-13]。乳腺癌保乳术患者进行全乳放疗的过程中,IMRI是占据主导地位的一种模式,但摆位误差、乳腺体积形状改变等因素可对乳腺靶区位移产生影响。针对上述弊端,临床上考虑到CBCT三维影像的优势,将其应用于乳腺癌放疗前的摆位验证中,为放疗精准性的提升及正常组织的保护提供了重要帮助[14-16]。
乳腺癌保乳术后IMRI随机误差中,尤以摆位误差为甚,在选择不同配准方法的情况下,摆位误差也受到一定影响。不同配准方法下的摆位误差亦有不同,本研究中采用自动灰度配准、自动骨性标志配准、自动灰度配准结合手动骨性标志配准等方法,优势在于速度较快、耗时较短,适用于周边骨性组织相对丰富的区域。自动灰度配准是通过配准框内所有图像的不同灰阶来进行计算,计算对象通常为CBCT图像及计划图像的重合情况,同时,这一配准方法还可用于旋转误差的纠正。本研究结果显示,自动灰度配准在X方向上的摆位误差小于自动骨性标志配准,差异有统计学意义(P<0.05),说明在乳腺癌保乳术后选择配准方法时,自动灰度配准在左右方向上的误差低于自动骨性标志配准。自动灰度配准在X、Y方向上的摆位误差均大于自动灰度配准结合手动骨性标志配准,差异均有统计学意义(P<0.05);自动骨性标志配准在X、Y方向上的摆位误差均大于自动灰度配准结合手动骨性标志配准,差异均有统计学意义(P<0.05)。说明自动灰度配准结合手动骨性标志配准在左右、头脚方向上的配准精度和稳定性优于自动灰度配准及自动骨性标志配准。基于乳腺部位软组织丰富而骨性组织相对缺乏的特性,本研究团队建议,在进行CBCT验证时可将自动灰度配准方法作为首选方案,结合周围骨性组织手动调整效果更佳。由于乳腺属于非刚性器官,因此在行CBCT时,患者应配合指导,将乳腺组织充分暴露于放射野内,同时也可有效地确保乳腺组织的形态紧张度。在放疗过程中,也应充分对肌肉张力、皮肤脂肪厚度等因素予以足够重视,防止对摆位误差产生不良影响。
乳腺癌保乳术后摆位误差的减少途径越来越多,CBCT即为其中较为典型的一种方法。在今后乳腺癌保乳术后放疗中,可考虑将CBCT作为可行的图像引导方案,对于提高配准精度、减少摆位误差均具有重要意义。同时,还应充分结合靶区外界的情况,选取合适的时机进行复位,并重新进行CT扫描,拟定治疗计划,以确保治疗效果的最优化。
