改良盆底缝合术在肛提肌外腹会阴联合切除术治疗低位直肠癌患者中的应用
2020-09-14王健高军曹原
王健,高军,曹原
北京市第六医院普外科,北京100007
直肠癌是消化系统常见恶性肿瘤,在中国,直肠癌患者中约75%为低位直肠癌[1]。腹会阴联合切除术(abdominal perineal resection,APR)是手术治疗低位直肠癌的重要术式,于1908年由外科医师Miles首先报道,但该术式易出现环周切缘(circumferential resection margin,CRM)阳性及术中穿孔[2]。为改善传统APR术式缺点,近年来提出的肛提肌外腹会阴联合切除术(extralevator abdominoperineal excision,ELAPE)具有降低CRM阳性率和术中穿孔率的优势[3]。然而ELAPE术式因手术切除范围扩大,增加了盆底重建难度。目前ELAPE术中常用的盆底重建方式包括肌皮瓣移植、生物补片修补以及直接缝合等,但哪种方式更优尚未有定论[4]。北京市第六医院近年来在ELAPE术中应用改良缝合技术行盆底腹膜关闭,取得了良好效果。为此,本研究回顾性分析改良盆底缝合术在ELAPE治疗低位直肠癌患者中的应用效果,并与生物补片重建盆底技术进行对比,旨在评估改良盆底缝合术的安全性和有效性,以期为临床提供依据,现报道如下。
1 资料与方法
1.1 一般资料
收集2015年2月至2018年4月于北京市第六医院行ELAPE手术的低位直肠癌患者的病历资料。纳入标准:①经电子肠镜、组织病理学确诊为原发性直肠癌;②年龄18~80岁;③肿瘤下缘与肛缘距离小于5 cm;④行根治性ELAPE手术。排除标准:①伴有明确远处转移灶;②合并肠梗阻、肠穿孔等急性并发症;③妊娠期和哺乳期;④临床资料不完整。根据纳入、排除标准,共纳入64例低位直肠癌患者,按术中盆底缝合重建方式不同分为生物补片组(n=34)和改良缝合组(n=30)。生物补片组中,男19例,女15例;年龄39~80岁,平均(59.72±10.16)岁;体重指数(body mass index,BMI)为(25.16±2.85)kg/m2;TNM分期:T3期21例,T4期13例。改良缝合组中,男18例,女12例;年龄36~79岁,平均(58.34±9.48)岁;BMI为(25.60±3.07)kg/m2;TNM分期:T3期19例,T4期11例。两组患者性别、年龄、BMI、TNM分期比较,差异均无统计学意义(P>0.05),具有可比性。
1.2 手术方法
改良缝合组:全身麻醉后,患者取改良截石位。常规消毒后,按照全直肠系膜切除术原则锐性分离直肠系膜至骶骨岬,术中注意保护上腹下神经丛、双侧腹下神经、输尿管及生殖血管等,沿直肠后间隙分离直肠至尾骨尖平面,分离两侧直肠侧韧带。距离肿瘤10~15 cm处切断乙状结肠,充分止血并于直肠后方填塞一块纱布,以作为会阴部操作的标志。将远端直肠和直肠系膜推向盆腔,于乙状结肠造口前,使用倒刺线连续缝合关闭盆底腹膜,然后进行乙状结肠造口术。造口结束后,变换患者体位为折刀位,荷包缝合关闭肛门,围绕肛门做梭形切口,于肛门外括约肌外侧进行分离,环周解剖肛提肌,如有必要,可行部分尾骨切除。切断两侧肛提肌,取出预置的纱布及柱状标本,于骶前间隙放置引流管并逐层关闭会阴切口。
生物补片组:不进行盆底腹膜缝合,患者行乙状结肠造口术后,变换体位至折刀位,荷包缝合关闭肛门,围绕肛门做梭形切口,于肛门外括约肌外侧进行分离,环周解剖肛提肌。切断两侧肛提肌,取出预置的纱布及柱状标本。将人脱细胞真皮基质补片以Prolene缝线连续缝合固定于肛提肌腱弓,并于补片下方放置引流管,逐层关闭切口。
1.3 观察指标
两组患者术后均随访观察1年,以电话及门诊复查方式进行。记录患者围手术期相关指标、术后并发症发生情况以及随访期内复发、转移及生存情况。总生存率计算终点为各种因素导致的死亡。
1.4 统计学方法
采用SPSS 20.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,组间比较采用两独立样本t检验;计数资料以例数及率(%)表示,组间比较采用χ2检验或Fisher确切概率法;采用Kaplan-Meier法绘制生存曲线,生存分析采用Logrank检验。以P<0.05为差异有统计学意义。
2 结果
2.1 围手术期指标的比较
两组均顺利完成手术。两组患者手术时间及术中出血量比较,差异均无统计学意义(P>0.05);生物补片组患者盆底重建时间明显短于改良缝合组,术后住院时间明显长于改良缝合组,住院总费用明显多于改良缝合组,差异均有统计学意义(P<0.01)。(表1)
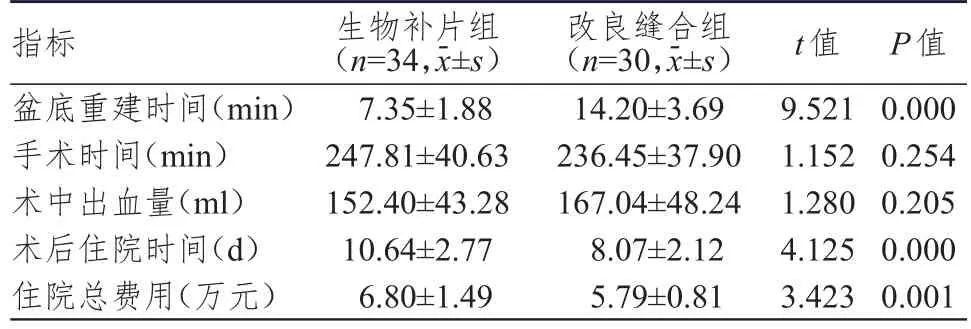
表1 两组患者围手术期指标的比较
2.2 术后并发症发生情况的比较
两组患者术后并发症总发生率比较,差异无统计学意义(P>0.05)。(表2)

表2 两组患者术后并发症发生情况的比较
2.3 复发、转移情况及生存分析
术后1年内生物补片组患者局部复发3例,远处转移5例,4例因远处转移死亡;改良缝合组患者局部复发2例,远处转移4例,3例因远处转移死亡;两组患者局部复发率、远处转移率及1年总生存率比较,差异均无统计学意义(P>0.05)。(表3、图1)

表3 两组患者术后随访期内复发、转移及生存情况的比较[n(%)]
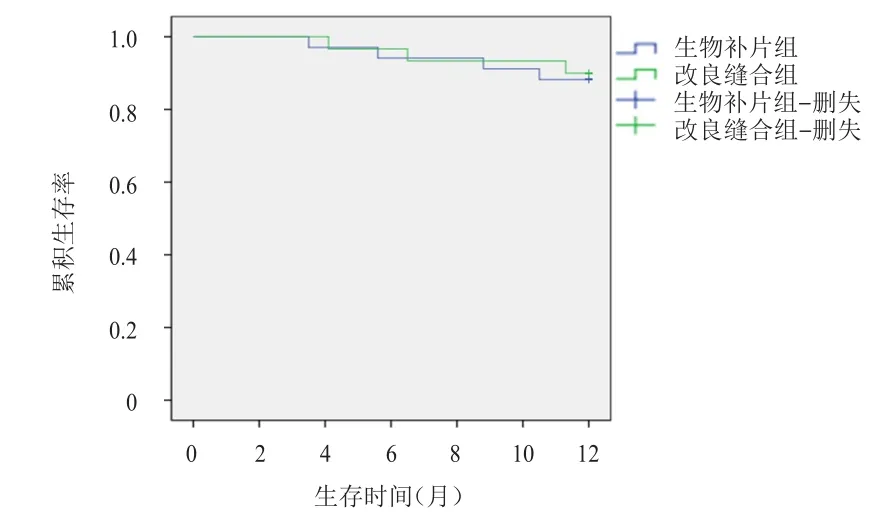
图1 生物补片组(n=34)和改良缝合组(n=30)患者的生存曲线
3 讨论
对于未发生远处转移的低位直肠癌患者,根治性手术切除是治疗的主要手段。ELAPE术式增加了手术切除范围,降低了CRM阳性率和局部复发率,且手术视野较好,该术式在国内最早于2008年开展,经过数年的临床应用,ELAPE在低位直肠癌中的应用取得了较好的成果[5-6]。ELAPE术中腹部和会阴手术不能同时进行,手术顺序采取先腹部后会阴,在本研究中完成下腹部操作后,再将患者体位调整为俯卧折刀位进行会阴部操作,这种体位使手术视野暴露更充分,术中沿肛门括约肌-肛提肌外侧缘进行解剖操作,仅需切断会阴部向直肠的分支血管,出血量少。
研究显示,直肠癌根治性切除术后CRM阳性与局部复发密切相关[7]。王琦等[8]在一项荟萃分析中对ELAPE和传统APR术进行了比较,发现ELAPE组术中穿孔率及复发率均低于APR组。相较于传统APR手术,ELAPE增大切除范围至肛提肌外侧,降低了CRM阳性率,但是手术造成会阴缺损大,提高了盆底重建难度及会阴部伤口并发症发生率[9]。目前针对ELAPE术后盆底重建的方法主要有直接缝合、肌皮瓣移植和生物补片修补[10]。报道显示ELAPE术后直接缝合会阴部缺损,会阴部并发症发生率高达40%以上[11]。随着研究的深入,相继有学者使用臀大肌皮瓣和腹直肌皮瓣进行盆底重建。Nelson和Butler[12]在一项病例对照研究中发现应用腹直肌皮瓣进行盆底重建时,患者会阴部切口并发症发生率明显低于应用臀大肌皮瓣的患者。然而ELAPE术中采用肌皮瓣移植术既延长了手术时间还提高了皮瓣供应区并发症发生率[13]。随着生物材料技术的发展,生物补片被逐渐应用于ELAPE盆底重建中,在国内一项纳入102例行ELAPE手术的低位进展期直肠癌患者的多中心前瞻性研究中,83例患者采用生物补片进行盆底重建,19例患者进行直接缝合,研究结果显示使用生物补片进行盆底重建可以显著降低会阴部切口相关并发症发生率[14]。本研究中,采用改良缝合技术进行盆底腹膜缝合,并与生物补片修补技术进行比较,结果显示改良缝合技术进行盆底重建时间长于生物补片修补,但并未延长总体手术时间,接受改良缝合技术的患者术后住院时间更短,同时治疗费用更低,两种盆底重建方式术后并发症并未发现差异。在ELAPE中,改良缝合技术具有一定操作难度,要求操作者具有丰富的临床经验,在进行直肠及乙状结肠游离时,应尽可能预留盆底腹膜,这样在缝合关闭盆底腹膜时相对简单。对于存在盆底腹膜缺损者,这种缝合方式并不适用,应采取其他盆底重建方式。另外,本研究对两组患者的生存情况分析发现,两组患者1年生存率无明显差异,提示两种盆底重建方式对患者短期预后影响无明显差异,然而其对长期预后的影响有待进一步随访观察。
综上所述,ELAPE术中,与采用生物补片进行盆底重建相比,改良缝合技术具有住院时间短、费用低等特点,其应用于低位直肠癌ELAPE术中安全、可行。本研究为回顾性研究,纳入病例数有限,更全面、准确的结论有待前瞻性、多中心研究进行验证。
