心包剥脱术治疗缩窄性心包炎患者的近期疗效分析
——单中心结果
2020-09-08曹安强程力剑
曹安强,罗 勇,袁 武,程力剑,陈 剑,王 伟,赵 龙,陈 杰
(成都市第三人民医院成都市心血管病研究所心内科,成都 610504)
慢性缩窄性心包炎是一种心包慢性炎性病变所导致的疾病。以结核为主的多种原因导致心脏、壁层心包发生炎性改变,进而出现纤维化,最终出现心包组织增厚、缩窄、钙化;逐渐压迫心脏及部分大血管,导致以心脏舒张期充盈受限为主的循环障碍性疾病[1]。缩窄性心包炎病程迁延,对全身多脏器影响大,诊断、治疗较困难。心包剥脱术是目前治疗缩窄性心包炎最有效的方法[2-4]。心包剥脱术是一个门槛不高的外科手术,但要想把手术做得“干净”,让患者能最大获益却十分困难[5]。近5 年成都市第三人民医院单中心、单个人完成心包剥脱术127 例,在围术期管理和手术细节方面有所心得,报道如下。
1 资料和方法
1.1 一般资料
收集 2015 年 3 月至 2019 年 3 日成都市第三人民医院完成心包剥脱术的患者127 例,其中男82例,女45例。年龄3~79岁。病史3个月至14年。首次行心包剥脱123 例,二次手术4 例(2 例于外院行心包剥脱术半年和两年后又出现药物难以控制的双下肢水肿;其余2 例为心包剥脱术后5 年的患者,症状复发)。按照发病至手术前的病程分为 5 组:3 个月内组,3~6 个月组,6~12 个月组,1~3 年组,3 年以上组;主要症状:心累、气促,夜间不能平卧,腹胀、纳差,恶心、呕吐,乏力,下肢、睾丸等部位水肿。体征:颈静脉充盈或怒张,奇脉,心尖搏动减弱或消失,心音低钝或遥远,肝脏增大,腹水,下肢水肿,胸腔积液,睾丸水肿等。心功能分级(纽约心脏协会分级):Ⅰ级12 例,Ⅱ级43 例,Ⅲ级63 例,Ⅳ级9 例。其中12 例合并心房纤颤,1 例行术中肺静脉隔离和左心耳结扎;4 例合并需处理的冠状动脉(冠脉)问题,2 例前降支病变同期行左乳内动脉-前降支旁路移植术,1 例回旋支闭塞性病变术中暴露差未予处理,1 例前降支合并右冠脉主干病变,术中行前降支旁路移植术成功,右冠脉暴露差,术后1 周于心内科行经皮冠脉介入治疗;术中考虑同期处理的瓣膜性疾病4 例,其中2 例为二尖瓣中度以上反流,1 例为三尖瓣重度反流,术中在体外循环下手术;1 例18 岁女性患者术前二尖瓣中度反流,术中完成心包剥离,完全松解房室沟缩窄环后,术中经食管超声心动图检查提示二尖瓣反流轻微,未予处理,3 个月后复查超声心动图提示二尖瓣反流消失。
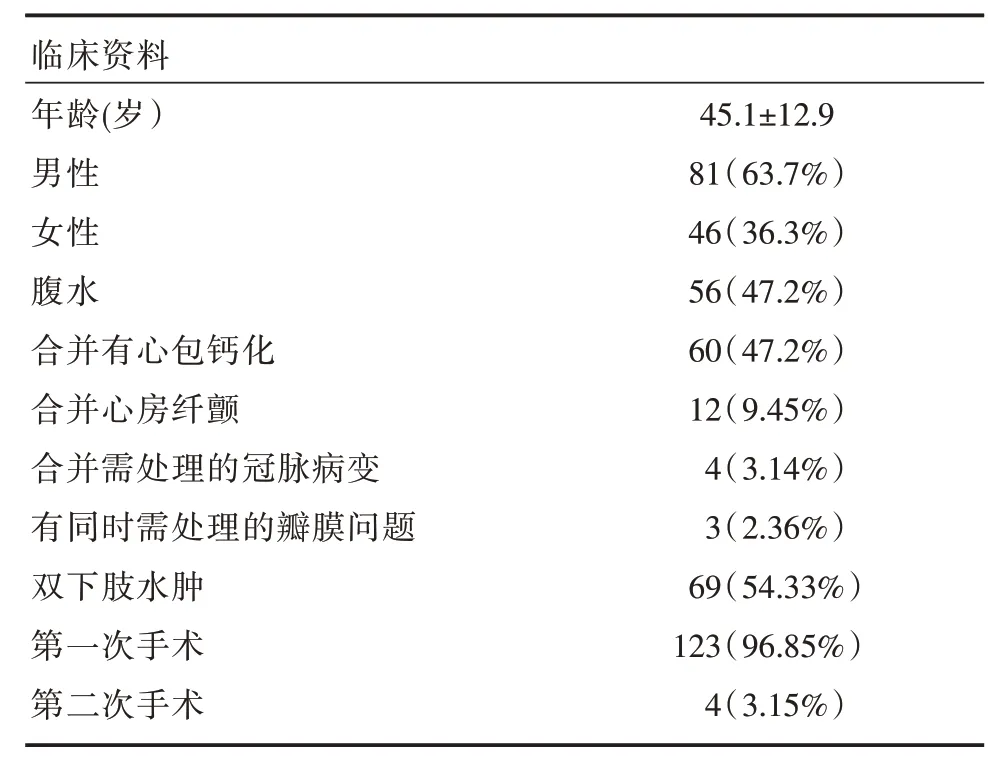
表1 患者临床资料分析 [n(%)]
1.2 术前检查及准备工作
所有患者术前均进行痰查抗酸杆菌并抽血行结核菌素试验;常规完成胸部计算机断层扫描(CT)、X 线胸片、超声心动图、腹部超声、动态心电图、肺功能检查;女性≥50 岁,男性≥45 岁行冠脉造影检查;入院后均首选静脉用洋地黄制剂,部分患者对静脉洋地黄制剂不耐受则使用口服地高辛治疗,其中7 例对地高辛不耐受,术前使用米力农进行最少1 周的治疗;术前使用利尿药降低容量负荷,达标要求为患者术前双下肢无水肿或水肿基本消退;术前严格的呼吸道准备,包括严格的呼吸训练、呼吸道雾化、口服或静脉用祛痰药物、必要的抗感染治疗、术前对胸腔积液的处理;术前3 d 要求血中白蛋白浓度达到正常水平。
1.3 手术方式
本组所有患者均采用气管插管,在静脉复合麻醉下手术。1 例3 岁男孩因入院时病情极其危重,高热、呼吸及循环衰竭担心无法耐受胸骨正中切口手术而行左胸部切口手术。其余患者全部经胸骨正中切口行心包剥脱术。手术剥离方法:暴露升主动脉-左心室流出道-左心室面-心尖-右心室流出道及右心室-房室环-右心房-上、下腔静脉。心包切除范围:两侧最少至隔神经前缘,上至大血管根部,下至隔面及心尖,充分松解上、下腔静脉到右心房入口,完全松解房室环。
1.4 统计学分析
采用SPSS 19.0 软件进行统计学分析,计数资料以[n(%)]表示,组间比较采用卡方检验。计量资料以()表示,两两比较采用LSD检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 全组一般情况
缩窄性心包炎3 个月以下病程的患者症状相对较轻,多于内科或社区进行初步治疗,体征多不明显,但仍有心包结核伴肺部结核活跃的患者入院急诊进行外科手术治疗。心包缩窄症状出现导致入院的患者的病程以3 个月到12 个月最多,占总人数比例为68.5%,在此病程区间的患者多于内科进行相应治疗,诊断相对明确。3~6 个月组和6~12 个月组患者的症状严重程度及体征严重程度相似,差异无统计学意义(P>0.05);病程一年以上入院进行手术的患者约21.7%,此类患者多伴有严重的症状:双下肢水肿、多浆膜腔积液。
2.2 全组治疗结果
本组127 例均顺利完成手术,围术期死亡3例:1例76岁老年患者,半年于外院行一次心包剥脱术,术后2 个月开始发生严重心功能不全,收入我科并行手术;术中开胸时发生升主动脉破裂,立即行股动脉插管在体外循环下手术,最终发现撕裂处累及冠脉,术中行冠脉旁路移植术+心包剥脱术,术后患者死于严重低心排血量综合征和恶性心律失常;1 例为39 岁中年女性患者,术后8 h 顺利拔除气管插管,术后48 h 于重症监护室(ICU)发生心搏呼吸骤停,经抢救无效死亡;1 例为21 岁青年男性,术后18 h 由监护室转回普通病房,突发心室颤动最终抢救无效死亡。随着病史延长,患者手术后相应肺部并发症、低心排血量综合征发生率有明显增加,尤其当病程超过3 年后,低心排血量综合征发生率较其他组有明显增加,住院时间明显延长。3 年以上组住院时间及低心排血量综合征发生率与其他组比较,差异有统计学意义(P<0.05)。病程长并不增加手术时间,而3~6 个月组外科医生对手术满意度最差,反而病程超过6 个月组外科医生对手术满意度较好。不同病程组患者手术时间、住院时间、医生手术满意度、并发症发生率等比较,详见表2。

表2 不通病程组患者手术时间、住院时间、医生手术满意度、并发症发生率等的比较
3 讨 论
3.1 术前准备工作
3.1.1 术前心功能调整 缩窄性心包炎患者术前因为心包缩窄导致心室肌肉呈现盔甲样包裹,收缩及舒张能力均受限,心室肌无法达到锻炼的目的,久之导致心室肌能力衰退,故术后发生低心排血量综合征的可能性增加[6]。术前使用洋地黄类药物进行心脏功能改善,增加心室肌能力是必要的,重点在于药物使用后,心室做功增加,从而达到锻炼心肌的目的[7]。本中心缩窄性心包炎术前准备工作平均时间为14 d,有的老年患者术前调整期可能达1~2 个月,以保证术前心肌收缩能力得到改善。
3.1.2 术前营养支持 缩窄性心包炎一般病史较长[8],术前营养状态较差,多伴有低蛋白血症,术前营养支持非常重要[9],术前纠正低蛋白血症需更加积极,术前3~5 d 内需尽可能纠正低蛋白血症。
3.1.3 术前肺功能及多浆膜腔积液的处理 缩窄性心包炎患者术前多数伴有多浆膜腔隙积液,对此类积液的积极处理是非常重要,胸腔及腹腔积液都会影响患者术前的呼吸状态,多量的胸腔积液会导致术前肺不张,如不积极处理,手术后可能导致氧合差,痰量增多,复张性肺水肿等不良事件的发生[2]。
3.2 手 术
3.2.1 手术切口选择 手术切口的正确选择在缩窄性心包炎手术中起重要作用。切口的选择曾有不同声音,但近年胸骨正中切口手术被大家所接受[10]。有报道认为胸骨正中切口对左心室和隔面的暴露困难,实际上在暴露左心室面过程中对心脏进行挤压和搬动而导致的血流动力学不稳定才是真正的困难;如同不停搏冠脉旁路移植术进行回旋支的处理,术中可与麻醉师进行密切配合,合理运用体位与血管活性药物控制血压,基本上可顺利完成左心室面的操作;而隔面在手术过程中暴露充分,并未发现有困难。所以,胸骨正中切口是心包剥离术的最佳选择。
3.2.2 心包剥脱技巧 手术剥离顺序:暴露升主动脉-左心室流出道-左心室面-心尖-右心室流出道及右心室-房室环-右心房-上、下腔静脉。首先进行升主动脉的剥脱,术者经验:升主动脉处增厚黏连的心包界限容易找出,且暴露的升主动脉也可作为紧急体外循环插管的位置。心室肌肉较厚,剥脱过程中发生心室破裂的可能性极小,本组无发生心室破裂而中转体外循环手术的患者。但粗暴剥脱,对层次判断失误或解剖不熟悉损伤冠脉,仍有可能造成心室大出血而需中转体外循环可能。在心室剥脱过程中,切忌打洞式剥脱,而应该寻找间隙,以面带点,一带一路,坦克式剥离。
心房炎变后瘢痕形成多引起心房位置发生较明显改变,而且心房壁薄,炎变后水肿严重,是术中容易发生破裂大出血的部位。本组1例14岁女性,术中进行右心房剥离时破裂出血,因心脏严重水肿和空间结构的紊乱,缝合困难,导致破口增大,出血难以控制,立即中转体外循环,最终顺利完成手术。术者经验:心房有小破口,可使用5-0prolene线缝合,先控制较大出血,再进一步控制小的出血,切忌慌张使用大针缝合,导致不可控的出血。
房室环位置较深,尤其是左心房室环,常常伴有严重的钙化嵌入导致剥离困难,但此类患者房室环充分剥离的意义显得尤其重要,术者经验:充分剥离心室面,抬高心尖,与麻醉师配合维持循环稳定,直视下充分剥离房室环的缩窄,此处操作风险极高,如出现大出血将是致命的。
3.2.3 心包切除范围及程度 经典的心包剥脱手术要求:两侧至隔神经前缘,上至大血管根部,下至隔面及心尖,充分松解上、下腔静脉到右心房入口,完全松解房室[11]。国内有报道认为,心包剥脱术应尽可能解除增厚心包对心脏的束缚,并尽量减少发生再缩窄的组织学基础[10,12]。我们认为缩窄性心包炎的剥离范围应该为心包整体切除,心包剥离后心脏原有的生理游离缘及面应该完全松解,心尖可以完全抬起,与以上报道观点一致。既往报道提示:遇到难以剥脱的位置可留置岛状心包,达到松解目的本组留置岛状患者少见,仅见于病程在3~6 个月的患者,增厚心包组织层次不清晰,水肿严重,难以剥离,最后留少许岛状心包。对病程超过6 个月的患者进行心包剥脱,界限较明显,即使有钙化,也较容易找到突破口而进行心包全部剥离。
3.2.4 心包缩窄病程的影响 本组研究发现随着患病时间的增加,缩窄性心包炎患者临床症状发生率、严重程度和术后低心排血量综合征等不良事件发生率会相应增加。因此,缩窄性心包炎应尽早积极手术治疗[13-15]。关于病程与手术难度的关系,本组患者与多数报道稍有不同。本组研究病程时间在3~6 个月组患者的手术平均时间最长,而且剥离效果稍差;对于病程超过6 个月的患者,手术剥离难度相对较小,即使有较长病程及有严重心包钙化的患者,也不会增加手术时间。究其原因,3~6 个月期间心包与心肌间隙不明确,且增厚心包组织水肿较严重,剥离难以成型,导致手术难度增加,并且有多处小片状、岛状再缩窄组织基础遗留,可能造成远期的再缩窄。基于此,对于病程在3~6个月间,患者状态较稳定者,是否首先可采用内科保守治疗,随访并等待病程达到6 个月再进行手术,患者能否因此而获得更好的远期效果,值得研究。
3.2.5 体外循环的使用 报道显示体外循环是心包剥脱术的危险因素[16]。我们认为是否体外循环并非探讨的关键,因为术中循环不稳定和大出血才会中转体外循环,因此,体外循环是保障手术的安全屏障[17]。体外循环的准备对心包剥脱手术是非常有必要的,有体外循环的存在可使心脏外科医生进行心包剥脱时更有信心。
3.2.6 外科监护室的治疗 心包剥脱术有着较高的并发症发生率和病死率,其病死率高于一般心外科手术[18]。术后低心排血量综合征是围术期死亡的主要原因之一[19-20],本组术后低心排血量综合征发生率为6.93%,1 例的死因为低心排血量综合征。我们认为,对于术后低心排血量综合征的治疗应开始于术前,术前使用洋地黄制剂使心肌得到锻炼,对防止术后低心排血量综合征有效。容量管理是缩窄性心包炎术后管理的重要环节,而术前对容量的严格控制,尽量纠正低蛋白血症是容量管理的第一步,也是最重要的一步,如术前患者仍有明显的第三间隙水肿,术后容量管理会十分困难。
4 结 论
缩窄性心包炎随着病程时间的延长,手术后肺部并发症、低心排血量综合征发生率可明显增加,尤其当病程超过3 年后,低心排血量综合征发生率较其他组有明显增加,住院时间明显延长,因此,缩窄性心包炎应尽可能早行外科手术治疗。术前针对性的强心、营养、容量控制可减少术后并发症发生率。缩窄性心包炎病史的长短不会严重增加手术难度和手术时间,3~6 个月病程组患者的外科手术操作性差,外科医生手术满意度最差,心包组织残留率高,在病情稳定的情况下可酌情推后手术时间。缩窄性心包炎的心包剥脱“应该”而且“可以”完全剥离,手术应尽量做到不残留再狭窄的组织基础,外科医生的技术和策略对患者围术期生存率及远期效果有很大影响。经胸骨正中切口行心包剥脱术暴露好,安全性高,是缩窄性心包炎手术的较好选择。体外循环是缩窄性心包炎手术中的重要准备,有体外循环的支撑,外科医生对心包剥脱术可更加自信从容。
