主动脉瓣置换术后发生低心排出量综合征的预测因素探讨
2014-04-13马红张其霞李晓静郑晓燕
马红 张其霞 李晓静 郑晓燕
主动脉瓣置换术后发生低心排出量综合征的预测因素探讨
马红 张其霞 李晓静 郑晓燕
目的 探讨患者在主动脉瓣置换术后发生低心排出量综合征的预测因素。方法300例瓣膜置换术的患者,其中主动脉狭窄(AS)和主动脉瓣关闭不全(AI)患者各150例,观察和记录所有患者出现低心排出量综合征的情况及相关因素。结果术后有86例患者(28.6%)出现低心排出量综合征,其中AS患者39例(26.0%),AI患者47例(31.3%)。下列因素与低心排出量综合征的发生相关:AS术前因素包括高龄(OR=4.7)、术前肥胖(OR=1.8)、心力衰竭病史(OR=1.7)、收缩末期室间隔厚度(OR=5.5)、舒张末期室间隔厚度(OR=4.2)、左房内径(OR=1.6)、二尖瓣和三尖瓣反流(OR=1.9、1.5);术后早期因素包括LVEF≤50.0%(OR=5.4)、左心室收缩末期直径(OR=1.7)、舒张末期直径(OR=1.9)及二尖瓣反流(OR=4.1)。AI术前因素高龄(OR=1.9)、术前肥胖(OR=4.8)、心力衰竭病史(OR=1.7)、LVEF≤50.0%(OR=1.8)、左心室收缩末期直径(OR=4.5)和舒张末期直径(OR=6.4)、收缩末期室间隔厚度(OR=1.5)、舒张末期室间隔厚度(OR=1.6)、三尖瓣反流(OR=1.5)。术后早期因素,包括LVEF≤50.0%(OR=7.2)、左心室收缩末期直径(OR=4.7)及舒张末期直径(OR=6.1)。结论主动脉瓣置换术后发生低心排出量综合征风险很高,可以根据术前及术后早期的相关因素进行预测。
主动脉瓣病变 瓣膜置换手术 低心排出量综合征 预测因素
目前,心脏疾病患者行心血管手术后并发症发生率仍然居高不下,心房颤动、谵妄、肾功能衰竭以及呼吸系统并发症等仍然严重影响患者预后[1]。低心排出量综合征是术后并发症中最危险的因素,可以使术后患者的血流动力学参数显著恶化,延长患者在ICU的停留时间,影响患者的预后,并与术后死亡具有密切的关系[2-3]。近年来研究发现,术前肾功能衰竭、低左心室射血分数(LVEF<35.0%)、高龄(>70岁)、体外循环时间、主动脉阻断时间、病程、重复手术以及心肌梗死等因素在心血管手术后低心排出量的发生中起着重要的作用[4-5]。为了降低瓣膜置换术后出现低心排出量的风险,笔者研究分析了术后低心排出量的预测因素,以期为临床预防和治疗提供帮助。
1 资料和方法
1.1 一般资料 选择2010-03—2013-11在我院进行瓣膜置换术的患者,其中主动脉瓣狭窄(AS)和主动脉瓣关闭不全(AI)患者各150例。男143例,女157例,年龄51~72岁,平均(61.5±5.4)岁。平均体表面积(BSA)为(1.87±0.21)m2,平均体重指数(BMI)为(26.75±3.42)kg/m2。所有患者的合并症情况如下:高血压患者195例(64.7%);糖尿病60例(20.0%);肾功能衰竭11例(3.67%),血肌酐增加>基线的3倍,肾小球滤过率<75.0%,或血肌酐≥354μmol/L,且血肌酐急性升高44.2μmol/L,尿量<0.3ml/(kg·h)持续24h或无尿12h;心力衰竭51例(17.0%),LVEF<35.0%。所有患者术前行冠状动脉造影,时间为19~63h,平均(33.0±7.7)h,冠状动脉均无明显病变。本次研究得到了我院伦理委员会的批准,研究前均告知患者及其家属并签署知情同意书。
1.2 方法 所有患者在体外循环下进行心脏瓣膜置换,植入的机械瓣膜或人工瓣膜为19~31mm。术前以及术后早期(术后4~21d,平均9d)均进行超声心动图检查,术后18~24个月,平均21个月随访。检查下列超声心动图数据:LVEF,左心室收缩末期内径(LVESd),左心室舒张末期内径(LVEDd),左心室收缩末期室间隔厚度(ESIVST),左心室舒张末期室间隔厚度(EDIVST),左房内径(LAd),AS患者的平均和最大跨瓣压差。所有患者术前的临床资料见表1。
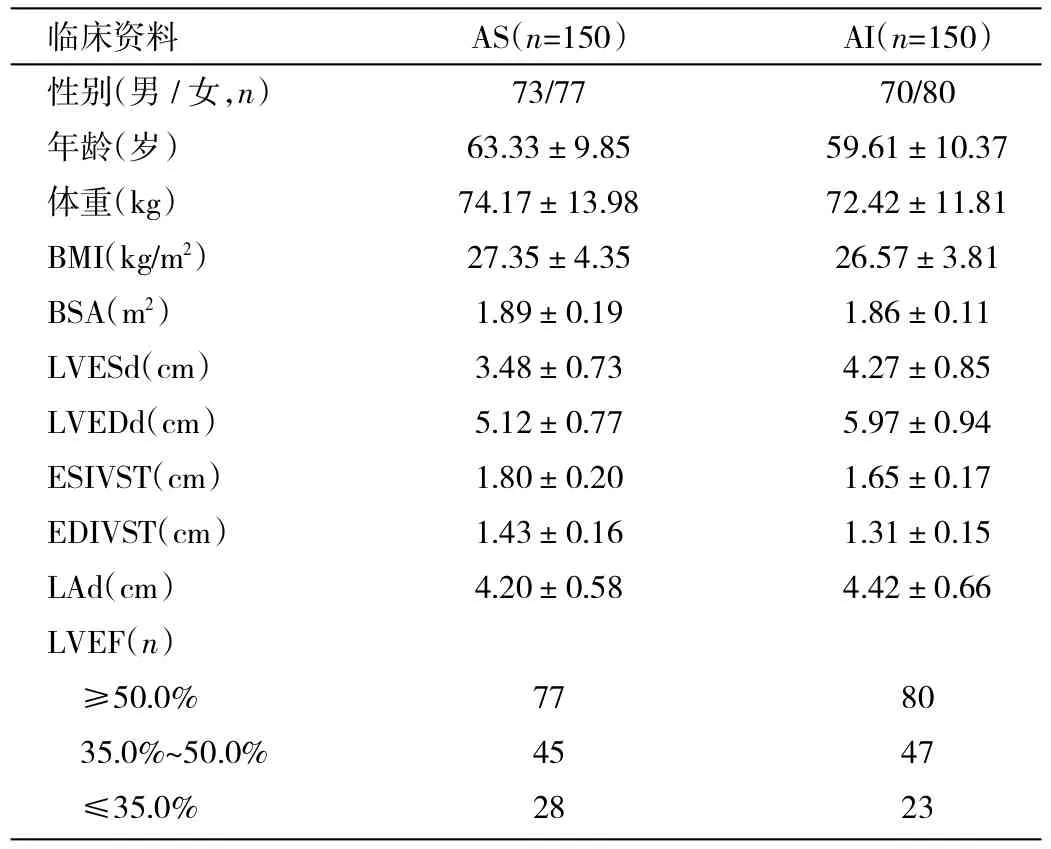
表1 患者术前临床资料
1.3 低心排出量综合征的判断 监测患者的收缩压(SBP)、中心静脉压(CVP)、尿量、中心体温与体表温度以及心脏指数(CI)。当SBP下降>20.0%持续≥2h;CVP>1.7kPa持续≥2h;尿量<0.5ml/(kg·h)持续≥2h;中心体温与体表温度的差值>5℃,导致四肢发冷持续≥2h;CI<2.5ml/m2。上述2种及2种以上的情况出现时,即为低心排出量综合征[6]。
1.4 统计学处理 采用SPSS 18.0统计软件,危险因素与病死率的关系采用单变量分析,诊断的有效性采用ROC曲线分析,结果以曲线下面积(AUC)和95%可信区间(95%CI)表示。经单变量分析P<0.05的危险因素再使用多变量logistic回归进行分析,结果包括比值比(OR)、P值和95%CI,P<0.01即为引发低心排出量综合征的独立危险因素。
2 结果
术后共有86例患者出现低心排出量综合征,包括39例AS患者和47例AI患者。
2.1 AS患者 AS患者中共有39例(26.0%)患者出现低心排出量综合征,未出现低心排出量的患者111例(74.0%)。两者在ICU停留的时间分别为(3.41±3.33)d和(2.46±2.11)d,住院时间分别为(13.99±7.12)d和(10.91± 4.61)d,术后患者早期死亡分别为4例(10.3%)和4例(3.6%),经随访记录,术后长期死亡分别为4例(10.3%)和5例(4.7%),比较均有统计学差异(均P<0.01)。同时,低心排出量还是患者术后死亡的独立危险因素(OR= 7.5,95%CI:1.9~14.8,P<0.01),见图1。
单变量相关分析提示,瓣膜置换术后AS患者出现低心排出量综合征的术前预测因素包括年龄≥70岁、BMI≥30kg/m2、心力衰竭病史、ESIVST≥1.80cm和EDIVST≥1.40cm、LAd≥4.20cm、轻度二尖瓣和三尖瓣反流。术后早期因素包括LVEF≤50.0%、ESIVST≥1.80cm、EDIVST≥1.40cm和轻度二尖瓣反流。多变量logistic回归分析表明,5种因素是AS患者术后出现低心排出量的独立危险因素,术前因素中年龄≥70岁,ESIVST≥1.80cm,EDIVST≥1.40cm;术后早期因素中的LVEF≤50.0%以及轻度二尖瓣反流,见表2。
2.2 AI患者 AS患者中共有47例(31.3%)患者出现未出现低心排出量综合征,未出现低心排出量的患者103例(68.7%),两者在ICU停留的时间分别为(3.41±3.33)d天和(2.46±2.11)d;住院时间分别为(13.99±7.12)d和(10.91±4.61)d;术后早期死亡分别为4例(10.3%)和4例(3.6%);经随访记录,术后长期死亡分别为4例(10.3%)和5例(4.7%),比较均有统计学差异(均P<0.01)。同时,低心排出量还是患者术后死亡的独立危险因素(OR= 8.1,95%CI:2.3~15.1,P<0.01),见图2。
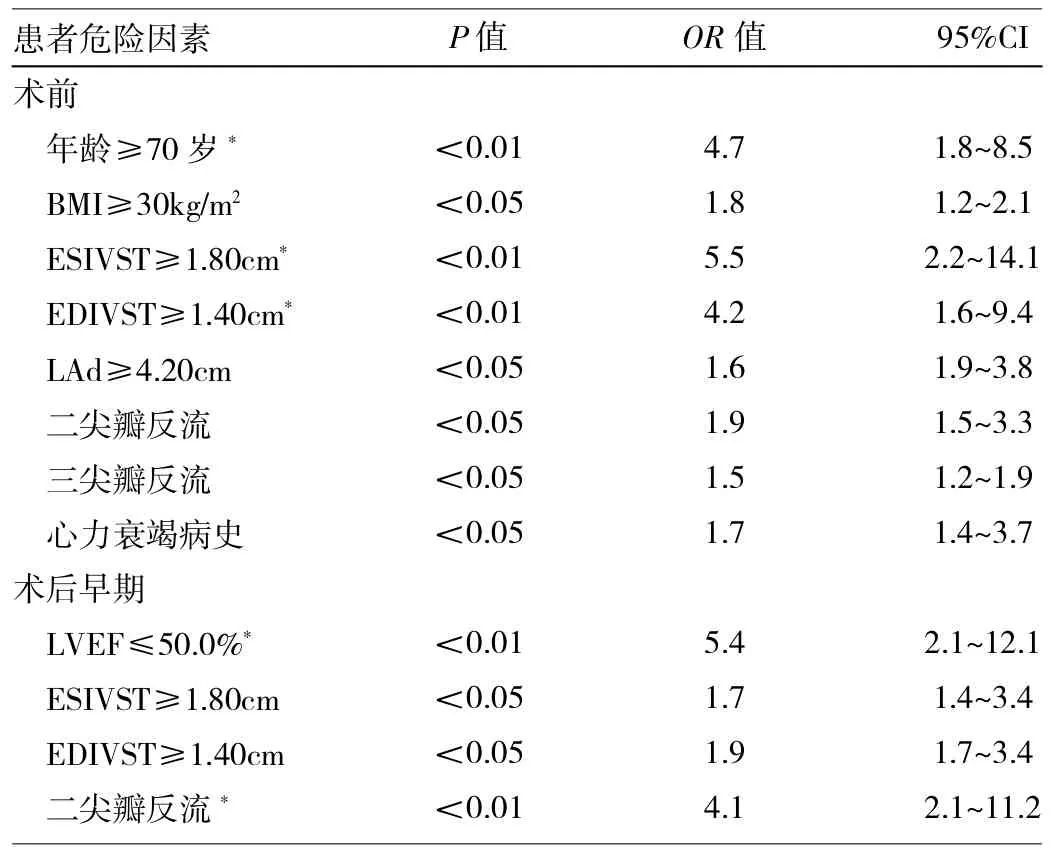
表2 AS患者瓣膜置换术前和术后早期的危险因素

表3 AI患者瓣膜置换术前和术后早期的危险因素

图1 术后低心排出量预测AS患者预后的ROC曲线(AUC= 0.942)
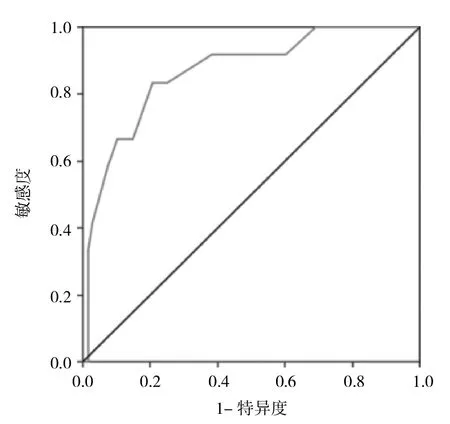
图2 术后低心排出量预测AI患者预后的ROC曲线(AUC= 0.868)
单变量相关分析提示,瓣膜置换术后AI患者出现低心排出量综合征的术前预测因素包括年龄≥70岁、BMI≥30kg/m2、LVEF≤50.0%、心力衰竭病史、LVESd≥4.15cm和LVEDd≥5.90cm、ESIVST≥1.60cm、EDIVST≥1.35cm和三尖瓣反流。术后早期因素包括LVEF≤50.0%、LVESd≥4.15cm和LVEDd≥5.90cm。多变量logistic回归分析表明,6种因素是AI患者术后出现低心排出量的独立危险因素,术前因素中的BMI≥30kg/m2、LVESd≥4.15cm和LVEDd≥5.90cm;术后早期因素中的LVEF≤50.0%,LVESd≥4.15cm和LVEDd≥5.90cm,见表3。
3 讨论
低心排出量综合征是心血管术后常见的并发症,明显增加了患者在ICU停留的时间以及住院时间,而且可以增加患者死亡的风险[7-8]。本研究观察到高BMI、高龄、低LVEF,以及其他轻微的瓣膜病变等都会增加AS或AI患者瓣膜置换术后出现低心排出量的风险。
Maganti等[7]对主动脉瓣手术患者进行了研究,2 255例患者中均未并发其他心血管疾病,术后3.9%出现低心排出量综合征。预测低心排出量综合征的因素主要包括肾衰竭、LVEF≤40.0%、休克、女性和高龄等。充血性心力衰竭、高血压、肾功能衰竭、中风和主动脉瓣大小等因素还与患者病死率相关。Rao等[9]研究了冠脉搭桥术后出现低心排出量综合征的情况,在纳入研究的4 558例患者中有412例(9.1%)患者出现低心排出量综合征,出现低心排出量综合征患者的病死率为16.9%,显著高于未出现者的0.9%。logistic回归分析表明,与LVEF≤40.0%、重复手术、女性、≥70岁、急诊手术、左冠状动脉狭窄、心肌梗死以及伴随糖尿病等8大因素相关。目前关于瓣膜置换术后出现低心排出量的预测因素的报道相对较少[10-11],Sato等[11]分析了42例瓣膜置换患者术后出现低心排出量综合征的情况,结果显示左室心肌质量指数、体外循环时间、心衰以及纽约心脏学会分级标准等与低心排出量综合征的发生密切相关。
本研究中AS患者年龄≥70岁、BMI≥30kg/m2、心力衰竭病史、ESIVST≥1.80cm和EDIVST≥1.40cm、LAd≥4.20cm、轻度二尖瓣和三尖瓣反流各项指标等术前因素,以及术后早期LVEF≤50.0%、ESIVST≥1.80cm、EDIVST≥1.40cm、轻度二尖瓣反流等因素均与低心排出量综合征相关。其中术前因素中年龄≥70岁、ESIVST≥1.80cm、EDIVST≥1.40cm,术后早期因素中LVEF≤50.0%、轻度二尖瓣反流等均为AS患者瓣膜置换术后低心排出量的独立危险因素。在术前,高龄患者(≥70岁)和有心力衰竭史患者的心功能已出现减弱,在瓣膜置换术后更易出现低心排出量综合征。ESIVST≥1.80cm、EDIVST≥1.40cm等因素表明患者室间隔明显增厚,提示这些患者本身有肥厚性心肌病的危险。术后如果出现LVEF≤50.0%则表明左心室功能受损,出现轻度二尖瓣和三尖瓣反流可以使得左心房负荷和左心室舒张期负荷加重,从而导致低心排出量综合征的出现。
AI患者年龄≥70岁、BMI≥30kg/m2、心力衰竭病史、LVESd≥4.15cm和LVEDd≥5.90cm、ESIVST≥1.60cm,EDIVST≥1.35cm、轻度三尖瓣反流等术前因素,以及术后早期LVEF≤50.0%、心力衰竭病史、LVESd≥4.15cm、LVEDd≥5.90cm、轻度的三尖瓣反流等因素均与低心排出量综合征相关。其中术前因素中的BMI≥30kg/m2、LVESd≥4.15cm和LVEDd≥5.90cm,术后早期因素中LVEF≤50.0%、LVESd≥4.15cm和LVEDd≥5.90cm等均为AI患者瓣膜置换术后低心排出量的独立危险因素。与AS患者不一致,在AI患者中术前的BMI≥30kg/m2的患者由于处于肥胖状态,可能会引起心脏负荷的增加、免疫力的降低及其他器官功能的降低;LVESd和LVEDd增大后降低了心排出量,从而引起了AI患者的低心排出量综合征。在术后,LVEF≤50.0%、LVESd≥4.15cm和LVEDd≥5.90cm等因素也会引起AI患者的低心排出量综合征。综上所述,本研究结果表明,高龄、低LVEF、心力衰竭病史等都是低心排出量综合征的重要预测因素,与既往研究一致[12]。此外,本研究还发现包括肥胖、术前及术后早期的一些血流动力学参数等与患者术后低心排出量综合征的发生相关,在临床上对于瓣膜置换手术患者将予以密切监测。
[2]Krag A,Bendtsen F,Henriksen J H,et al.Low cardiac output predicts development of hepatorenal syndrome and survival in patients with cirrhosis and ascites[J].Gut,2010,59(1):105-110.
[3]Banach M,Goch A,Misztal M,et al.Low output syndrome following aortic valve replacement Predictors and prognosis[J].Arch Med Sci,2007,3(2):117-119.
[4]Sá M P,Nogueira J R,Ferraz P E,et al.Risk factors for low cardiac output syndrome after coronary artery bypass grafting surgery[J].Rev Bras Cir Cardiovasc,2012,27(2):217-223.
[5]Abella R,Satriano A,Frigiola A,et al.Adrenomedullin alterations related to cardiopulmonary bypass in infants with low cardiac output syndrome[J].J Matern Fetal Neonatal Med,2012,25(12): 2756-2761.
[6]Unverzagt S,Hirsch K,Buerke M,et al.Inotropic agents and vasodilator strategies for acute myocardial infarction complicated by cardiogenic shock or low cardiac output syndrome(Protocol)[J].Cochr Dat Syst Rev,2014,16(2):105-109.
[7]Maganti M,Badiwala M,Sheikh A,et al.Predictors of low cardiac output syndrome after isolated mitral valve surgery[J].J Thorac Cardiovasc Surg,2010,140(4):790-796.
[8]Ranucci M,Bozzetti G,Ditta A,et al.Surgical reexploration after cardiac operations:why a worse outcome[J]?Ann Thorac Surg, 2008,86(5):1557-1562.
[9]Rao V,Ivanov J,Weisel R D,et al.Predictors of low cardiac output syndrome after coronary artery bypass[J].J Thorac Cardiovasc Surg,1996,112(1):38-51.
[10]Hoffman T M,Wernovsky G,Atz A M,et al.Efficacy and safety of milrinone in preventing low cardiac output syndrome in infants and children after corrective surgery for congenital heart disease[J].Circulation,2003,107(7):996-1002.
[11]Sato N,Uchida N,Miura M,et al.Risk analysis of low cardiac output syndrome after valve replacement[J].Tohoku J Exp Med, 1993,171(1):77-88.
[12]Butts R J,Scheurer M A,Atz A M,et al.Comparison of maximum vasoactive inotropic score and low cardiac output syndrome as markers of early postoperative outcomes after neonatal cardiac surgery[J].Pediatr Cardiol,2012,33(4):633-638.
Predictive factors related to low cardiac output syndrome following aortic valve replacement
Objective To investigate the predictive factors related to postoperative low cardiac output syndrome in patients after aortic valve replacement due to aortic stenosis or regurgitation.MethodsThree hundred patients with aortic valve defect due to aortic stenosis(AS,n=150)or aortic incompetence(AI,n=150),who underwent isolated aortic valve replacement were included in the study.Low cardiac output syndrome(LOS)was defined as the need for high dosages of inotropic medication, and/or intra-aortic balloon pumping to sustain adequate hemodynamic status.ResultsPostoperative low cardiac output syndrome developed in 86 patients(28.6%),including 39 patients with AS(26.0%)and 47 patients with AI(31.3%).The development of postoperative LOS were associated with the following factors (odds ratio in parentheses):for AS group:advanced age (OR=4.7),obesity(OR=1.8),history of heart failure(OR=1.7),end-systolic(OR=5.5)and end-diastolic intraventricular septum thickness(OR=4.2),left atrial diameter(OR=1.6),mitral and tricuspid regurgitation(OR=1.9,1.5)before surgery,LVEF≤50.0% (OR=5.4),left ventricular end systolic diameter(OR=1.7),left ventricular end diastolic diameter(OR=1.9)and mitral regurgitation (OR=4.1)in early postoperative period;for AI group:advanced age(OR=1.9),obesity(OR=4.8),history of heart failure(OR=1.7), LVEF≤50.0%(OR=1.8),left ventricular end-systolic(OR=4.5),end-diastolic diameters(OR=6.4),left ventricular end systolic diameter(OR=1.5),left ventricular end diastolic diameter(OR=1.6),and tricuspid regurgitation(OR=1.5)in preoperative period and left ventricular end-systolic(OR=4.7)and end-diastolic diameters(OR=6.1),and LVEF≤50.0%(OR=7.2)in early postoperative period.ConclusionThe patients at high risk for the development of low cardiac output syndrome should be the focus of trials of new techniques of myocardial protection to effectively resuscitate the ischemic myocardium and optimization of preexisting heart failure symptoms.
Aortic valve defectAortic valve replacementLow output syndrome Predictors

2014-05-04)
(本文编辑:胥昀)
325027 温州医科大学附属第二医院ICU
