过表达Nrf2蛋白对妊娠糖尿病孕鼠胎盘氧化应激及子鼠心脏功能的影响
2020-09-02赵晓兰王玉珏岳军梅颉李玲玲
赵晓兰,王玉珏,岳军,梅颉,李玲玲
四川省医学科学院/四川省人民医院妇产科,成都 610027
核转录因子E2相关因子2(nuclear factor E2-related factor 2,Nrf2)在抗氧化防御基因的转录激活及氧化还原稳态的恢复中起重要作用。Nrf2被阻抑分子Keap1保留为无活性的复合物[1]。然而,在应对氧化应激时,Nrf2与Keap1分离进入细胞核后与抗氧化反应元件结合,启动下游的细胞保护性分子的表达,以维持内环境的稳定[2]。妊娠糖尿病(gestational diabetes mellitus,GDM)是妊娠中最常见的代谢紊乱,其定义为“妊娠中期及妊娠晚期发展为葡萄糖不耐症的类型,导致严重程度不一的高血糖症”[3-4]。Nrf2失调已被证实与糖尿病及其并发症有关[5-7],然而其具体的作用机制尚不清楚。因此,本研究通过构建小鼠GDM模型,探讨过表达Nrf2蛋白对GDM孕鼠胎盘氧化应激及子鼠心脏功能的影响,以期为揭示GDM可能的发病机制及对子代产生的影响提供借鉴。
1 材料与方法
1.1 实验材料 36只6周龄封闭群清洁级未经产C57小鼠,体重(24.65±0.56) g,购自四川省人民医院实验动物研究所;链脲佐菌素(streptozocin,STZ)、E钙黏蛋白(E-cadherin)、N钙黏蛋白(N-cadherin)、生存素(Survivin)、血管内皮生长因子(vascular endothelial growth factor,VEGF)抗体购自美国Sigma公司。二喹啉甲酸蛋白定量试剂盒(美国Pierce公司);MatrigelTM底膜基质(美国BD公司);HRP标记的山羊抗大鼠二抗(美国Santa Cruz公司);Varioskan Flash多功能酶标仪(美国Thermo Fisher公司);OLYMPUS DP71显微镜(日本Olympus光学有限公司);高速低温离心机(美国Beckman公司);电泳槽、电转仪(美国Bio-Rad公司);GDS-800 UVP凝胶成像系统(美国UVP公司);小鼠肌酸激酶同工酶(creatine kinase MB form,CK-MB)、心肌肌钙蛋白I(cardiac troponin I,cTnI)、肌红蛋白(myoglobin,MB)ELISA试剂盒(中国武汉博士德生物工程有限公司);超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)、还原型谷胱甘肽(glutathione,GSH)试剂盒(中国南京建成生物工程研究所)。
1.2 方法
1.2.1 动物模型建立与分组 将小鼠适应性喂养2周后,夜晚按照雌雄2:1比例合笼交配,次日清晨有阴栓者或阴道分泌物涂片见精子者视为交配成功,计为妊娠第0天。将36只妊娠成功的小鼠随机分为4组:对照组、模型组、pcDNA组及Nrf2组,每组9只。后3组小鼠禁食12 h后给予新鲜STZ溶液30 mg/kg、间隔24 h腹腔注射,共注射3次;对照组仅注射等体积生理盐水。第一次注射STZ后24 h,Nrf2组腹腔注射转染Nrf2过表达腺病毒;pcDNA组腹腔注射转染空载包装的腺病毒;其余两组注射等体积生理盐水。注射后72 h即为妊娠第4天,于空腹孕鼠眼球后静脉采血,离心分离血清后用葡萄糖测定试剂盒检测血糖水平,若≥16.7 mmol/L为造模成功。
1.2.2 各组空腹血糖、子宫指数、总胎数和流产数的测定 各组孕鼠空腹12 h后于眼球后静脉丛采血,血液静置于1.5 ml离心管中,2 h后离心,取上层血清10 μl用葡萄糖测定试剂盒检测血糖水平。将怀孕9 d的小鼠断颈处死后剖腹取出子宫,称重并计数胚胎数,计算子宫指数和流产数。子宫指数=子宫重量/体重×100%;流产数=着床点数-活胎点数。
1.2.3 检测SOD活性及MDA、GSH的含量 获取各组孕鼠胎盘组织,分别采用相应试剂盒以羟胺法、TBA法及比色法定SOD活性及MDA、GSH的含量。具体操作严格按试剂盒说明书进行。
1.2.4 HE染色观察孕鼠肝肾及子鼠心脏组织形态学变化 分别取每组3只孕鼠肝脏、肾脏组织及子鼠心脏组织放入4%多聚甲醛溶液中进行固定,24 h后脱水,石蜡包埋、切片,然后行HE染色:将切片分别置于二甲苯Ⅰ和二甲苯Ⅱ及100%、95%、90%、80%、70%的乙醇各10 min,用自来水冲洗;分别行苏木精染色、伊红染色;由低到高浓度乙醇梯度脱水,二甲苯透明,中性树脂封片;光学显微镜拍照,观察其形态特征。
1.2.5 超声测量子鼠心脏功能指标 检测各组子鼠心率(heart rate,HR),记录心电图T波变化,并通过BL-420F生物机能实验系统记录子鼠的左心室收缩压(left ventricular systolic pressure,LVSP)、左心室射血分数(left ventricular ejection fraction,LVEF)及缩短分数(fractional shortening,FS)。
1.2.6 ELISA法检测子鼠血清中CK-MB、MB、cTnI含量 取各组子鼠外周血,分离出血清。采用ELISA法严格按照试剂盒说明书测定子鼠血清CKMB、MB、cTnI的含量。
1.2.7 RT-PCR检测Nrf2 mRNA的表达 采用Trizol法提取孕鼠胎盘总RNA,并通过超微紫外分光光度计测定260 nm及280 nm波长处的吸光度。按照试剂盒说明书使用Super RT cDNA试剂盒合成cDNA。使用Quantifast®SYBR®GreenPCR Kit进行PCR,分别在95 ℃ 15 s及60 ℃ 60 s条件下使用ABI 7500将反应激活。引物如下:Nrf2正向5'-CTGAACTCCTGGACGGGACTA-3',反向5'-CGGTGGGTCTCCGTAAATGG-3';GAPDH正向5'-TGAAGCAGGCATCTGAGGG-3',反向5'-CGAAGGTGGAAGAGTGGGAG-3'。
1.2.8 Western blotting检测Nrf2蛋白表达水平取适量孕鼠胎盘组织或子鼠心脏组织,匀浆后按1:3比例加入含有蛋白酶抑制剂的RIPA裂解液,12 000 r/min离心10 min,取上清,根据BCA试剂盒说明书检测蛋白浓度。将匀浆上清液与上样缓冲液按1:1配比,电泳、转膜、封闭,一抗4 ℃过夜,二抗室温孵育1 h,TBST漂洗,ECL发光剂显影,采用Bio-Rad GelDoc XR+凝胶成像系统采集图像,用Image J2x软件对各抗体条带灰度值进行测量。
1.3 统计学处理 采用SPSS 21.0软件进行统计分析。实验数据以表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 各组GDM孕鼠胎盘组织Nrf2表达水平比较与对照组(1.000±0.000)比较,模型组及pcDNA组Nrf2 mRNA水平(分别为0.11±0.04、0.12±0.07)均明显降低(P<0.05),而Nrf2组与对照组比较无明显差异;与模型组比较,Nrf2组的Nrf2 mRNA水平(2.34±0.54)明显升高(P<0.05),而pcDNA组与模型组比较无明显差异。与对照组(0.070±0.015)比较,模型组及pcDNA组Nrf2蛋白表达水平(分别为0.010±0.005、0.013±0.006)均明显降低(P<0.05);与模型组比较,Nrf2组的Nrf2蛋白表达水平(0.260±0.040)明显升高(P<0.05),而pcDNA组与模型组比较无明显差异(图1)。
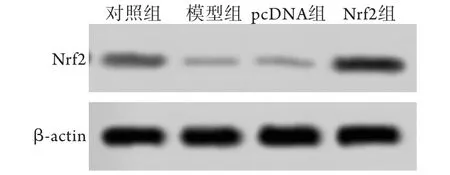
图1 各组Nrf2蛋白表达水平(Western blotting)Fig.1 Nrf2 expression in each groups (Western blotting)
2.2 各组孕鼠空腹血糖、子宫指数、总胎数及流产率比较 与对照组比较,模型组孕鼠的空腹血糖及流产率明显升高,子宫指数及总胎数明显减少,差异均有统计学意义(P<0.05)。与pcDNA组比较,Nrf2组孕鼠的空腹血糖及流产率明显降低,子宫指数及总胎数明显增加,差异均有统计学意义(P<0.05,表1)。
2.3 各组孕鼠胎盘组织SOD活性及MDA、GSH含量比较 与对照组比较,模型组的MDA含量明显升高,SOD活性和GSH含量明显降低,差异均有统计学意义(P<0.05)。与pcDNA组比较,Nrf2组的MDA含量明显降低,SOD活性和GSH含量明显升高,差异均有统计学意义(P<0.05,表2)。
表1 各组孕鼠空腹血糖、子宫指数、总胎数及流产率的比较(±s,n=9)Tab.1 Fasting blood glucose, uterine index, total number of fetuses and abortion rate of pregnant mice in each groups (±s, n=9)

表1 各组孕鼠空腹血糖、子宫指数、总胎数及流产率的比较(±s,n=9)Tab.1 Fasting blood glucose, uterine index, total number of fetuses and abortion rate of pregnant mice in each groups (±s, n=9)
与对照组比较,(1)P<0.05;与pcDNA组比较,(2)P<0.05。
组别 空腹血糖(mmol/L) 子宫指数 总胎数 流产率(%)对照组 4.15±0.66 0.015±0.003 15.46±3.07 7.34±5.98模型组 12.72±2.94(1) 0.009±0.003(1) 9.23±2.12(1) 75.24±8.95(1)pcDNA组 12.58±2.46 0.008±0.002 9.42±2.48 74.29±9.23 Nrf2组 5.13±0.74(2) 0.013±0.001(2) 12.55±3.17(2) 16.28±6.97(2)F 49.48 17.09 10.42 192.51 P<0.01 <0.01 <0.01 <0.01
表2 各组SOD活性及MDA、GSH含量比较(±s,n=9)Tab.2 Comparison of SOD activity, MDA and GSH content among each groups (±s, n=9)
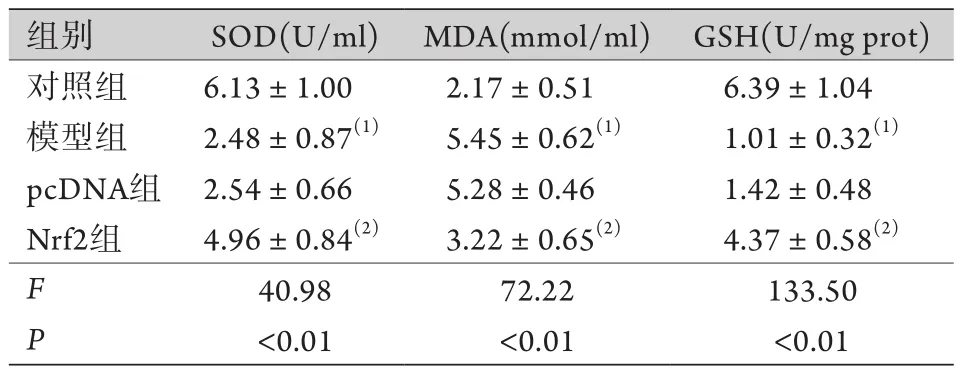
表2 各组SOD活性及MDA、GSH含量比较(±s,n=9)Tab.2 Comparison of SOD activity, MDA and GSH content among each groups (±s, n=9)
与对照组比较,(1)P<0.05;与pcDNA组比较,(2)P<0.05。
组别 SOD(U/ml) MDA(mmol/ml) GSH(U/mg prot)对照组 6.13±1.00 2.17±0.51 6.39±1.04模型组 2.48±0.87(1) 5.45±0.62(1) 1.01±0.32(1)pcDNA组 2.54±0.66 5.28±0.46 1.42±0.48 Nrf2组 4.96±0.84(2) 3.22±0.65(2) 4.37±0.58(2)F 40.98 72.22 133.50 P<0.01 <0.01 <0.01
2.4 各组孕鼠肝脏及肾脏组织形态学表现 对照组小鼠肝细胞索排列整齐、规则,细胞无变性;肾脏组织细胞形态规则,排列整齐。模型组及pcDNA组肝细胞索排列紊乱,灶性坏死、脂肪变性及炎细胞浸润明显;肾脏基底膜增生,糖原沉积,可见间质区域的炎性细胞浸润及纤维化。Nrf2组肝细胞坏死得以改善,浸润性炎性细胞数量减少,肾损伤情况得以改善,糖原沉积减轻,间质区域的炎性细胞浸润及纤维化程度减轻(图2)。
2.5 各组子鼠心脏组织中Nrf2蛋白表达水平比较与对照组(0.050±0.017)比较,模型组Nrf2蛋白表达水平(0.007±0.005)明显降低(P<0.05)。与pcDNA组(0.008±0.004)比较,Nrf2组Nrf2蛋白表达水平(0.220±0.030)明显升高(P<0.05,图3)。
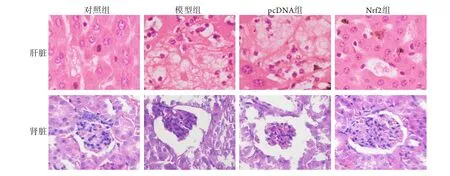
图2 各组孕鼠肝脏及肾脏组织形态学变化(HE ×400)Fig.2 Morphological changes of liver and kidney tissues of pregnant mice in each group (HE staining, ×400)
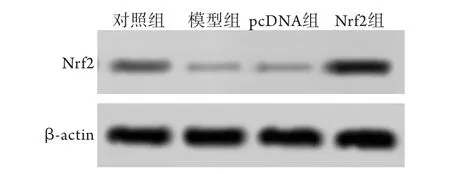
图3 各组子鼠心脏组织中Nrf2蛋白的表达水平Fig.3 Expression of Nrf2 protein in heart tissues of offspring mice in each group
2.6 各组子鼠心脏功能指标比较 与对照组比较,模型组子鼠的HR、LVSP、LVEF、FS均明显降低,差异有统计学意义(P<0.05)。与pcDNA组比较,Nrf2组子鼠的HR、LVSP、LVEF、FS均明显升高,差异有统计学意义(P<0.05,表3)。
2.7 各组子鼠血清CK-MB、MB、cTnI含量比较 与对照组比较,模型组子鼠血清CK-MB、MB及cTnI含量明显升高,差异均有统计学意义(P<0.05)。与pcDNA组比较,Nrf2组子鼠血清CKMB、MB、cTnI含量明显降低,差异均有统计学意义(P<0.05,表4)。
2.8 各组子鼠心肌组织形态学变化 对照组子鼠心肌细胞边缘清晰,核膜完整,心肌纤维排列整齐,无细胞间质水肿;模型组及pcDNA组子鼠心肌细胞出现肿胀,明显的细胞间质水肿,界限模糊,有少量交叉条纹;Nrf2组子鼠心肌细胞间水肿减轻,心肌损伤介于模型组与对照组之间(图4)。
表3 各组子鼠心脏功能指标比较(±s,n=9)Tab.3 Comparison of cardiac function indicators of offspring mice among each group (±s, n=9)

表3 各组子鼠心脏功能指标比较(±s,n=9)Tab.3 Comparison of cardiac function indicators of offspring mice among each group (±s, n=9)
与对照组比较,(1)P<0.05;与pcDNA组比较,(2)P<0.05。
组别 HR(次/min) LVSP(mmHg) LVEF(%) FS(%)对照组 432.86±56.03 138.24±35.09 57.05±6.59 27.12±4.43模型组 208.77±26.52(1) 55.02±14.15(1) 21.56±8.45(1) 7.05±1.89(1)pcDNA组 210.62±28.61 57.13±10.76 20.38±7.06 7.39±1.43 Nrf2组 328.17±64.33(2) 102.87±24.42(2) 43.26±6.42(2) 21.25±3.13(2)F 47.27 26.79 55.23 104.51 P<0.01 <0.01 <0.01 <0.01
表4 各组子鼠血清CK-MB、MB、cTnI含量比较(±s,n=9)Tab.4 Comparison of CK-MB, MB and cTnI contents in offspring mice among each group (±s, n=9)

表4 各组子鼠血清CK-MB、MB、cTnI含量比较(±s,n=9)Tab.4 Comparison of CK-MB, MB and cTnI contents in offspring mice among each group (±s, n=9)
与对照组比较,(1)P<0.05;与pcDNA组比较,(2)P<0.05。
组别 CK-MB (U/L) MB (ng/ml) cTnI (ng/ml)对照组 25.97±4.38 29.08±8.09 0.11±0.01模型组 123.55±19.26(1) 149.17±24.33(1) 0.67±0.03(1)pcDNA组 119.74±18.07 147.38±21.54 0.65±0.02 Nrf2组 58.02±7.53(2) 64.23±10.42(2) 0.27±0.05(2)F 106.5 106.8 719.7 P<0.01 <0.01 <0.01
3 讨 论
GDM与流产、胎膜早破及其他妊娠异常相关[8]。GDM的病因复杂,其发生机制和流行病学特征涉及多个遗传及环境因素。GDM给母体、发育中的胎儿及后代均带来了严重的短期及长期健康风险,包括随后发生于母体的2型糖尿病风险,以及后代出现不良心脏代谢表型的风险等[9]。本研究结果显示,Nrf2过表达可引起孕鼠空腹血糖及流产率降低,子宫指数及总胎数增加,提示Nrf2过表达可降低孕鼠流产率。

图4 各组子鼠心脏组织形态学变化(HE ×400)Fig.4 Morphological changes of heart tissue in each group of offspring mice (HE ×400)
氧化应激在GDM的发生中起着至关重要的作用[10]。患有GDM的孕妇表现出高血糖引起的循环氧化应激增加及抗氧化酶减少[11-12]。MDA是由病理性疾病(如糖尿病)中的活性氧(reactive oxygen species,ROS)诱导的磷脂降解产生的,通常用于指示脂质过氧化及氧化应激[13-14]。SOD及GSH是人体中普遍存在的抗氧化剂,可保持氧化还原反应的平衡。GDM患者血液中的SOD及GSH水平明显降低,MDA水平明显升高,氧化应激增加[8,15]。本研究结果显示,Nrf2过表达使SOD活性及GSH含量升高,MDA含量降低,GDM孕鼠肝肾组织的病理损伤减轻,提示Nrf2过表达可缓解GDM孕鼠的氧化应激。
Nrf2的失调已被证实与糖尿病及其并发症有关。有研究发现,2型糖尿病孕妇胎盘中的Nrf2表达降低,从而降低了血红素氧化酶1的表达[16]。本研究结果显示,子鼠心脏组织中Nrf2蛋白表达水平升高,提示Nrf2过表达可能对子鼠心脏具有保护作用。有研究发现,Nrf2表达升高对糖尿病心肌病[17]及糖尿病肾病[18]有保护作用,这与本研究结果一致。还有研究证实,在动脉粥样硬化、局部缺血、再灌注、心脏肥大、心力衰竭及糖尿病等实验模型中,Nrf2的过表达对心脏功能具有保护作用[19]。3种心肌损伤标志物CK-MB、MB及cTnI在心肌损伤诊断中发挥着重要作用[20]。cTnI对心肌损伤诊断具有很高的敏感度及特异度。研究发现,严重心肌损伤小鼠血浆中cTnI的表达水平明显升高[21]。本研究结果显示,Nrf2过表达可使子鼠的HR、LVSP、LVEF、FS明显升高,血清中的CK-MB、MB、cTnI含量明显降低,并减轻了心肌损伤,这些都进一步证实了Nrf2过表达对子鼠心脏功能的保护作用。
综上所述,本研究结果表明,Nrf2过表达降低了孕鼠的空腹血糖、流产率、MDA含量,以及子鼠血清CK-MB、MB、cTnI含量,提高了子宫指数、总胎数、SOD活性及GSH含量,以及子鼠的HR、LVSP、LVEF、FS,减轻了孕鼠肝肾组织的病理损伤和子鼠的心肌损伤,提示过表达Nrf2蛋白能够减缓GDM孕鼠胎盘的氧化应激并维持子鼠心脏功能,为揭示GDM可能的发病机制及对子代产生的影响提供了理论依据。
