氢化可的松对中暑大鼠去甲肾上腺素低反应性及炎症反应的影响
2020-09-02张明陈怀生李悦杨经文施学智梁泳欣童华生
张明,陈怀生,李悦,杨经文,施学智,梁泳欣,童华生*
1广州医科大学附属第六医院/清远市人民医院重症医学科一区,广东清远 511500;2南方科技大学第一附属医院/暨南大学第二临床医学院/深圳市人民医院重症医学科,广东深圳 518020;3南部战区总医院重症医学科/解放军热区损伤与组织修复重点实验室,广州 510010
循环衰竭是重症中暑常见的临床表现,它可能是患者的首发症状,也可能是由其他脏器衰竭所致[1-2]。中暑直接导致无基础病的心脏发生泵衰竭的概率并不大,其循环衰竭难以简单地通过心功能损伤来解释[3]。另外,尽管热打击后内源性的儿茶酚胺大量分泌,维持中暑患者循环功能仍常须依赖缩血管药物[4-5],预示重症中暑患者存在着对缩血管药物的低反应性,这可能是中暑循环衰竭的致病机制之一。在重症中暑的研究中,作为与其相似的炎症反应性疾病,脓毒症休克的研究经验常被借鉴。脓毒症休克同样伴随着对缩血管药物的低反应性,有研究指出,氢化可的松可作为增加该反应性的辅助药物[6]。然而,至今鲜有研究报道血管反应性的改变,亦无氢化可的松的应用经验,该药物对血管反应性的影响仍不明确。本研究观察了氢化可的松对去甲肾上腺素升血压效应等的影响,探讨其对缩血管药物的效应及其对炎症反应的影响。
1 材料与方法
1.1 主要试剂 氢化可的松购自华中药业股份有限公司,去甲肾上腺素购自中国远大医药公司。一氧化氮(nitric oxide,NO)检测试剂盒购自碧云天生物技术公司,前列腺素E2(prostaglandin E2,PGE2)、皮质醇、促肾上腺皮质激素(adrenocorticotropic hormone,ACTH)、核因子κB(nuclear factor kappa-B,NF-κB)、肿瘤坏死因子-α(tumor necrosis factor,TNF-α)、白细胞介素1β(interleukin-1β,IL-1β)ELISA检测试剂盒购自云克隆科技股份有限公司。
1.2 中暑大鼠模型的构建及分组 健康雄性SPF级SD大鼠96只,体重220~250 g,购自南方医科大学动物实验中心,实验流程经南部战区总医院实验动物伦理委员会审批通过。实验前大鼠常规饲养在温度(23±1) ℃、湿度50%±5%的环境中。实验开始时,将大鼠用3%戊巴比妥(30 mg/kg)施行腹腔注射麻醉,再行颈动脉置管接压力传感器监测动脉血压,最后行股静脉置管以注入实验药物。具体操作方法见本课题组前期研究[7]。
将置管顺利的大鼠分为生理盐水对照组、氢化可的松对照组、生理盐水中暑组及氢化可的松中暑组,每组24只,随机参加下述3部分实验,每部分实验中各组大鼠均为8只。造模时,中暑组大鼠被置入预热至(39.5±0.2) ℃及60%±5%湿度的改良型加温培养箱(购自戴维医疗器械股份有限公司)中,实验过程中保持培养箱内定期适当通风(供氧),并通过独立设备两次校正温度、湿度和氧气浓度。中暑建模成功的标准是大鼠肛温(直肠内5 cm)超过42 ℃的情况下,血压从峰值开始快速下降[8]。造模成功后的大鼠立刻采用冰块降温至基础体温,并以1 ml/kg的无菌生理盐水缓慢静脉注射补充血容量。两对照组大鼠始终置于(23±1) ℃、50%±5% 湿度、保暖的环境中,未接受热打击,维持大鼠中心体温接近基础体温。
中暑组大鼠在血压开始快速增高至峰值(热应激)后,分别接受10 mg/kg氢化可的松0.5 ml或等量生理盐水静脉注射。对照组分别在模拟造模开始后70 min接受10 mg/kg氢化可的松0.5 ml或等量生理盐水静脉注射,在模拟造模开始后75 min接受1 ml/kg无菌生理盐水静脉注射。
1.3 两次负荷剂量的去甲肾上腺素推注实验 为评估上述4组大鼠对去甲肾上腺素的反应性,参考文献[9]的方法和剂量,观察负荷剂量的去甲肾上腺素对大鼠血压的影响。每组取8只大鼠,分别接受一次负荷剂量的去甲肾上腺素(1 μg/kg)静脉弹丸式注射,当大鼠血压回复至基线水平后5 min,再次注射一次相同剂量的去甲肾上腺素,分别记录两次注射后的平均动脉压(MAP)峰值及血压回落至基线的时间。
1.4 恒定低剂量的去甲肾上腺素持续泵注实验为进一步观察恒定低剂量的去甲肾上腺素对大鼠血压的影响[9],上述大鼠每组取8只,分别接受去甲肾上腺素[25 μg/(kg·h)]微量泵持续泵注,记录大鼠MAP维持水平及存活时间。
1.5 血管反应性相关生化指标检测 4组大鼠每组取8只,分别接受去甲肾上腺素[25 μg/(kg·h)]静脉持续泵注,于造模1 h后通过动脉大量放血终止实验,留取避免稀释的动脉血标本,低温离心取血清并完成如下指标的检测:血管扩张因子(血清NO、PGE2),激素(皮质醇、ACTH),促炎因子(NF-κB、TNF-α、IL-1β)。为保障激素水平的稳定性,本步骤实验均在每日的14时至17时之间完成。操作方法严格按照试剂盒说明书施行。另外,为检测大鼠主动脉α1肾上腺素能受体3个亚型(α1A、α1B及α1D)的mRNA水平,取大鼠主动脉组织行RT-qPCR检测。用PrimeScriptTMRT Maseter Mix(TaKaRa)提取总RNA,罗氏LightCycler480系统实施扩增。mRNA的比较采用ΔΔCt方法,结果以相对于内参基因GAPDH的比值表示。引物序列设计参照文献[10](表1)。

表1 RT-qPCR的引物序列Tab.1 Primers used in RT-qPCR
1.6 统计学处理 应用SPSS 17.0软件处理数据。连续性计量资料先行Kolmogorov-Smirnov检验检测数据正态性,正态分布数据以表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t法;同一组数据的前后比较采用配对t检验。采用Kaplan-Meier方法进行生存分析。P<0.05为差异有统计学意义。
2 结 果
2.1 两次负荷剂量的去甲肾上腺素推注实验 中暑大鼠造模成功后均发生循环衰竭,血压进行性下降。未经降温、补液、血管活性药物干预的大鼠均因低血压导致的心律失常快速死亡。生理盐水对照组和氢化可的松对照组大鼠在两次接受1 μg/kg的去甲肾上腺素后,血压均快速而显著增高,并缓慢下降至基线,组内两次注射产生的MAP峰值和血压回落时间前后比较未见明显差异。生理盐水中暑组大鼠在接受负荷剂量的去甲肾上腺素后,血压上升的峰值和持续时间明显低于生理盐水对照组,第二次注射后的峰值降低更加明显。氢化可的松中暑组接受负荷剂量的去甲肾上腺素后,虽然血压峰值和持续时间明显低于氢化可的松对照组,但明显高于生理盐水中暑组,差异有统计学意义(P<0.05)。氢化可的松中暑组两次接受去甲肾上腺素注射后的血压峰值和持续时间前后比较无明显差异(表2)。
2.2 恒定低剂量的去甲肾上腺素持续泵注实验持续泵入恒定低剂量的去甲肾上腺素的实验中,氢化可的松中暑组和生理盐水中暑组大鼠MAP明显低于两个对照组,且前两组大鼠均因血压进行性下降而死亡。但是,氢化可的松中暑组大鼠血压高于生理盐水中暑组,血压下降相对平缓,且总体生存时间较后者延长(P=0.009,图1)。
表2 前后两次负荷剂量去甲肾上腺素静脉注射对大鼠血压的影响(±s,n=8)Tab.2 Effect of two doses of intravenously injected norepinephrine on the blood pressure of rats (±s, n=8)
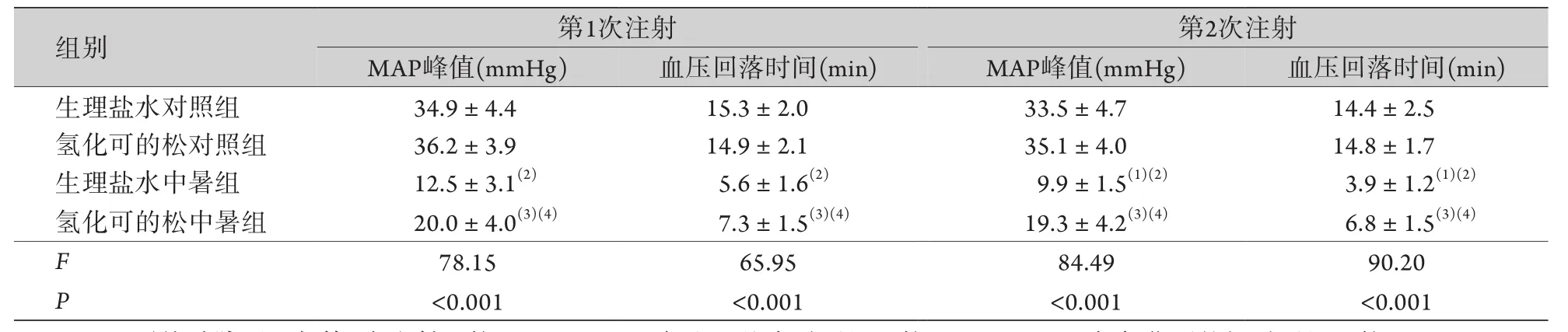
表2 前后两次负荷剂量去甲肾上腺素静脉注射对大鼠血压的影响(±s,n=8)Tab.2 Effect of two doses of intravenously injected norepinephrine on the blood pressure of rats (±s, n=8)
MAP.平均动脉压;与第1次注射比较,(1)P<0.05;与生理盐水对照组比较,(2)P<0.05;与氢化可的松对照组比较,(3)P<0.05;与生理盐水中暑组比较,(4)P<0.05。
images/BZ_12_638_514_1410_564.png组别 第1次注射 第2次注射images/BZ_12_1423_514_2220_564.png生理盐水对照组 34.9±4.4 15.3±2.0 33.5±4.7 14.4±2.5氢化可的松对照组 36.2±3.9 14.9±2.1 35.1±4.0 14.8±1.7生理盐水中暑组 12.5±3.1(2) 5.6±1.6(2) 9.9±1.5(1)(2) 3.9±1.2(1)(2)氢化可的松中暑组 20.0±4.0(3)(4) 7.3±1.5(3)(4) 19.3±4.2(3)(4) 6.8±1.5(3)(4)F 78.15 65.95 84.49 90.20 P<0.001 <0.001 <0.001 <0.001

图1 持续泵入去甲肾上腺素的大鼠血压(A)及生存情况(B)Fig.1 Blood pressure and survival of rats with continuously intravenous injection of norepinephrine
2.3 大鼠血管扩张因子及激素的检测 4组大鼠血清皮质醇、ACTH、NO、PGE2水平差异无统计学意义(P>0.05),提示氢化可的松对MAP的影响与上述血管扩张因子及激素水平无关(表3)。
表3 大鼠血清皮质醇、ACTH、NO、PGE2水平(±s,n=8)Tab.3 The serum levels of cortisol, adrenocorticotropic hormone, nitric oxide, prostaglandin E2 of rats (±s, n=8)

表3 大鼠血清皮质醇、ACTH、NO、PGE2水平(±s,n=8)Tab.3 The serum levels of cortisol, adrenocorticotropic hormone, nitric oxide, prostaglandin E2 of rats (±s, n=8)
ACTH.促肾上腺皮质激素;NO.一氧化氮;PGE2.前列腺素E2
组别 皮质醇(pg/ml) ACTH(pg/ml) NO(μmol/L) PGE2(μmol/L)生理盐水对照组 9.11±2.37 180.86±21.66 15.74±3.78 6.16±2.19氢化可的松对照组 10.61±3.07 171.38±53.25 16.64±5.52 6.22±1.88生理盐水中暑组 9.54±2.94 178.64±37.62 16.14±4.84 7.26±2.50氢化可的松中暑组 11.17±3.05 175.79±38.01 16.67±4.81 7.29±2.78 F 0.869 0.087 0.069 0.568 P 0.469 0.967 0.976 0.641
2.4 大鼠主动脉肾上腺素能受体的变化 生理盐水中暑组和氢化可的松中暑组的3种α1肾上腺素能受体亚型α1A、α1B及α1D的mRNA表达水平分别较生理盐水对照组和氢化可的松对照组明显下降,氢化可的松中暑组的肾上腺素受体mRNA表达显著高于生理盐水中暑组,差异有统计学意义(P<0.05,表4)。
2.5 大鼠血清炎性因子表达水平比较 大鼠血清NF-κB、TNF-α、IL-1β检测结果显示,生理盐水中暑组和氢化可的松中暑组的炎性因子水平分别较生理盐水对照组和氢化可的松对照组显著提高,氢化可的松中暑组的炎性因子水平显著低于生理盐水中暑组,差异有统计学意义(P< 0.05,表5)。
表4 主动脉组织的α1肾上腺素能受体3个亚型(α1A、α1B及α1D)的mRNA表达 (±s,n=8)Tab.4 The mRNA expressions of 3 subtypes (α1A, α1B and α1D) of α1 adrenergic receptor in aortic tissue (±s, n=8)

表4 主动脉组织的α1肾上腺素能受体3个亚型(α1A、α1B及α1D)的mRNA表达 (±s,n=8)Tab.4 The mRNA expressions of 3 subtypes (α1A, α1B and α1D) of α1 adrenergic receptor in aortic tissue (±s, n=8)
与生理盐水对照组比较,(1)P<0.05;与氢化可的松对照组比较,(2)P<0.05;与生理盐水中暑组比较,(3)P<0.05。
组别 α1A α1B α1D生理盐水对照组 1.00±0.14 1.00±0.18 1.01±0.12氢化可的松对照组 1.05±0.16 1.08±0.16 0.95±0.26生理盐水中暑组 0.55±0.24(1) 0.51±0.21(1) 0.50±0.13(1)氢化可的松中暑组 0.83±0.17(2)(3)0.75±0.23(2)(3)0.68±0.19(2)(3)F 11.642 13.788 13.530 P 0.001 <0.001 <0.001
表5 大鼠血清炎性因子表达水平 (±s,n=8)Tab.5 The serum levels of inflammatory cytokines of rats(±s, n=8)

表5 大鼠血清炎性因子表达水平 (±s,n=8)Tab.5 The serum levels of inflammatory cytokines of rats(±s, n=8)
TNF-α.肿瘤坏死因子α;IL-1β.白介素1β;NF-κB.核因子κB;与生理盐水对照组比较,(1)P<0.05;与氢化可的松对照组比较,(2)P<0.05;与生理盐水中暑组比较,(3)P<0.05。
组别 TNF-α (pg/ml)IL-1β (ng/ml) NF-κB(pg/ml)生理盐水对照组 6.33±0.59 6.49±0.93 0.63±0.12氢化可的松对照组 6.83±0.88 6.16±1.59 0.57±0.29生理盐水中暑组 22.87±7.45(1) 15.65±2.85(1) 1.20±0.45(1)氢化可的松中暑组 10.65±6.51(2)(3)11.72±3.50(2)(3)0.79±0.18(2)(3)F 14.425 20.842 5.870 P<0.001 <0.001 0.005
3 讨 论
现今,循环衰竭已经成为中暑大鼠模型建立的公认标准之一[11]。早有研究指出,虽然轻度中暑大鼠的血压可能升高,但重度中暑大鼠的血压势必大幅下降,循环衰竭是重度中暑的典型改变,且是造模大鼠死亡的直接原因[12]。这些足以证实中暑致循环衰竭的普遍性和特征性。与既往的研究结果类似,本研究中造模成功的大鼠无一例外地死于循环衰竭。另外,本研究还发现,早期快速降温、扩容可能缓解循环衰竭的进展速度,但无法逆转,使用缩血管药物仍是延长生存的有效措施。与脓毒症休克类似,重症中暑大鼠的血流动力学具有低血管张力的特点[13-14],而使用去甲肾上腺素干预脓毒症休克已成为共识[15],从中可以推测去甲肾上腺素对中暑循环衰竭治疗的潜在价值和必要性。
然而,去甲肾上腺素并不能长期稳定重症中暑大鼠的循环功能,正如缩血管药物不能治愈脓毒症休克的患者一样,缩血管药物的低反应性是首先要面对的问题[16]。由于其机制的复杂性,虽已经过漫长的研究,低反应性在脓毒症休克中仍未得到解决[17],单一的靶向、拮抗均有杯水车薪之势[18]。因而,人们转向考虑靶点更广泛的药物——氢化可的松等。早有研究证实,氢化可的松作为对各系统广泛起效的药物,可以进入血管壁细胞发挥强有力的作用[19]。为了验证该药物对中暑大鼠低反应性的作用,本研究采用弹丸式注射和持续注射两种模式,均观察到其对中暑大鼠去甲肾上腺素反应性的改善作用,且有利于大鼠生存时间的延长,这与糖皮质激素在脓毒症休克中的作用类似[9]。实际上,临床早有使用糖皮质激素改善中暑患者循环功能的观察报道[4]。也有动物实验使用糖皮质激素(地塞米松)改善中暑大鼠的低血压,但这些动物并未使用缩血管药物,不排除糖皮质激素改善了内源性儿茶酚胺的敏感性[11]。与这些研究不同的是,本研究主要评估糖皮质激素对使用了去甲肾上腺素的中暑大鼠的影响,并且选用了在抗休克领域更受认同的氢化可的松作为干预药物,干预过程更符合临床实际。
为了初步探索氢化可的松改善中暑大鼠去甲肾上腺素低反应性的机制,本研究观察了中暑大鼠血清NO和PGE2水平的变化,结果显示热打击或糖皮质激素并未在短时间内明显改变“血管张力因子”,初步排除了它们在这一过程中发挥重要作用的可能性。进一步的研究中,我们观察了中暑大鼠的血清皮质醇水平,以验证氢化可的松的有效性是否依赖于激素水平的缺乏。结果显示,至少在发病早期,大鼠未出现糖皮质激素不足的表现。与本研究不同的是,有研究发现,糖皮质激素水平在中暑动物体内有变化,造成差异的原因可能是观察时间点的不同[20]。总之,氢化可的松的治疗意义可能并不是单纯的补充不足以及外源性替代,正如在脓毒症休克中,也认为皮质醇激素水平的绝对值意义不大[21]。当然,为进一步验证该结论或者确定药物起效的激素水平“阈值”,后续研究仍是需要的。
炎性因子的大量释放是中暑作为一种炎症反应性疾病的重要依据,这些炎性因子被认为诱导了中暑导致的多器官功能障碍,也包括循环系统功能障碍[8]。虽然热打击能够诱导离体血管对去甲肾上腺素的低反应性,但热的直接作用不足以改变血管壁的收缩功能,而热打击伴随而来的血管环境的改变才是主要原因[22]。研究还显示,虽然具体机制仍不明确,增加的炎性因子,尤其是NF-κB、TNF-α、IL-1β可能是造成血管壁α1肾上腺素能受体变化,并进一步导致缩血管药物低反应的主要原因[23-24]。由此我们推测,炎性因子可能在中暑致去甲肾上腺素低反应性的过程中发挥重要作用。本研究发现,中暑后NF-κB、TNF-α、IL-1β水平明显增高,这与未使用缩血管药物的中暑模型类似[25],其变化趋势与血管低反应性一致。早有研究发现糖皮质激素能够通过多种机制抑制炎性因子的释放,因而作为相关研究常用的干预药剂[26]。这种效应在我们的中暑模型中也得到验证,且还伴随了中暑对去甲肾上腺素低反应性的改善。基于上述结论,我们认为炎性因子可能是诱导中暑大鼠对去甲肾上腺素低反应的原因之一,而氢化可的松可通过调控炎症反应改善此低反应性。
总而言之,本研究发现,中暑大鼠存在对去甲肾上腺素的低反应性,使用氢化可的松可以减缓中暑大鼠血压的下降幅度,延长大鼠个体存活时间,这种效果可能是通过抑制炎性因子的表达实现的,该发现可能为重症中暑的救治提供一定参考。可惜的是,本研究发现氢化可的松仍不具备逆转中暑诱发的致死性结局的功效,正如同没有任何一种糖皮质激素能够明显改善脓毒症休克患者的预后一样[6]。由此可见,相对于辅助药物的开发,进一步研究早期合理防控的技术手段,避免中暑进展到循环衰竭阶段,是下一步亟待解决的课题。
