非酒精性脂肪性肝炎无创诊断模型的构建
2020-09-02胡志军贺庆娟陈松海王春艳付懿铭陈国凤纪冬
胡志军,贺庆娟,陈松海,王春艳,付懿铭,陈国凤,纪冬*
1解放军总医院第五医学中心肝硬化诊疗二中心,北京 100039;2宝鸡市中医医院脾胃肝病二科,陕西宝鸡721000;3青岛市第八人民医院消化内科,山东青岛 266100
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)是一种无过量饮酒史、以肝脏实质细胞脂肪变性和脂肪贮积为病理特征的临床综合征[1],主要包括单纯性脂肪肝(nonalcoholic fatty liver,NAFL)、非酒精性脂肪性肝炎(nonalcoholic steatohepatitis,NASH)[2]、非酒精性脂肪性肝纤维化和肝硬化[3]。44%~64%的NAFL患者在发病后3~7年进展为NASH,10%~25%的NASH患者在确诊后8~14年进展为晚期肝纤维化或肝硬化(平均每7年进展至下一个肝纤维化阶段),2%~13%的晚期肝纤维化或肝硬化患者在确诊后3~7年进展为肝癌[4]。目前肝穿刺活检仍是NASH诊断的金标准,但其为有创操作,且受标本局限性及医疗条件等因素限制。近年来,无创诊断模型成为NASH诊断研究的热点。本研究分析常规实验室及临床指标与肝穿刺活检病理结果的相关性,构建预测NASH的无创诊断模型,以期为临床提供简单、准确评估NASH的手段。
1 资料与方法
1.1 研究对象 选取2014年1月-2018年7月解放军总医院第五医学中心(原解放军第302医院)经肝穿刺活检病理诊断的NASH患者。NASH诊断标准符合中华医学会肝病学分会脂肪肝和酒精性肝病学组2010年制定的《非酒精性脂肪性肝病诊疗指南》[5]。纳入标准:①无饮酒史或饮酒折合乙醇量男性每周<140 g,女性每周<70 g;②肝活检组织学改变符合脂肪性肝病的病理学诊断标准。排除标准:①酒精性肝病(ALD)、慢性丙型肝炎、自身免疫性肝病、肝豆状核变性等可引起脂肪肝的特定肝病;②药物(他莫昔芬、乙胺碘呋酮、丙戊酸钠、甲氨蝶呤、糖皮质激素等)、全胃肠外营养、炎症性肠病、甲状腺功能减退症、库欣综合征、β-脂蛋白缺乏症以及部分与胰岛素抵抗相关的综合征等可导致脂肪肝的特殊情况;③病毒性肝炎、ALD、自身免疫性肝病、肝豆状核变性、α1-抗胰蛋白酶缺乏症等其他类型肝病所致血清转氨酶或γ-谷氨酰转肽酶(GGT)增高;④肝脏恶性肿瘤、感染和胆道疾病;⑤正在服用或近期内服用过可导致肝脏酶谱升高的中药及西药者。共纳入NASH患者111例,其中男70例,女41例,年龄12~70(36.7±15.2)岁;同时选取非NASH患者343例,其中男154例,女189例,年龄12~72(46.1±11.3)岁。随机选择364例(建模组,包括NASH患者85例、非NASH患者279例)用于建立无创诊断模型,其余90例(验证组,包括NASH患者26例、非NASH患者64例)用于检验该模型的诊断效能。本研究通过解放军总医院第五医学中心伦理委员会审批。
1.2 肝脏病理学检测 由经验丰富的医师在B超引导下进行穿刺获取肝组织。活检组织取出后用10%甲醛溶液固定,HE染色后由两名经验丰富的病理学医师对组织进行半定量评分后按肝活检病理活动度积分(NAS)进行诊断。
1.3 实验室及临床指标检测 所有患者均测量身高、体重,计算体重指数(BMI)。实验室及临床指标包括血清谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)、碱性磷酸酶(alkaline phosphatase,ALP)、γ-谷氨酰转肽酶(gamma glutamyl transferase,GGT)、尿素(blood urea nitrogen,BUN)、肌酐(creatinine,Cr)、空腹血糖(fasting plasma glucose,FPG)、总胆固醇(total cholesterol,TC)、三酰甘油(triglyceride,TG)、低密度脂蛋白胆固醇(lowdensity lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(high-density lipoproteins cholesterol,HDL-C)、钙(calcium,Ca)、磷(phosphorus,P)、镁(magnesium,Mg)、白细胞(white blood cells,WBC)、红细胞(red blood cells,RBC)、血红蛋白(hemoglobin,Hg)及血小板(platelet,PLT)。
1.4 统计学处理 采用SPSS 22.0软件进行统计分析。正态分布的计量资料以表示,两组间比较采用独立样本t检验。非正态分布的计量资料以M(Q1,Q3)表示,两组间比较采用独立样本秩和检验。计数资料组间比较采用χ2检验。多因素分析采用前向逐步logistic回归分析,应用受试者工作特征(ROC)曲线划定界值并评价模型的诊断价值;ROC曲线下面积(area under curve,AUC)比较采用正态性Z检验。P<0.05为差异有统计学意义。
2 结 果
2.1 一般资料 两组年龄、性别、BMI、血常规及生化指标比较,差异均无统计学意义(P>0.05),有可比性(表1)。
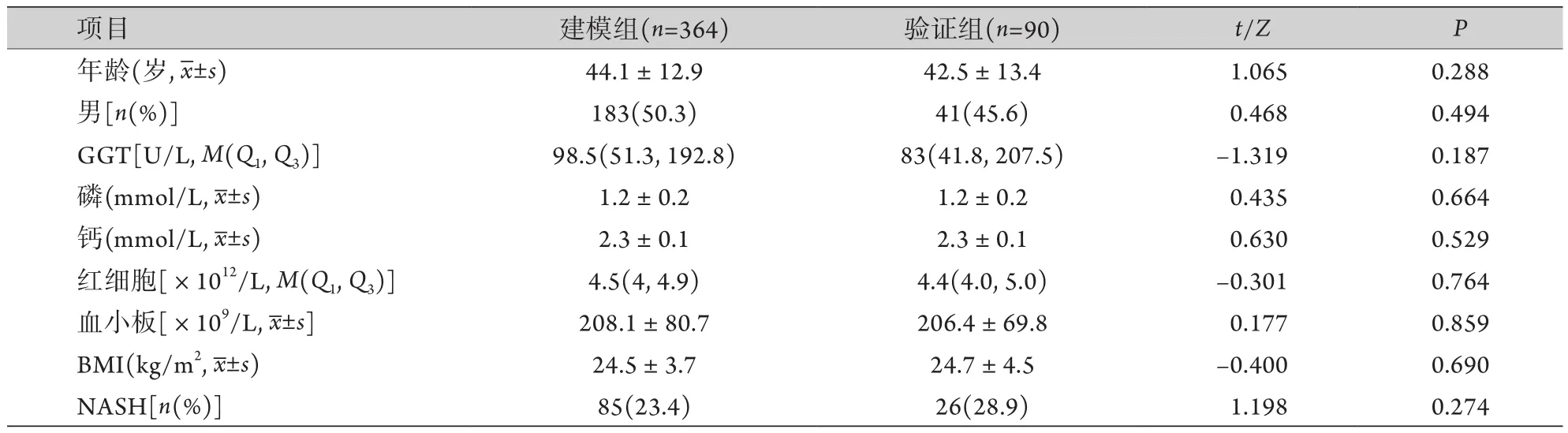
表1 两组患者一般资料比较Tab.1 General characteristics of patients in training group and validation group
2.2 NASH无创诊断模型构建 在建模组中,以NASH、非NASH为研究终点分组,将年龄、性别、血常规、生化及BMI等21项参数进行单因素分析,筛选出有明显差异的8项指标(年龄、性别、GGT、钙、磷、红细胞、血小板、BMI)进行logistic回归分析,并进行显著性检验筛选纳入模型的变量(纳入:P<0.05;剔除:P<0.01),最终确定与研究终点出现与否相关的独立预测指标,根据独立指标及其回归系数建立预测研究终点的多元回归方程,包含年龄、GGT、钙、磷、红细胞及BMI等6项指标,将该模型命名为NA-6(表2)。C=-20.242-0.033×年龄-0.011×GGT+3.493×钙+1.771×磷+1.416×红细胞+0.188×BMI。NA-6=eC/(1+eC),C为判别NASH的多元回归方程。
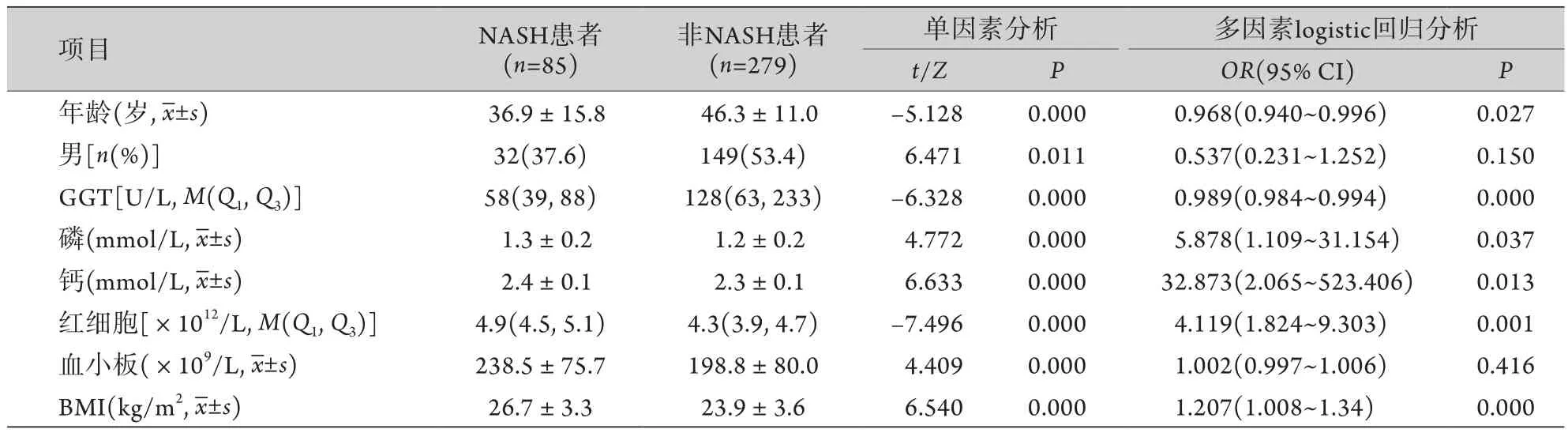
表2 建模组中NASH患者与非NASH患者临床指标比较Tab.2 Comparison of clinical characteristics between NASH and non-NASH patients in training group
2.3 NASH无创诊断模型的诊断价值 在建模组中,NA-6的AUC为0.893,以敏感度+特异度最大为条件,其诊断NASH的截断值为0.2,敏感度为84.7%,特异度为79.6%,阳性预测值度为57.1%,阴性预测值度为94.5%,准确度为81.6%。以该模型≤0.2为排除NASH的标准,可鉴别出79.6%的非NASH患者,阴性预测值可达94.5%。年龄、GGT、钙、磷、红细胞、BMI单独诊断NASH的AUC与该模型比较,差异有统计学意义(P<0.001,表3)。
2.4 NASH无创诊断模型的重复性 将NA-6模型应用于验证组,诊断NASH的AUC为0.829,两组之间 诊断效能基本一致,表明该模型有可重复性(表4)。
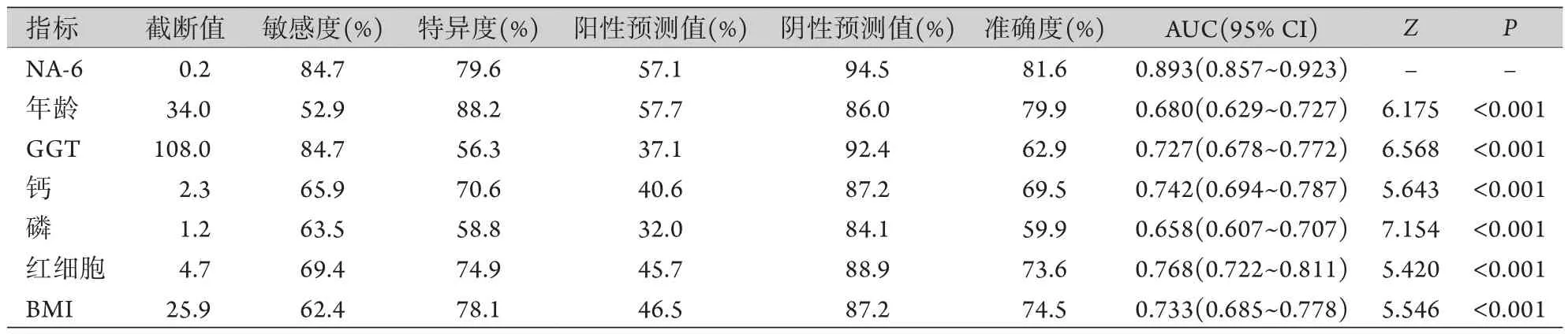
表3 非酒精性脂肪性肝炎无创诊断模型与各独立预测指标的诊断价值Tab.3 The diagnostic value of noninvasive diagnostic model and each of its independent prediction indicators

表4 非酒精性脂肪性肝炎无创诊断模型验证结果Tab.4 Validation results of the noninvasive diagnostic model of NASH
3 讨 论
NASH是由单纯性脂肪肝进展所致,是肝硬化及肝癌发生发展的重要原因[6]。肝组织活检目前仍是区分NAFL与NASH以及评估纤维化程度的有效手段,但肝组织活检样本仅占肝脏体积的1/5000,故不可避免地会产生抽样误差[7],且肝组织活检是一项侵入性技术,有0.3%的概率会出现严重并发症,限制了其在临床上的普遍应用。因此,研究者一直尝试使用无创血清指标,包括血常规、肝酶、生物化学标志物、基因等评估NASH及其严重程度,但目前尚无任何单项指标能足够准确判别NASH。近年来NASH无创诊断模型成为研究热点,有学者针对NASH的脂肪变性及纤维化程度建立无创诊断模型或指数。SteatoTest用于预测肝脏脂肪变性时,具有无创、操作简单和能进行定量评估的优势[8];脂肪肝指数(FLI)、NAFLD-肝脏脂肪分数(NAFLD-LFS)、三酰甘油-葡萄糖指数、内脏脂肪指数(VAI)和肝脂肪变性指数(HSI)等5项指标可用于诊断肝脂肪变性[9]。有研究将多种常规实验室和临床指标相结合,用于肝纤维化的预测评分诊断模型,包括BARD[10]、FIB-4[11]、NAFLD纤维化[12]和FibroMeter[13]等。冯巩等[14]回顾性分析127例NAFLD患者,以30例健康者作为非NAFLD人群,发现影响最大的指标为ALT(β=0.358,P=0.001),其次为BMI(β=0.258,P=0.012),诊断方程的AUC为0.927,灵敏度为87.7%,特异度为90.0%,截断值为277.7,具有较高的诊断效能。Eng等[15]收集了302例NAFLD儿童患者,经肝组织活检病理诊断后分为NASH组与非NASH组,在逐步变量选择后,以总胆固醇、腰围百分位数、总胆红素作为变量建立模型,其AUC为0.737,具有较高的辨别能力。龚先琼等[16]将94例NAFLD患者根据肝组织活检病理活动度积分(NAS)分为NASH组及非NASH组,两组年龄、BMI、ALT、AST、UA差异有统计学意义(P<0.05);Logistic回归分析显示,AST、UA水平与NAS有相关性(P<0.05)。
本研究以肝组织活检病理诊断的NASH病例为基础,构建以6项独立指标(年龄、GGT、钙、磷、红细胞及BMI)为内容的NASH无创诊断模型(NA-6),其预测NASH的AUC为0.893,根据截断值0.2设定排除标准,可将79.6%的非NASH患者筛选出来,从而避免肝组织活检,且阴性预测值可达94.5%,特异度为79.6%,敏感度为84.7%,准确度为81.6%,显示出良好的诊断效能,且具有可重复性。
BMI可以预测NASH的发生,与肝脏脂肪变性程度相关[17-18]。丁玉平等[19]发现NAFLD与肥胖密切相关,且BMI的分布与NAFLD检出率呈线性正相关,随着BMI增高,NAFLD检出率升高且脂变程度加重。内质网应激是导致NASH发病的主要因素之一,而血清钙是内质网功能障碍和应激的主要诱因,钙含量升高与NAFLD呈剂量依赖性相关,且相关研究表明,血清磷直接参与NAFLD的发病机制[20-21]。血小板可作为反映NASH的指标,随着NASH进展,其活性明显增加[22],且血小板压积升高是女性NAFLD发病的独立预测因素[23]。全球成人NAFLD患病率为10%~40%,是发达国家儿童和青少年最常见的肝病,其脂肪变性程度与年龄呈负相关[24]。GGT在脂肪肝病变中作为一种保护性酶,在抗氧化和促进氧化型谷胱甘肽转化成还原型谷胱甘肽的过程中起着重要作用[25]。酒精性肝病患者GGT明显升高,NAFLD患者GGT多为轻度升高[26-28]。本研究结果显示,NASH无创诊断模型的诊断效能明显优于各个单项指标,表明将有价值的指标合理组合构建模型,可以提高判别能力。
本研究以无创指标构建的NASH无创诊断模型NA-6具有良好的诊断价值和稳定性,利用该模型可对NASH的诊断及严重程度做出敏感、准确的判断,可在一定程度上替代肝穿刺活检指导临床治疗及随访病情转归,具有一定的现实意义。为提高该模型的准确度,尚须在更多肝穿刺活检患者中验证其评价肝脏脂肪变性程度动态发展的能力,以及是否可单独用于疗效评估。
