恶性胶质瘤U87细胞中miR-147启动子区甲基化程度对miR-147表达及细胞增殖的影响
2020-09-02武伟男许小斌连世忠
武伟男,许小斌,连世忠
基因启动子区高度甲基化可以关闭某些基因尤其是抑癌基因的活性,导致基因表达受限,表达量降低,从而影响细胞的增殖[1-3]。一些研究发现,微小RNA-147(miR-147)在肺癌、卵巢癌等肿瘤组织中可以抑制肿瘤细胞的增殖,起抑癌基因的作用[4-6]。而目前及既往研究中并未提及miR-147启动子区甲基化在胶质瘤研究中的相关报道,本实验应用恶性胶质瘤细胞U87细胞模拟人体胶质瘤组织,探究U87细胞中miR-147基因启动子区甲基化程度与miR-147表达量及细胞增殖的关系,为胶质瘤的诊断以及治疗提供参考依据。
1 材料与方法
1.1 主要试剂与仪器 U87细胞(北京协和医学院基础所细胞中心);DMEE高糖培养基、无菌磷酸缓冲盐溶液(PBS)溶液等;双抗;洁净工作台(江苏苏洁净化设备厂);低速低温离心机、移液器(Eppendorf);PCR仪、测序仪(美国ABI);电泳仪、电泳槽(北京六一仪器厂);冷冻离心机(安徽中科中佳科学仪器有限公司);台式高速离心机(湖南湘仪实验仪器开发有限公司);凝胶成像仪微型旋涡混合仪(上海沪西分析仪器厂有限公司);数显恒温水浴锅(太仓市科教器材厂);BP系列精密单道可调移液器(加拿大BBI);UV-Vis Spectrophotometer(Merinton);冰箱(青岛海尔股份有限公司)。其余试剂以及所用仪器均购置于上海生工股份有限公司。
1.2 配制不同浓度5′aza-dC DMEM高糖培养基 首先配制成浓度为1 mmol/L的储存浓度,然后分别用DMEM高糖培养基稀释,稀释后使其浓度分别为4 μmol/L、16 μmol/L备用。
1.3 细胞培养 培养基组成:DMEM、PBS以及双抗;培养条件:5%二氧化碳(CO2) 、37 ℃温培养箱。设置空白组与实验组,空白组用一般高糖培养基培养,实验组分别使用不同浓度5′aza-dC DMEM高糖培养基培养,并作为4 μmol/L组、16 μmol/L组,每组均设置3个复孔。实验过程中注意无菌操作,并且及时换液以保证细胞活性。
1.4 检测方法
1.4.1 使用BSP法检测U87细胞中miR-147启动子区甲基化程度 细胞培养24 h后,使用Ezup 柱式动物组织基因组DNA抽屉试剂盒提取各组细胞中的目的DNA,对提取的DNA使用亚硫酸氢钠修饰。BSP引物序列如下:上游引物序列为5′-ATAGTGGTGTAATTTTGGTTTATTG-3′,下游引物序列为3′ -CCCAACACTTTAAAAAACTAAAAC-5′,扩增序列为198bp(包括引物序列)。本次实验反应体系:总体积为64 μL,其中cDNA 1.5 μL,上下游引物各2 μL,dNTP(mix) 3 μL,Taq Buffer (with MgCl2) 5 μL,Taq酶 0.5 μL,dd H2O 50 μL。本次实验反应条件:95 ℃ 4 min,94 ℃ 30 s,55 ℃~60 ℃ 25 s,72 ℃ 40 s,35个循环,72 ℃ 6 min。PCR产物取5 μL进行电泳,即1%琼脂糖凝胶电泳,根据电泳图观察结果。亚硫酸氢盐修饰后测序所得图谱使用Chromas软件进行分析。各组中每个位点做5次克隆,重复2次,共10次克隆,记录每个位点发生甲基化的情况,计算各位点的甲基化率及各组总甲基化率。
1.4.2 QPCR技术检测各组细胞中miR-147表达量 继续细胞培养48 h后,检测各组细胞中miR-147表达量。首先通过Trizol试剂提取总RNA,然后在反转录试剂引导下进行RNA的反转录获得cDNA第一链,最后以单链cDNA 为PCR模板 ,在对应引物的引导下,以U6为内参,进行miR-147表达量的QPCR检测。检测引物序列miR-147-上游:5′-GGGGTGTGTGGAAAT-3′和miR-147-下游:3′ -AACTGGTGTCGTGGAGTCGGC-5′,U6-上游:5′-CTCGCTTCGGCAGCACA-3′和U6-下游:3′ -AACGCTTCACGAATTTGCGT-5′。反应程序:95 ℃,3 min;95 ℃,5 s;56 ℃,10 s;72 ℃,25 s;39 cycles;65 ℃,5 s;95 ℃,50 s。miR-147的表达量采用Ct比较法进行计算。每个复孔检测3次。
1.4.3 观察细胞数目及受抑制程度 显微镜下观察,记录细胞数目并计算细胞受抑制程度,细胞受抑制程度=[(空白组细胞数-实验组细胞数)/空白组细胞数]×100%。

2 结 果
2.1 目的基因序列与亚硫酸氢盐修饰后模式序列(见图1) 亚硫酸氢钠处理后模式序列:所有C转为T,CG位点仍然为C。方框内为设计引物的位置。该基因片段共有9个CG位点(见图1中红色标记)。将这些位点分别记作1~9。

图1 目的基因序列与亚硫酸氢盐修饰后模式序列(A为目的基因序列;B为修饰后模式序列)
2.2 各组电泳结果(见图2) 以下结果是取5 μL PCR产物进行电泳,电泳参数:150 V,100 mA所得的DNA Marker,分别是空白组(0 μmol/L)、4 μmol/L组以及16 μmo/L组,每条条带的核苷酸序列长度约为198 bp。
2.3 测序结果(见图3) 发生甲基化的CG位点保持不变,未发生甲基化的CG位点C碱基则变为T碱基。
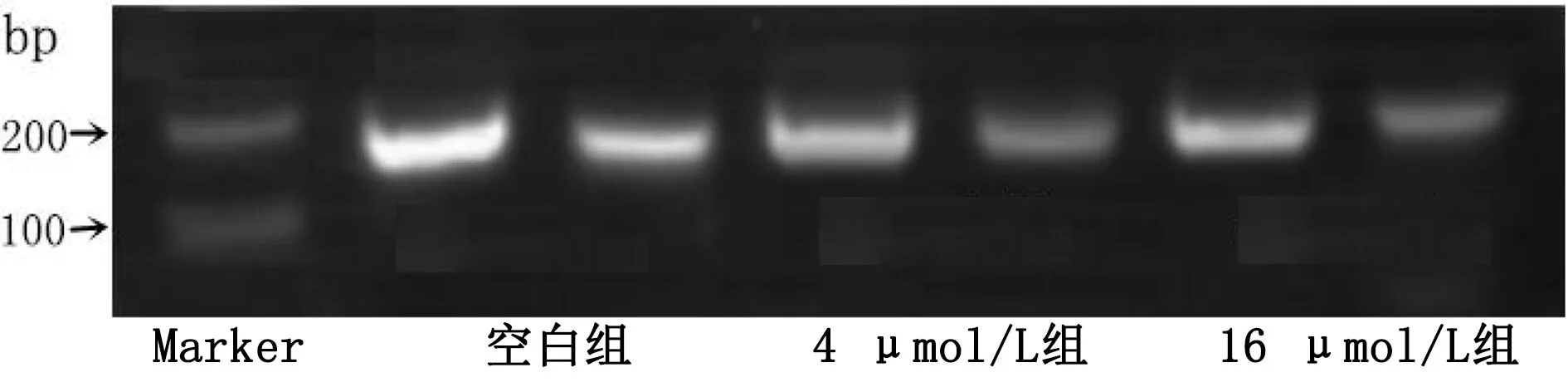
图2 各组电泳结果
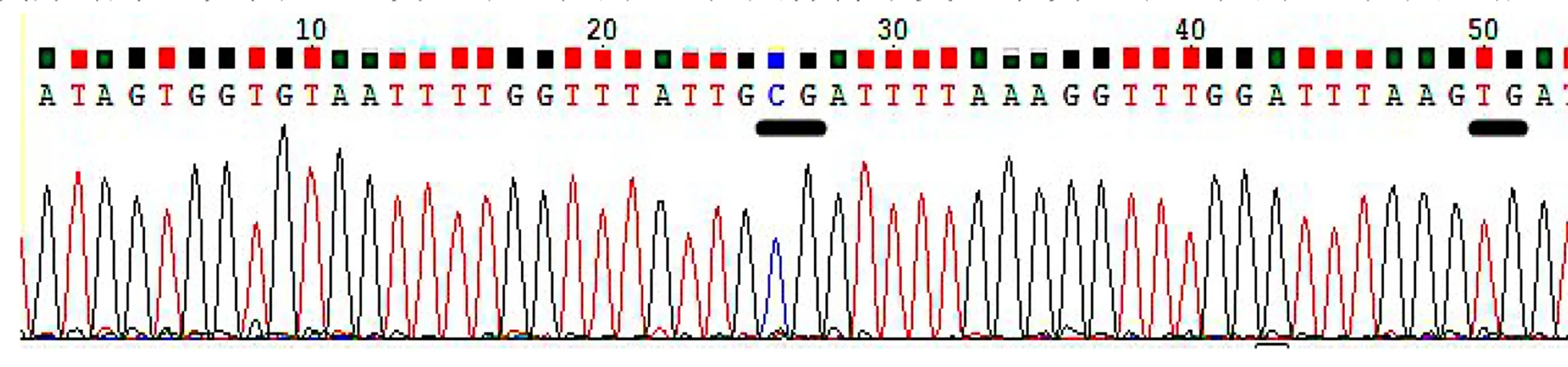
图3 测序结果
2.4 测序后各组miR-147启动子区甲基化率(见图4) 空白组各位点甲基化率分别为100%、40%、40%、20%、60%;4 μmol/L组各位点甲基化率分别为100%、40%、20%;16 μmol/L组各位点甲基化率分别为40%、20%。计算总甲基化率:空白组为14.6%,4 μmol/L组为8.9%,16 μmol/L组为3.4%。
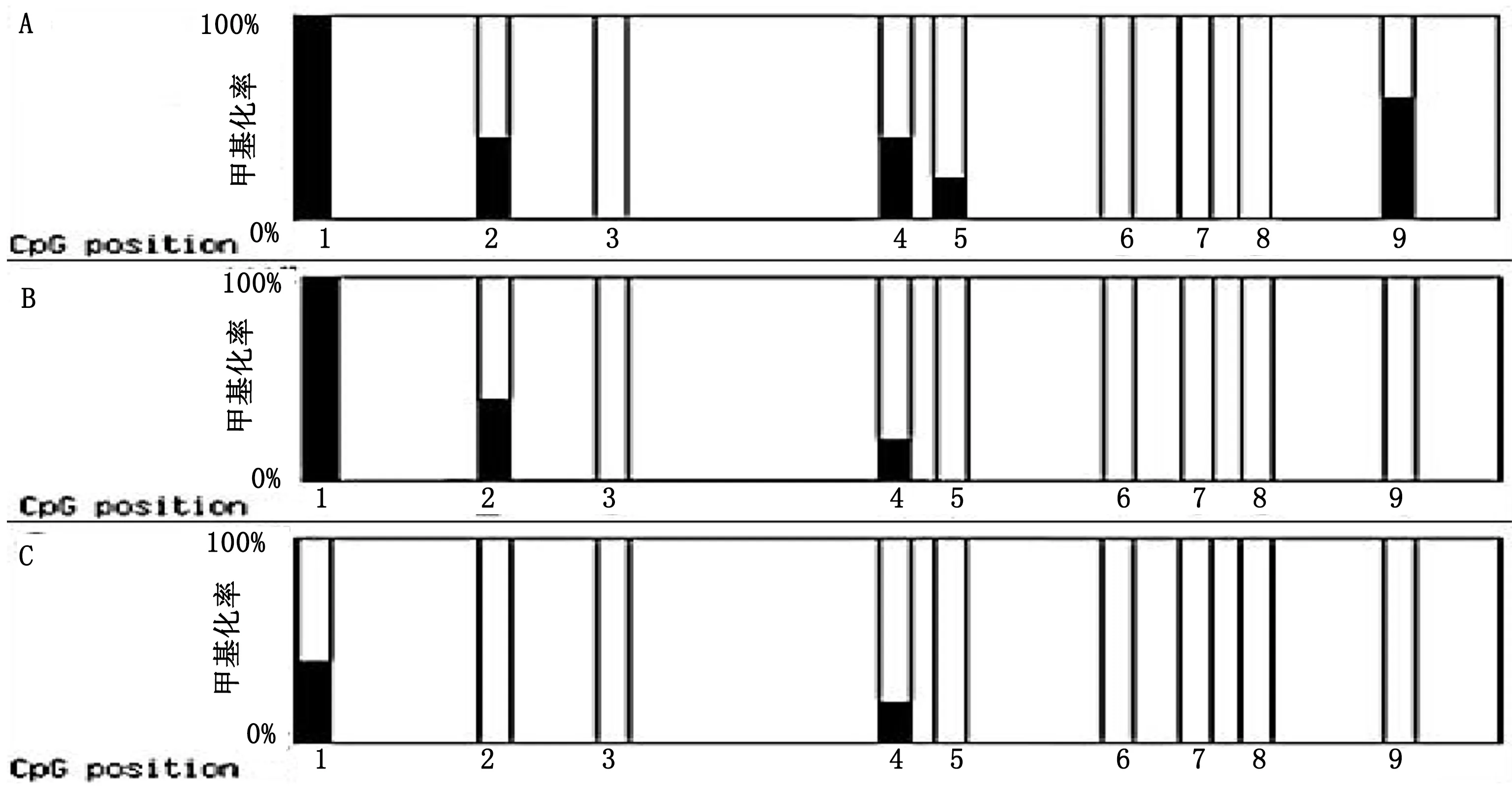
图4 测序后各组miR-147启动子区甲基化率(A为空白组;B为4 μmol/L组;C为16 μmol/L组)
2.5 不同组中miR-147表达量比较及细胞抑制率(见图5、图6) 空白组miR-147相对表达量为0.29±0.02,4 μmol/L组miR-147相对表达量为0.66±0.03,16 μmol/L组miR-147相对表达量为1.09±0.05。组间比较采用单因素方差分析,差异有统计学意义(P<0.001)。4 μmol/L组大约有19.4%细胞受抑制,16 μmol/L组大约有51.6%细胞受抑制。
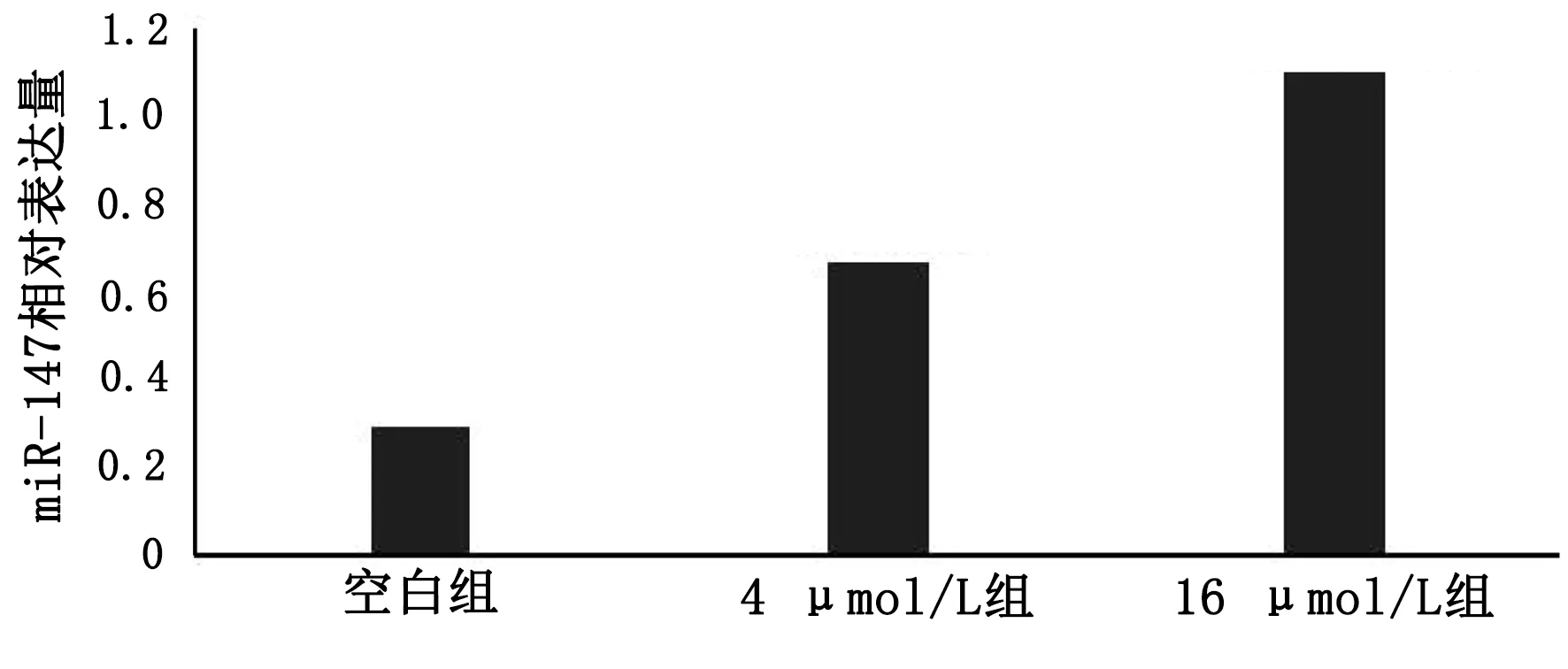
图5 各组中miR-147相对表达量
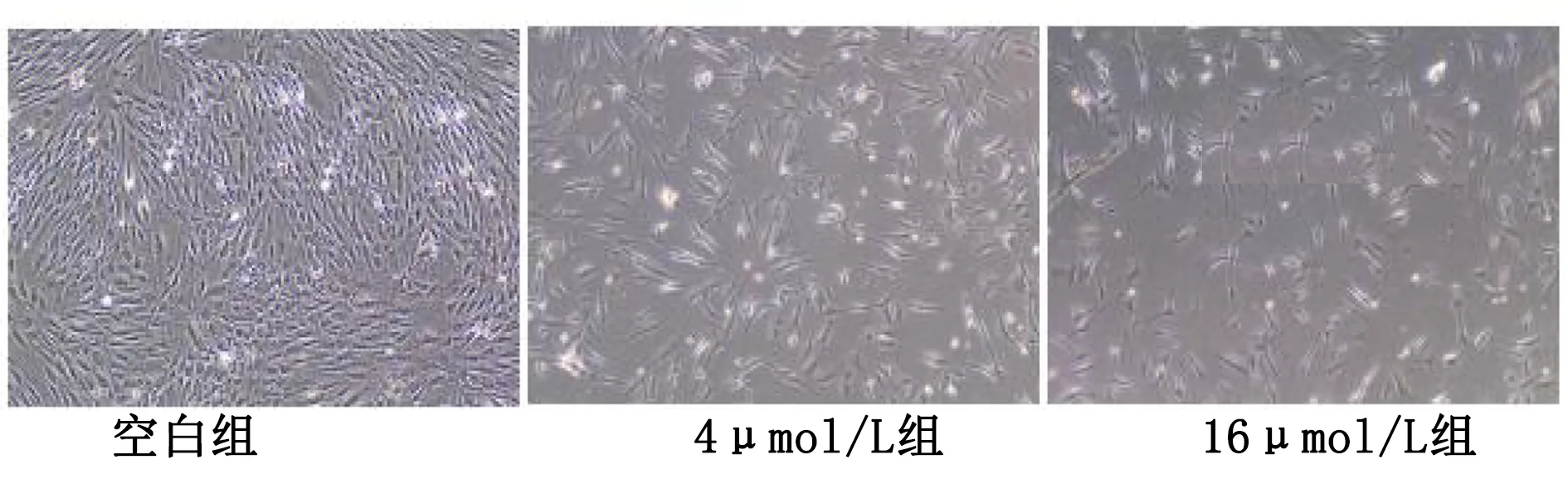
图6 各组培养72 h后细胞数目切片图
3 讨 论
胶质瘤是神经外科常见的一类肿瘤,在颅内肿瘤中占比非常高,其发生率占颅内肿瘤的40%~50%[7-9],其治疗相当困难,尤其是胶质母细胞瘤[10],即使积极通过手术、放化疗等措施,其生存周期也往往不足1年。而临床治疗胶质瘤的化疗药物主要是去甲基化药物替莫唑胺[11-13],其主要作用为抑制MGMT基因启动子区甲基化程度。但是有些胶质瘤已经对替莫唑胺的去甲基化作用产生耐药性[14-16]。所以,需要寻找更为合适的方法来攻克这一难题,目前,研究基因启动子区甲基化是一个比较热门的方向。
基因启动子区甲基化广泛存在于包括人类在内的哺乳动物体内[17],尤其与某些肿瘤的发生发展相关[18-19]。研究基因启动子区甲基化主要是研究启动子区的CpG岛中CG位点的甲基化情况,如果CpG岛中甲基化程度过高,则会抑制该基因的表达,相反,如果降低启动子区的甲基化程度,则会使该基因表达恢复,这就是DNA启动子区甲基化的“开关”现象[10]。
本实验通过使用不同浓度的甲基化转移酶抑制剂5′aza-dC培养基培养U87细胞,使该细胞中miR-147启动子区甲基化水平发生不同程度的降低,并且检测各组中miR-147的表达量及细胞抑制率。根据实验结果,发现降低U87细胞中miR-147启动子区甲基化程度后会使miR-147的表达量增多,并且能够抑制细胞增殖。因此,这可能为去甲基化药物的研究提供一个新的作用位点,通过降低miR-147启动子区甲基化程度来达到治疗胶质瘤的目的,当然,这确切机制仍需要在人脑胶质瘤组织以及其他胶质瘤细胞系中做进一步的研究,并进行相关的动物实验研究。
