千年桐半木质化春梢扦插繁殖及生根机理研究
2020-08-31周幼成钟秋平李清平刘微芬邹玉玲葛晓宁曹林青
周幼成,钟秋平,李清平,刘微芬,邹玉玲,田 丰,葛晓宁,曹林青
(1. 中国林业科学研究院 亚热带林业实验中心,江西 分宜 336600;2. 南京林业大学,江苏 南京 210037;3. 益阳市林业局,湖南 益阳 413000)
千年桐Vernicia montana为大戟科Euphorbiaceae油桐属Vernicia落叶乔木,是我国特有的木本油料树种[1-2]。桐油具有良好的防水性、耐热性和绝缘性,常作为涂料用于家具、船舶、汽车以及半导体的制造,桐油还具有绿色环保以及无公害等特点,可开发成优质的生物质柴油及其他工业原料,具有广泛的利用前景[3-5],有研究表明,千年桐或可能成为缓解国家油料资源紧张的优势树种之一[6]。千年桐常见的繁殖方式为实生苗繁殖,实生繁殖的苗木遗传差异性大,不利于优良性状的保持,利用实生苗生产造林对良种需求量大,从幼苗到果实成熟周期长,投入成本高,限制了千年桐良种产业的发展。扦插繁殖是许多树种快速繁殖的方法,扦插苗能够保持母本优良性状,同时具有操作简单、成苗快、应用广泛等优点[7]。
相关学者对大戟科植物扦插进行了试验研究,但对千年桐扦插繁殖研究较少[8-10]。而且鲜有关于千年桐插穗内源激素和抗氧化酶对其生根影响的研究报道,内源激素和抗氧化酶对多个树种扦插生根存在明显的促进或抑制效应[11]。本研究以千年桐半木质化春梢为试材,对插穗生根过程进行拍照观察,了解其生根周期和生根方式;对插穗基部解剖结构进行显微观察,探究根原基的分化形成、不定根形成的组织起源和生根类型;通过检测相关生理指标,明确内源激素和抗氧化酶的变化对愈伤组织、不定根形成之间的响应机制及其相关性;采用3 因素3 水平L9(34)正交试验设计筛选能促进千年桐插穗生根的植物生长调节剂的最优组合,为千年桐扦插快繁及引种驯化提供科学理论基础。
1 材料与方法
1.1 试验地概况
试验地位于中国林科院亚热带林业实验中心(27°48′46″N,114°39′47″E),气候类型为亚热带季风性湿润气候,年均降水量约为1 600 mm,年均气温15.6 ℃,极端高温为40.1 ℃,全年无霜期约为260 d。试验于中心内的温室大棚中进行,大棚具有自动化喷雾设施,供水系统良好,排水通畅,棚内苗床上方3.5 m 处覆盖遮阳网,苗床高出地面约15.0 cm。
1.2 试验设计
插穗均采自千年桐良种示范林。以多年生母树上部半木质化春梢作为试材,将春梢剪为8 ~10 cm 每段,保留顶芽及1 片叶,扦插于河沙与黄心土同体积比的混合基质中。根据前期预试验结果可知,质量浓度低于500 mg/L 的植物生长调节剂,速蘸及浸泡处理对千年桐插穗生根促进作用并不显著,生根率较低。1)分别用800 mg/L 的IBA,NAA 和ABT-1 对插穗基部浸泡处理10 min,共3 个处理,每个处理选择150 株插穗,重复3 次,扦插后每隔7 d 调查取样一次,分析不同处理生根性状,对样品生根进行拍照观察,对其解剖结构进行显微观察,同时检测其相关生理指标;2)按照3 因素3 水平L9(34)正交试验设计[12],探究植物生长调节剂种类、质量浓度及处理时间对插穗生根的影响,正交设计试验组合见表1,清水处理作为对照,共10 个处理,每个处理选择100 株插穗,重复3 次,扦插35、63 d 后调查各组生根率、根长等生长性状指标。
1.3 扦插及管理
选用直径6 cm、高15 cm的无纺布袋盛放基质,基质袋用托盘整齐摆放于苗床上,基质在扦插前一天用0.5%高锰酸钾溶液消毒。插穗用0.1%的多菌灵水溶液消毒10 min,清洗后将插穗下端3 ~4 cm 浸泡于激素中,采用直插法,用竹条在基质上打出4 ~6 cm 的引导洞,扦插后用手压实插穗周围基质并浇灌清水,苗床上搭有1.2 m 高的拱棚并覆盖塑料薄膜。为保持插穗及土壤湿润,需及时喷雾,后用含有0.1%的高锰酸钾溶液和含有0.1%的多菌灵溶液进行交替消毒,及时清除坏死插穗,30 d 后每周消毒1 次。

表1 植物生长调节剂种类、质量浓度和处理时间正交试验因素水平Table 1 Orthogonal factors and levels of plant growth regulators species, concentration and treatment time
1.4 数据统计
1)形态及解剖结构观察。每隔7 d 取样一次,对生根形态进行拍照观察,截取插穗基部长度为1 cm 的茎段保存于FAA 固定液中,用于根系解剖结构观察研究,茎段固定和软化参照周乃富等[13]的研究方法,染色液为番红-固绿,使用Olympus BX51 显微镜观察并拍照。
2)生长性状的调查。扦插35 d 后统计愈伤率,63 d 后统计生根率,根长大于1 mm 视为生根[14],测定一级不定根最长根长、一级不定根平均根长、一级不定根数量、根系干质量。下文中的最长根长、平均根长和生根数皆是指一级不定根。将根系置于60 ℃恒温箱中烘至根系质量不变,称其干质量,精度为0.01 g。计算根系效果指数=(平均根长×根系数量)/插穗总数;根系生长指标隶属函数为R(X)=(X-Xmin)/(Xmax-Xmin),X为各处理中指标测定值,Xmin和Xmax为某一指标在所有处理中的最小值和最大值,对各处理生根效果进行综合评价[12]。
3)生理指标的测定。扦插0、21、42、63 d后截取插穗基部不定根及长约2 cm 的韧皮组织,液氮对样品速冻后保存于-80 ℃冰箱,用于分析内源激素含量和POD、SOD 活性。每次取样15 株,以安捷伦1260 高效液相色谱仪串联6420A 质谱仪测定植物内源激素生长素(IAA)、脱落酸(ABA)、赤霉素(GA3)和玉米素核苷(ZR)含量。激素提取:准确称取样品约0.5 g,加入10 倍体积乙腈溶液,4 ℃提取之后过夜,12 000g离心5 min,取上清液,沉淀再次加入5 倍体积乙腈溶液,提取2 次,合并所得上清液,加入25 mg C18 填料,剧烈震荡30 s,10 000g离心5 min,取上清,氮气吹干,以200 μL 甲醇复溶,过0.22 μm 有机相滤膜,放入-20 ℃冰箱待上机检测。电离方式:ESI 负离子模式;扫描类型:MRM;气帘气:15 psi;喷雾电压:-3 500 V;雾化气压力:65 psi;辅助气压力:70 psi;雾化温度: 400 ℃;色谱柱:Agilent ZORBAX SB-C18 反相色谱柱(2.1×150,3.5 µm);柱温:30 ℃;流动相:A:B=(水/0.1%甲酸):(甲醇),外标法定量;采用建成生物试剂盒法测定SOD、POD 的活性。
1.5 数据处理及分析
采用SPSS 20.0 和Excel 2016 等软件对数据进行统计及方差分析,对有显著性差异的指标进行Duncan’s 多重比较。
2 结果与分析
2.1 千年桐扦插生根过程形态和解剖结构观察
2.1.1 插穗生根形态观察
对插穗生根过程进行拍照观察,综合不同处理抽样调查情况,将插穗生根过程分为4 个阶段:1)0 ~14 d,切口逐渐愈合,基部产生愈伤组织,顶部萌生新芽(图l a);2)15 ~34 d,基部愈伤组织增多,新生芽继续生长(图1 b);3)35 ~42 d,开始产生不定根,生根类型有皮部生根型(图1 c)和愈伤组织生根型(图l d),新生顶芽及叶片产生光合作用;4)扦插43 d 以后,不定根快速生长,根系不断伸长增粗(图1 e)。千年桐以皮部生根为主,而且不同处理下插穗生长状态存在明显差异(图1 f、图1 g)。扦插75 d后开始进行炼苗移栽(图1 h)。
2.1.2 插穗生成过程解剖结构观察
对扦插0 d 千年桐插穗解剖结构进行显微观察,发现其表皮(Ep)位于茎段横切面最外层,具有细胞间隙大、排列疏松等特点,皮层(Co)则是由数层排列不规则的薄壁细胞组成,维管组织从里到外组成依次是髓(Pi)、木质部(Xy)、维管形成层(Vc)和韧皮部(Ph),对多个样本进行切片观察,均未发现潜伏存在的根原基和已分化的根原始细胞(图2a)。

图1 千年桐插穗根系生长变化特征及生根类型Fig.1 The alterant character on the root growth process and the rooting types of Vernicia montana
对不同时期插穗解剖结构进行显微观察,发现其生根大致经历4 个阶段,植物生长调节剂诱导分化根原始细胞、根原始细胞形成根原基(Rp)、根原基发育形成不定根(Ar)和不定根的伸长,与上述对生根形态拍照观察结果相对应。1)扦插14 d,在韧皮部和维管形成层部位发现了刚刚开始分裂的根原始细胞,但此时形成层细胞刚刚恢复分生能力,周围组织生长分化并不明显(图2 b);2)扦插21 d,薄壁细胞出现了明显的分裂分化,并开始向外产生类分生组织,进一步分裂形成排列紧密与周围细胞有明显区别的细胞团,即形成了根原基(图2 c);3)扦插35 d,根原基细胞团通过快速地平周分裂和垂周分裂等,其形态发生了巨大变化,由开始的卵圆形变为楔形,并朝着皮部不断延伸(图2 d);4)扦插42 d,根原基继续朝着韧皮部射线的方向生长,延伸到皮层区域,此时根原基可以区分出根冠(Rc)、根尖(Rt)和分生区,最外层表皮被不定根所突破(图2 e)。不定根继续生长到56 d 时,根冠区域逐渐分化出维管组织,与插穗的维管系统相连形成完整的根结构(图2 f)。图2 g 和图2 h 分别为生长35和42 d插穗基部切片,可以发现由愈伤组织(Ca)分化产生的根原基较少。
2.2 植物生长调节剂对千年桐插穗生根过程根系性状和生理的影响
2.2.1 植物生长调节剂对千年桐插穗内源激素的影响
调查不同植物生长调节剂处理下插穗生根过程内源激素含量变化,结果如图3 所示。IAA 含量总体变化规律为前期下降后期上升,IBA 与ABT-1 处理组变化趋势相同,扦插21 d 时即处于刚刚产生愈伤组织阶段,IAA 含量达到最低值,为57.63 ng·100 g-1,之后IAA 含量一直处于上升趋势,扦插63 d 时达到最高值261.92 ng·100 g-1,NAA 处理组IAA 含量前中期呈下降趋势,可能是插穗对NAA 的响应慢于其他两种植物生长调节剂。ZR 含量总体变化规律为前中期下降后期上升,IBA 与ABT-1 处理组ZR 变化趋势相一致,扦插42 d 时即处于刚刚生根阶段,ZR 含量降到最低值 45.63 ng·100 g-1,在扦插 63 d 时达到 100.12 ng·100 g-1,NAA 处理组变化趋势有所差异,但总体相同,低含量的内源ZAA 与愈伤组织及根系的产生关系密切。GA3含量总体处于下降趋势,扦插0 d 时为最高值44.27 ng·100 g-1,之后不断下降至最低值 7.86 ng·100 g-1。ABA 含量始终处于较高水平,IBA 与ABT-1 处理组ABA 变化趋势相似,扦插21 d 即刚刚产生愈伤组织时ABA 略有上升,后不断下降到最低值145.61 ng·g-1,NAA 处理组 ABA 含量保持平稳上升至263.94 ng·g-1,含量远远高于其他两个处理组,高浓度的内源ABA 在插穗愈伤组织及不定根的形成过程中起到一定作用。
2.2.2 植物生长调节剂对千年桐插穗SOD、POD活性的影响
调查不同植物生长调节剂处理下插穗生根过程SOD、POD 活性变化,结果如图4 所示。不同处理间SOD 活性总体变化规律大致相同,扦插21 d时SOD 活性下降到最低值38.26 U·g-1,21 d 以后其活性呈现快速增长的趋势,扦插63 d 时即根系发育完全阶段,其活性达到最大值132.64 U·g-1。剪取千年桐枝条进行扦插时,离体的插穗在生根过程中会产生大量的超氧自由基,超氧自由基的累积使插穗受到活性氧胁迫,SOD 具有清除超氧自由基的作用[15],因此SOD 活性的变化与插穗愈伤组织及不定根的产生有密切的联系,插穗愈伤组织形成前SOD 活性较低,随着愈伤组织及根系的产生超氧自由基不断累积使SOD 活性不断增加。氧化酶POD 广泛存在于植物细胞中,它的变化与插穗生根关系密切,不同处理间POD 活性总体变化规律存在差异,NAA 与IBA 处理组POD 活性变化趋势相一致,前期上升中后期不断下降,但POD 活性一直保持在较高水平,ABT-1 处理组POD 活性则是前期下降中后期不断上升至最高值455.12 U·g-1,植物生长调节剂处理提高了POD 活性。
2.2.3 不同生根阶段生长生理指标相关性分析
扦插35 d 与63 d 分别调查不同处理的愈伤率和生根率,同时,检测分析扦插21 d 和63 d 不同处理样品的相关生理指标,重复3 次,结果如表2所示,不同处理、重复之间生长生理指标存在明显差异。
对表2 数据进行相关性分析,结果如表3 所示,插穗的愈伤率和生根率呈正相关,但不显著。愈伤率与扦插21 d 的ABA 含量显著正相关,与SOD、POD 活性呈显著负相关(P<0.05);IAA含量与ZR、GA3的含量呈显著负相关,与SOD、POD 活性呈显著正相关;ZR 与GA3以及SOD 与POD 之间均呈显著正相关;ABA 含量与POD 活性呈显著负相关。扦插63 d 时,插穗生根率与IAA、ZR 含量呈显著正相关;IAA 与ZR 存在极显著正相关(P< 0.01);ABA 与IAA、ZR、POD 之间均存在显著负相关,ABA 含量的变化对其他三者产生显著影响。
2.3 植物生长调节剂种类、质量浓度和处理时间对千年桐春梢扦插生根的影响
2.3.1 不同处理间根系生长性状比较
扦插35 d 后统计愈伤率,63 d 后统计生根率等根系生长性状指标,结果如表4 所示。不同处理间根系发育情况存在显著差异,处理组根系生长发育情况显著优于CK。插穗的愈伤率、生根率、平均根长、根系干质量和根系效果指数呈现显著差异,T1用 500 mg/L 的 ABT-1 处理 30 min与 T2用 800 mg/L 的 ABT-1 处理 10 min 插穗根系生长情况显著优于其他处理(P<0.05)。处理组插穗愈伤率范围为35.17%~64.83%,生根率
范围为25.93%~43.97%,根系效果指数范围为1.07 ~2.77,最大值皆出现在T1,最小值皆出现在 T7即用 500 mg/L 的 NAA 处理 1 min。
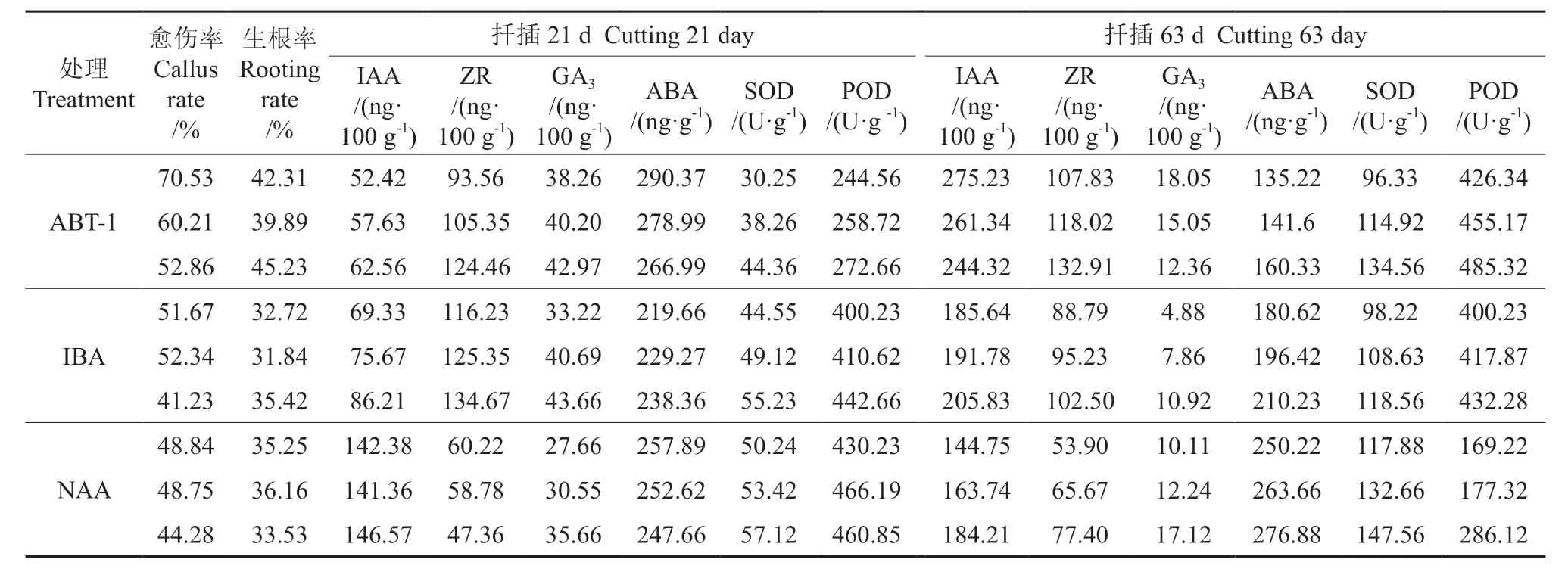
表2 不同处理下千年桐插穗相关生长生理指标Table 2 Correlation analysis of physiological indexes of Vernicia montana cuttings

表3 插穗不同生长阶段生长生理指标相关性分析†Table 3 Correlation analysis of growth physiological indexes in different growth stages of cuttings

表4 植物生长调节剂种类、质量浓度及处理时间对千年桐插穗生根的影响†Table 4 Effects of different plant growth regulators, concentration and treatment time on rooting of Vernicia montana cuttings
2.3.2 植物生长调节剂种类、质量浓度和处理时间对插穗生根影响方差分析及LSD 多重比较
对插穗根系生长指标进行方差分析,其结果如表5 所示,不同种类的植物生长调节剂对插穗愈伤率、生根率、根系干质量和根系效果指数均有极显著影响(P<0.01),对平均根长和最长根长影响显著(P<0.05);植物生长调节剂质量浓度对插穗根系生长指标均无显著性影响;处理时间对插穗愈伤率、生根率、平均根长、根系效果指数均有极显著影响(P<0.01)。
对表5 中有显著差或极显著异因素的各水平进行多重比较,其结果如表6 所示,ABT-1 处理组的根系生长发育指标皆显著高于NAA 处理组,ABT-1 处理组的愈伤率、生根率、根系干质量和根系效果指数显著高于IBA 处理组(P<0.05)。植物生长调节剂质量浓度间距过小,导致质量浓度对插穗根系生长的影响无显著性差异。时间对插穗根系生长产生不同影响,处理10、30 min 时,插穗的愈伤率、生根率、平均根长和根系效果指数皆显著高于处理1 min(P<0.05),处理30 和10 min对插穗根系生长的影响无显著性差异。ABT-1 对千年桐插穗生根促进效果显著优于NAA 和IBA,10、30 min 处理时间显著优于1 min,一定范围内延长植物生长调节剂处理时间有助于插穗生根。

表5 植物生长调节剂种类、质量浓度和处理时间对千年桐插穗根系生长影响的方差分析Table 5 Variance analysis of the effects of different plant growth regulators, concentration and treatment time on cutting rooting parameters of Vernicia montana

表6 植物生长调节剂种类和处理时间对千年桐插穗根系生长影响的LSD 多重比较Table 6 LSD multiple comparison of the effects of different plant growth regulators, treatment time on cutting rooting parameters of Vernicia montana
2.3.3 根系生长性状隶属函数值及综合评价
采用模糊数学中的隶属函数分析法对9 个处理组合的7 项指标进行分析及综合评价,结果如表 7 所示,T1用 500 mg/L 的 ABT-1 处理插穗30 min,其平均隶属函数值为0.976 为最佳处理组合,T7用500 mg/L 的NAA 处理插穗1 min,其平均函数值为0.142,为最差处理组合。

表7 植物生长调节剂种类、浓度和处理时间对根系生长指标的隶属函数值及综合评价Table 7 Membership function values and synthetic valuation of root development indicators in plant growth regulators species, concentration and treatment time
3 讨 论
插穗生根过程与自身的遗传特性、生态学、生物学密切相关,同时受外界多种因素如光照、空气、温度、湿度共同调控,是一个极其复杂的生理过程[16]。植物生长调节剂诱导根原始体的产生以及调配插穗内营养物质,有助于不定根的形成[17-20],对千年桐扦插前插穗解剖结构进行观察,未发现根原始细胞,经过植物生长调节剂处理,插穗产生了根原基,说明千年桐根原基是扦插后经植物生长调节剂诱导产生的,这与海棠果Malus prunifoliaBrokh[21]和核桃Juglans regiaL.等[22]相似,均属于诱导根原基产生之后再分裂分化形成不定根。ABT-1,IBA 和NAA 是常见的促生根剂,IBA 具有稳定性强、降解代谢慢和毒性小等优点,作为一种高效的生根剂被广泛的使用[23-25],NAA的生理活性高且毒性比IBA 大,多项研究发现IBA 比 NAA 更容易促进植物插穗生根[20,26-28],这与本研究结果相似,但ABT-1 对插穗根系生长的促进作用显著优于前两者,原因是植物生长调节剂的混合使用能更大程度促进插穗生根[29]。植物生长调节剂质量浓度也是影响植物生根的重要因素之一,王良桂等[30]发现植物生长调节剂质量浓度对插穗生根产生重要影响;赵翔等[17]研究发现,植物生长调节种类和处理时间是影响灰木莲Manglietia coniferaDandy 插穗生根的两大主要因素,但质量浓度并未显著影响插穗生根,这与本试验结果相同;处理时间对根系的生长产生了显著影响,处理10 min 和30 min 两者不存在显著差异,但都显著高于1 min,处理时间可能与激素质量浓度产生了综合效应。
千年桐扦插生根过程中,同一生根阶段不同处理间内源激素含量存在明显差异,不同种类的内源激素含量变化差异明显。研究发现IAA 在不定根生成过程中起着重要作用,主要作用于受体蛋白后通过转运糖类等物质来促进根原始细胞的分裂生长[11]。本研究结果表明,扦插前期IAA 含量降低,在插穗形成愈伤组织到根系快速生长阶段,IAA 含量快速增加,其变化曲线与根原基加速分裂分化时期相一致,这与詹亚光和欧阳芳群等[31,11]研究结果相同,NAA 处理组的IAA 含量低于其他两个处理,这也是NAA 促进生根效果较ABT-1,IBA 差的原因之一。李永欣等[32]和李朝婵等[33]认为ZR 在不同生根时期作用不同,低质量浓度的ZR 有利于根原始细胞的分化形成,高质量浓度的ZR 促进根原基的生长发育,ZR 在根原始细胞分裂分化及愈伤组织形成过程中有所消耗,其含量呈下降趋势,在不定根长出后,通过自身合成作用使其含量增加,这与本研究结果相一致,生根与IAA、ZR 含量呈显著正相关。内源ABA 含量始终处于较高水平,Zhang 等[34]研究发现ABA 是植物体内一种天然的抑制性植物激素,具有抑制细胞分裂的作用,ABA 会诱导气孔关闭,减少蒸腾作用,从而减少水分的流失,所以高质量浓度的ABA 在插穗愈伤组织及不定根的形成过程中起到一定促进作用。内源GA3含量水平较低且一直处于下降趋势,韩继红等[35]研究认为赤霉素对不定根的形成有抑制作用,Brian 等[36]研究发现GA3在生根过程中抑制了根原基细胞的分裂,从而抑制根系的形成,Haissig 等[37]发现GA3阻碍了生长素对根原基细胞的诱导,同时阻碍了根原基的进一步生长发育。大量研究表明,逆境胁迫会很大程度影响植物的酶促系统,植物酶SOD、POD 等会组成有效的清除系统,能及时清理过氧化物和自由基[15,38],离体的插穗在生根过程中会产生大量的超氧自由基,超氧自由基的累积使插穗受到活性氧胁迫,SOD、POD 具有清除超氧自由基的作用,因此SOD、POD 活性的变化与插穗愈伤组织及不定根的产生有密切的联系,随着愈伤组织及根系的产生超氧自由基不断累积使SOD、POD 活性保持较高水平。木本植物扦插生根机理极其复杂,千年桐扦插更是难以生根,因此,还需深入探究千年桐扦插繁殖生根机理及生理代谢机制,完善扦插繁育体系。
4 结 论
本试验首先探究了3 种植物生长调节剂ABT-1,IBA 和NAA 对千年桐扦插生根的影响,对生根过程进行拍照观察,以及对根系解剖结构进行显微观察,发现插穗经植物生长调节剂处理,可以诱发其根原始细胞分裂分化形成根原基,进而发育形成不定根,插穗生根时间为扦插后6 ~7 周,主要以皮部生根为主,不同植物生长调节剂对插穗生根过程生长性状、内源激素含量及SOD、POD 活性的影响差异明显,部分内源激素对插穗形成愈伤和不定根有显著影响,内源激素含量及抗氧化酶活性始终处于动态变化之中,其通过协同作用促进不定根产生。之后在更深入地探究植物生长调节剂种类、质量浓度及处理时间对插穗生根的影响时发现,ABT-1 生根效果显著优于IBA 和NAA,处理时间10、30 min 显著优于1 min,其质量浓度对生根影响不显著,在10 个处理中,T1即用500 mg/L 的ABT-1 处理30 min,插穗根系生长情况显著优于其他处理。
