安神补脑液对失眠大鼠模型海马组织内GABA_ARα1、GABA_ARγ2、NKCC1表达的影响
2020-08-27于智莘吕宏亮李晶宋琳琳粟栗于江波
于智莘 吕宏亮 李晶 宋琳琳 粟栗 于江波
(1长春中医药大学,吉林 长春 130117;2吉林敖东延边药业股份有限公司)
失眠又称入睡和维持睡眠障碍(DLMS),临床上以难于入睡、频度过短、深度不足、早醒及睡眠质量不佳、持续时间短等为主要症状的一种病证〔1〕。临床上用于治疗失眠的药物主要以人工合成的镇静催眠的西药制剂为主,通过缩短睡眠潜伏期,延长睡眠时间起到改善睡眠质量的作用,但因其对大脑中枢神经系统(CNS)存在广泛的抑制作用,长期服用极易产生成瘾性和依赖性。中医药在治疗失眠方面疗效显著,无成瘾性、依赖性,无不良反应及停药反跳现象,且药毒性及副作用少。安神补脑液(ASBN)具有安神健脑、生补精髓、涵养气血之功效。本文通过建立失眠动物模型,观察ASBN对失眠大鼠睡眠状态的改善作用及该药对模型大鼠海马体内γ-氨基丁酸受体(GABA)_ARα1、GABA、ARγ2、Na+-K+-Cl-协同转运蛋白(NKCC1)表达的影响,从而从海马体内神经递质受体及NKCC1表达的角度探索ASBN治疗失眠的机制。
1 材料和方法
1.1实验动物及材料 SD大鼠90只购自辽宁省长生生物技术股份有限公司,动物合格证号:SCXK-(辽)2015-0001,9~11周龄,体重185~215 g,雄雌各半。KM昆明种小鼠20只购自辽宁省长生生物技术股份有限公司,动物合格证号:SCXK-(辽)2015-0001,10~12周龄,体重18~22 g,雄雌各半。
试剂:对氯苯丙氨酸(PCPA)(Sigma,USA);合成PCR引物(Sangon Biotech上海);戊巴比妥钠(Sigma,USA); UNIQ-10柱式Trizol总RNA提取试剂盒(Sangon Biotech,上海);兔抗GABA_ARα1 (Protein Tech,USA) ,兔抗GABA_ARγ2(Protein Tech,USA) ,NKCC1(Protein Tech,USA) ; Trans Script Green Two-Stepq RT-PCRSuperMix(全式金生物技术,北京);北京化工厂氯仿(CNNo.32061);生理盐水(四药有限公司,石家庄,批号:H2015653);MS104TS 电子天平(梅特勒-托利公司,瑞士); 7500型Real-timePCR仪(ABI)。
1.2复制失眠模型〔2〕SD大鼠先进行适应性喂养7 d后进行称重,运用完全随机分组法分为正常组(15只)和模型组(75只),模型组腹腔注射PCPA混悬液,正常组腹腔注射等体积0.9%生理盐水,连续注射2 d后观察模型组及正常组状态。将复制成功的失眠模型大鼠完全随机分为模型组、ASBN-高剂量(H)组、ASBN-中剂量(M)组、ASBN-低剂量(L)组和氟西汀(Fluoxetine)组各15只。正常组和模型组连续7 d生理盐水灌胃;Fluoxetine组:连续7 d Fluoxetine 1.5 mg/kg灌胃;ASBN-H组、ASBN-M组、ASBN-L组:连7 d ASBN 100、75、50 mg/kg灌胃。根据大鼠给药体表面积公式计算出各用药组大鼠的给药剂量。
1.3探索戊巴比妥钠睡眠剂量的阈值〔3~6〕该实验首先通过入睡率确定戊巴比妥钠睡眠剂量的阈值。入睡的评定标准:给药30 min内小鼠翻正反射消失>1 min。戊巴比妥钠睡眠剂量阈上值评定标准:小鼠完全入睡,又不使睡眠时间过长的剂量;戊巴比妥钠睡眠剂量阈下值评定标准:90%~100%小鼠翻正反射不消失的药物最大剂量。经过预实验确定,小鼠戊巴比妥钠睡眠剂量阈值为35~45 mg/kg。
测试前小鼠禁食12 h,称取体重,计算每只小鼠注射戊巴比妥钠的剂量。6组小鼠于第5天给药30 min后,经腹腔注射戊巴比妥钠阈下值35 mg/kg,以小鼠翻正反射消失时间为指标,记录30 min内入睡小鼠百分率为入睡率。
1.4观察指标 观察大鼠精神,活动状态,皮毛颜色,饮水、进食量及对外界刺激的反应等。
1.5对戊巴比妥钠阈下值大鼠入睡率的影响〔7~9〕ASBN-H、M、L组灌胃,模型组给予等剂量0.9%生理盐水,灌胃结束后1 h,各组动物腹腔注射戊巴比妥钠阈下值35 mg/kg(临用前现配),Fluoxetine组给予0.25 mg/kg Fluoxetine溶液,灌胃量0.01 ml/g。观察并记录给予戊巴比妥钠后30 min内各组大鼠入睡的数量(入睡评定标准:30 min内翻正反射消失达1 min以上)。
1.6免疫组化染色(IHC)-P法检测大鼠海马体齿状回GABA_ARα1的表达〔10,11〕取材:最后一次给药1 h后,每组随机取大鼠10只,雄雌各半,腹腔注射10%水合三氯乙醛〔CCl3CH(OH)2〕3 ml/kg进行麻醉,腹主动脉采血,10 min后,灌注大量生理盐水冲洗至肝脏发白,流出液基本无色后灌注4%多聚甲醛,致全身僵硬,于10 min后断头取脑,放入4%多聚甲醛溶液中,置于4℃固定,取海马段,常规石蜡包埋切片。IHC:60℃烤片,二甲苯脱蜡,乙醇梯度入水,冲洗,抗原修复,内源性过氧化物歧化酶封闭,加一抗1∶50工作液,2~8℃孵育过夜,生物素标记(兔抗GABA_Aα1),室温孵育,磷酸盐缓冲液(PBS)冲洗,加辣根过氧化物酶(HRP)标记的霉亲和素室温孵育,PBS 冲洗,DAB显色,冲洗,苏木素复染,盐酸-乙醇分化,乙醇梯度脱水,二甲苯透明,中性树胶封片,光镜下检测。GABA_ARα1受体蛋白OD值检测:使用Image Pro plus(IPP)7.0图像分析软件,检测阳性细胞的积分OD值,每张切片选取5个视野,取平均值。
1.7qPCR〔6〕加入Trizol研磨大鼠海马体脑组织,取上清液,依次加入CCl3、C2H5OH提取总RNA;根据总RNA浓度计算模板加样量,使用RT-PCR试剂盒逆转录成cDNA,GABA_ARγ2正义链:5′-CTTCTTCGGATGTTTTCCTTCAGG-3′,反义链:5′-CATAGGGTATTAGATCGTTGGACT-3′,退火温度60℃,NKCC1正义链:5′-TTACTACCTGCGCACCTTCG-3′,反义链:5′-TCCAGCTCATCGTGGAACTC-3′,退火温度62℃,β-actin上游引物:5′-CCCATCTATGAGGGTTACGC-3′,下游引物:5′-TTTAATGTCACGCACGATTTC-3′,退火温度61℃。PCR扩增反应条件:95℃ 10 min,95℃ 20 s,60℃ 60 s,扩增36~40个循环。反应结束后,读取PCR软件内的循环阈值(CT值),采用ΔΔCT法处理结果,以β-actin为内参计算GABA_ARγ2和NKCC1的相对表达量,以2-ΔΔCt表示。
1.8统计学分析 采用SPSS22.1软件行方差分析。
2 结 果
2.1一般状态 正常组精神状态良好,活动敏捷,毛发光亮,体重明显增加。模型组精神亢奋,易激惹,毛发干枯、无光亮,饮水量明显增加,形体消瘦。Fluoxetine组和ASBN-H、M、L组精神状态、活动情况均不同程度优于模型组。
2.2戊巴比妥钠阈下值催眠实验 正常组入睡率为25%,与模型组(10%)比较,各剂量给药组均能使戊巴比妥钠阈下值30 min内的入睡率增加(Fluoxetine组90%,ASBN-H、M、L组为74%、52%、40%;P<0.05)。
2.3ASBN对失眠大鼠模型海马体组织中GABA_ARα1受体表达量的影响 在光学显微镜下可见,免疫组织化学切片的背景呈现淡黄色,免疫阳性细胞呈现不同程度的棕黄色,海马体齿状回GABA_ARα1受体呈现圆形、卵圆形及多角形,大小不一,细胞突起为 2~3个。结果显示,模型组(0.030 2±0.009 6)与正常组(0.053 6±0.024 9)比较,大鼠海马体齿状回GABA_ARα1受体表达量明显减少(P<0.05)。与模型组比较,Fluoxetine组(0.052 1±0.030 7)显著增加(P<0.01),ASBN-H组(0.049 2±0.036 8)明显增加(P<0.05);ASBN-M组(0.047 7±0.029 6)、ASBN-L组(0.044 9±0.030 2)与模型组差异无统计学意义(P>0.05),见图1。

图1 各组海马体齿状回GABA_ARα1表达(IHC-P,×100)
2.4GABA_ARγ2和NKCC1 mRNA在失眠大鼠海马体脑组织中的表达 各组GABA_ARγ2 mRNA表达差异显著(P<0.05);模型组较正常组明显下降(P<0.05);与模型组比较,Fluoxetine组、ASBN-H组明显增高(P<0.05)。各组NKCC1 mRNA表达无明显差异(P>0.05),但模型组表达呈升高趋势,且各用药剂量组都呈现降低趋势,见表1。
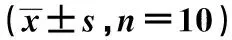
表1 各组海马体GABA_ARγ2、NKCC1 mRNA 表达比较
3 讨 论
睡眠是人体最基本的生理功能,既重要又复杂,涉及中枢系统的多个部位,且受到多种因子的影响。目前已知的部位涉及脑干、下丘脑、皮质、海马区等多个脑区,涉及的因子主要有神经递质、激素、细胞因子、肽类物质等。经过长期研究表明,海马与人体睡眠关系密切。其中海马体〔9〕内GABA_ARα1、GABA_RA、γ2、NKCC1可作为研究失眠机制的重要依据。GABA_AR药理学研究集中在BDZ位点上,通过结合GABA_AR上一个特异的识别位点(α1),进而增加Cl-通道的开放频次,使Cl-内流,细胞膜超极化,产生具有抑制性的突触后电位,从而增强对GABA的抑制作用。本实验以此作为选取GABA_ARα1、GABA_AR、γ2作为观察指标的理论支撑〔10〕。
本研究结果表明,ASBN对改善失眠大鼠睡眠节律有一定作用,其作用机制可能是提高大鼠海马体中GABA_ARα1和 GABA_ARγ2,减少NKCC1,从而起到治疗作用。
