miR-19-3p靶向TC-1对口腔鳞癌细胞增殖、凋亡、迁移、侵袭的影响
2020-08-27尹雪莲杨光马东杰苏哲君霍峰王鹏
尹雪莲 杨光 马东杰 苏哲君 霍峰 王鹏
(1承德医学院附属医院口腔科,河北 承德 067000;2秦皇岛市中医医院手术室)
口腔鳞癌是一种非常常见的口腔颌面部的恶性肿瘤之一,威胁人类的生命健康安全〔1〕。miRNA为长度在18~25个核苷酸之间的内源性短链非编码RNA,其在癌症发生发展中的调控作用受到关注〔2,3〕。miR-19-3p在多种癌症表达失调,但其在口腔鳞癌中的作用机制仍需继续探索。甲状腺癌相关基因(TC)-1位于8p11~12,是一种含106个氨基酸编码的固有无序蛋白,广泛表达多种组织器官中,其在许多信号通路中均起重要作用,例如Wnt /β-连环蛋白信号通路,且参与许多癌症的发展〔4,5〕。但miR-19-3p在口腔鳞癌中与TC-1的相互作用关系尚未清楚。本研究旨在探讨miR-19-3p对口腔鳞癌细胞增殖、凋亡、迁移、侵袭和凋亡的调控机制。
1 材料与方法
1.1材料 31例口腔鳞癌癌旁组织和39例口腔鳞癌组织均来自承德医学院附属医院2018年2~12月接受外科手术切除的病例。患者及家属均签署知情同意书。人口腔鳞癌细胞CAL27、Tca8113均购自美国菌种保藏中心;胎牛血清购自杭州四季青;DMEM培养基购自北京康为世纪;CCK-8试剂购自日本同仁;胰蛋白酶购自美国GIBCO公司;LipofectamineTM3000试剂购自Invitrogen公司;二喹啉甲酸(BCA)蛋白定量试剂盒购自;qRT-PCR试剂盒购自日本TaKaRa公司;Transwell小室购自美国Corning公司;聚偏氟乙烯(PVDF)膜购自德国罗氏诊断有限公司;Annexin V-FITC/PI凋亡检测试剂盒购自南京森贝伽公司;双荧光素酶报告实验试剂盒购自上海碧云天生物研究所。
1.2细胞培养 用RPMI1640完全培养基(10 %胎牛血清+1%双抗)培养人口腔鳞癌细胞CAL27、Tca8113,在37℃、5% CO2的恒温细胞培养箱中培养、传代。
1.3细胞分组 将miR-19-3p mimics、miR-NC、pcDNA、pcDNA-TC-1、miR-19-3p+pcDNA、miR-19-3p+pcDNA-TC-1与3倍量的脂质体混合均匀,再与CAL27细胞共培养8 h,添加新培养基继续培养48 h,用qRT-PCR检测转染效率。将其分别标记为miR-19-3p组、miR-NC组、pcDNA组、pcDNA-TC-1组、miR-19-3p+pcDNA组、miR-19-3p+pcDNA-TC-1组。用于后续的qRT-PCR、Western印迹实验、CCK-8、Transwell实验和流式细胞术实验。
1.4qRT-PCR实验 将需要检测的细胞或充分研磨的组织匀浆用RNA抽提试剂盒提取RNA、反转录试剂盒合成cDNA、qRT-PCR试剂盒进行miR-19-3p、LRIGl检测。用2-△△Ct计算miR-19-3p、LRIGl的表达。
1.5Western印迹实验检测细胞TC-1、细胞周期蛋白(Cyclin)D1、P21、Bax、Bcl-2、E-钙黏蛋白(cadherin)、基质金属蛋白酶(MMP)-2表达 将待检测细胞用裂解液在冰上裂解30 min,提取总蛋白,并进行定量、变性。蛋白电泳结束后用转膜仪将蛋白转移至PVDF膜,再用2.5%脱脂奶粉室温封闭处理2 h。加入稀释过的Ⅰ抗溶液(1∶500~2 000),4℃孵育12~14 h。加稀释过的Ⅱ抗(辣根过氧化物酶标记的二抗),37℃ 孵育2 h。最后用ECL加发光液进行显影曝光。
1.6CCK-8法检测细胞增殖 将需要检测的细胞调整至5×105个/ml,取100 μl至96孔板,加入CCK-8反应液,在490 nm波长下检测细胞吸光度(A)。
1.7Annexin V-FITC/PI双染检测细胞凋亡 将待检测的细胞用磷酸盐缓冲液(PBS)洗涤3次,再用 500 μl 结合缓冲液悬浮,按照 Annexin V-/FITC试剂盒要求操作,加入染色液,最后上流式细胞仪检测分析凋亡情况。总凋亡率(%)为早期凋亡率与晚期凋亡率之和。每个样品重复3次,实验重复2次。
1.8Transwell小室检测细胞迁移侵袭 将待检测细胞按106个/孔接种细胞6孔板,用不含血清培养基培养12 h。再将细胞调至105个/ml,取100 μl平铺在小室的上表面,600 μl含血清的培养基加入小室的下室,将小室在37℃反应12 h。取出小室,除去上室膜上的细胞,再用甲醇固定、结晶紫染色。然后再显微镜下观察细胞数量并计数,取平均值。
1.9双荧光素酶报告基因实验检测细胞荧光活性 根据mircode在线网站(http://www.mircode.org/)预测到的miR-19-3p与TC-1之间的结合位点,化学合成野生型TC-1基因序列(TC-1-WT)和突变型TC-1序列(TC-1-MUT),并将其克隆到荧光载体psiCHECK-2,建立荧光素酶报告基因质粒,提取质粒DNA。将其与miR-NC、miR-19-3p共转染。按双荧光素酶报告基因检测试剂盒技术手册要求操作。结果用海肾荧光素活性与萤火虫荧光活性的比值表达细胞的荧光活性。
1.10统计学分析 采用PEMS2.2软件进行统计分析,多组数据比较采用单因素方差分析及SNK-q检验,两组数据比较采用t检验。
2 结 果
2.1miR-19-3p在口腔鳞癌组织和癌旁组织中的表达 与癌旁组织(1.13±0.08)相比,口腔鳞癌组织中miR-19-3p表达(0.28±0.02)显著降低(t=63.995,P=0.000)。
2.2miR-19-3p过表达对口腔鳞癌细胞CAL27、Tca8113增殖的影响 与miR-NC组相比,miR-19-3p组CAL27、Tca8113细胞中miR-19-3p表达上调,CyclinD1蛋白表达下调,P21蛋白表达升高,24、48、72 h细胞活性降低,差异均有统计学意义(P<0.05)。见表1,图1。选用miR-19-3p过表达作用效果较明显的细胞CAL27做后续实验。
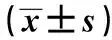
表1 miR-19-3过表达对细胞CAL27、Tca8113增殖的影响

图1 miR-19-3p过表达对增殖相关蛋白表达的影响
2.3miR-19-3p过表达对口腔鳞癌细胞CAL27凋亡的影响 与miR-NC组相比,miR-19-3p组CAL27细胞中miR-19-3p、Bax蛋白上调,Bcl-2蛋白下调,细胞凋亡率升高,差异均有统计学意义(P<0.05)。见图2,图3,表2。

图2 miR-19-3p过表达对口腔鳞癌细胞CAL27凋亡的影响

图3 miR-19-3p过表达对Bax、Bcl-2表达的影响

表2 miR-19-3过表达对细胞CAL27凋亡的影响
2.4miR-19-3p过表达对CAL27迁移侵袭的影响 与miR-NC组相比,miR-19-3p组CAL27细胞中E-cadherin蛋白表达显著升高,MMP-2蛋白表达显著降低,迁移细胞数和侵袭细胞数均显著降低(P<0.05)。见图4,图5,表3。

图4 miR-19-3p过表达对细胞CAL27迁移、侵袭的影响(结晶紫染色,×200)

图5 miR-19-3p过表达对E-cadherin、MMP-2表达的影响

表3 miR-19-3p过表达对细胞CAL27迁移、侵袭的影响
2.5miR-19-3p靶向调控TC-1 miRcode在线预测网站显示,miR-19-3p与TC-1之间存在互补的核苷酸序列(图6)。与miR-NC组(1.12±0.08、1.08±0.09)相比,miR-19-3p组WT-TC-1细胞的荧光活性(0.35±0.02)明显下调(t=22.872,P=0.000),MUT-TC-1(1.02±0.07)差异无统计学意义(t=1.289,P=0.226);与miR-NC组相比,miR-19-3p组细胞TC-1 mRNA和蛋白均显著下调,与anti-miR-NC组相比,anti-miR-19-3p组细胞TC-1 mRNA和蛋白均显著上调(P<0.05)。见表4。

图6 miR-19-3p靶向、调控TC-1

表4 miR-19-3p调控TC-1 mRNA、蛋白的表达
2.6过表达TC-1表达能逆转miR-19-3p过表达对口腔鳞癌细胞CAL27增殖、凋亡、迁移、侵袭的作用 与miR-NC组相比,miR-19-3p组CAL27细胞中TC-1、Bcl-2、MMP-2蛋白表达均显著降低,Bax、E-cadherin蛋白表达均显著升高,24、48、72 h细胞活性均显著下降,细胞凋亡率显著上升,细胞迁移数和侵袭数均显著下降(均P<0.05);与miR-19-3p +pcDNA3.1组相比,miR-19-3p +pcDNA3.1-TC-1组CAL27细胞TC-1、Bcl-2、MMP-2蛋白表达均显著上升,Bax、E-cadherin蛋白表达均显著下降,24、48、72 h细胞活性均显著上升,细胞凋亡率显著下降,细胞迁移数和侵袭数均显著上升(P<0.05)。见图7、表5。

图7 TC-1及凋亡、迁移蛋白的表达

表5 各组凋亡、侵袭蛋白表达及细胞活性、凋亡率、迁移、侵袭细胞数比较
3 讨 论
miRNA是一类单链内源性非编码小分子RNA,在肿瘤的发生、增殖和转移过程中起至关重要的作用〔6〕。miR-17-92簇是第一个被鉴定的致癌miRNA,也称为oncomir-1,其基因组扩增和高表达在各种类型的癌症中均有发现,而miR-19是miR-17-92簇的关键成员,对促进肿瘤发生具有重要作用〔7~9〕。据报道,miR-19在乳腺癌、结直肠癌、肺癌、甲状腺癌、前列腺癌等很多癌症中均出现异常表达〔10,11〕。Christopher等〔12〕在研究中通过生物信息学方法筛选口腔鳞癌中与炎症相关的miRNA发现,miRNA-19a/b在调控口腔鳞癌的炎症反应中具有显著影响,推测miRNA-19a/b的靶基因对口腔鳞癌诊断和靶向治疗有巨大潜力。本实验发现,miR-19-3p在口腔鳞癌组织中表达明显下调,这是国内外首次明确miR-19-3p在口腔鳞癌中的异常表达,为miR-19-3p在口腔鳞癌中的研究及开发奠定基础;进一步研究发现,过表达miR-19-3p抑制口腔鳞癌细胞的增殖、迁移和侵袭并促进其凋亡,这些结果均在研究miR-19-3p对口腔鳞癌的诊断和治疗中的潜在价值奠定基础,也为后续进行miR-19-3p在其他癌症中的功能及机制研究提供理论依据;深入研究发现,miR-19-3p可靶向负调控TC-1的表达,这说明miR-19-3p对口腔鳞癌细胞表型的调控功能与调控TC-1有关,为miR-19-3p的调控机制研究提供依据。
TC-1是在2000年由澳大利亚学者Chua等〔13〕在研究甲状腺癌中发现的一个新基因,后被命名为 C8orf4基因。近期,TC-1在肺癌、乳腺癌、结直肠癌、胃癌中均出现表达异常升高〔14~17〕。白琳琳等〔18〕报道,TC-1在舌鳞癌组织中的过度表达与舌鳞癌的低分化程度相关。Zhang等〔19〕研究发现,TC-1在舌鳞癌组织中的表达明显升高,且与晚期TNM分期显著相关,其作用与调控Wnt /β-连环蛋白信号通路密切相关,提示TC-1的高表达水平可能通过增强Wnt信号通路的活性来促进OTSCC的进展。本研究结果显示,TC-1表达可受miR-19-3p的抑制,且过表达TC-1也可逆转miR-19-3p的表达,这暗示TC-1在口腔鳞癌细胞中的表达上调,为TC-1在口腔鳞癌中的功能研究奠定基础;进一步研究发现,过表达TC-1还可逆转miR-19-3p对口腔鳞癌细胞增殖、凋亡、迁移和侵袭的影响及其相关蛋白表达的调控作用,这说明TC-1不仅可逆向调控miR-19-3p在口腔鳞癌细胞中的表达,还可逆转miR-19-3p对口腔鳞癌细胞的增殖、凋亡、迁移和侵袭的影响,为miR-19-3p在口腔鳞癌中的功能及机制研究提供依据。
综上,miR-19-3p在口腔鳞癌中低表达,过表达miR-19-3p可抑制口腔鳞癌细胞的增殖、迁移和侵袭,促进凋亡,其机制与靶向TC-1相关,为口腔鳞癌的靶向治疗提供新靶点。
