鹿茸蛋白提取物对帕金森模型秀丽隐杆线虫毒性作用与药理作用的研究
2020-08-27赵鑫陈思王毅刘洋孙娅楠何忠梅
赵鑫 陈思 王毅 刘洋 孙娅楠 何忠梅
帕金森病(Parkinson’s disease,PD)是继阿尔茨海默症之后的第二大神经退行性疾病,流行病学研究表明,在全世界范围内,PD患者在65岁以上人群中占1%~2%,在85岁以上人群中占4%~5%[1]。现代研究认为,PD发病部位在大脑黑质区多巴胺神经元丢失引起的体内多巴胺分泌量的降低,继而出现震颤、运动迟缓、肌肉僵直等一系列运动功能障碍。目前,临床上指导推荐药物多为左旋多巴为代表的复方多巴制剂及抗胆碱类药物[2]。但是多巴制剂仅能缓解发病,并不能从根本上治疗帕金森病。
中医认为,鹿茸性温,入肝、肾经。鹿茸是迄今为止唯一发现的哺乳动物可再生附属器官[3]。现代药理学研究表明,鹿茸有很强修复再生能力。鹿茸不仅能够促血管再生[4],还能促进表皮和成纤维细胞增殖及皮肤创伤愈合[5]。且大量研究表明,鹿茸对神经系统具有保护作用[6]。这为鹿茸用于治疗神经系统损伤性疾病提供了一定的理论依据。但现有的研究在肯定了鹿茸修复神经损伤作用的同时,并未对其毒性进行过系统研究[7]。本课题组前期得到一组可促进神经生长作用的鹿茸蛋白提取物。通过鹿茸蛋白提取物给药造模大鼠证实鹿茸蛋白提取物能够治疗大鼠帕金森病,并且研究发现鹿茸蛋白提取物中标记的蛋白成分可以透过血脑屏障[8]。而后给药损伤的SH-SY5Y细胞,发现鹿茸蛋白提取物可以保护神经细胞,促进神经细胞生长。本实验依赖于秀丽隐杆线虫(C.elegans)这一模式生物,从表型上观察到其对帕金森模型线虫A30P(以下简称A30P线虫)树突的修复作用,但是药物起药效作用的安全剂量范围尚需进一步研究。本实验在前期研究的基础上观察鹿茸蛋白提取物对A30P线虫生存率、生长发育、运动行为、树突恢复等方面的影响,探究鹿茸蛋白提取物的毒性及其药理学作用,筛选出最佳药效剂量范围。
1 材料与方法
1.1 实验药品
梅花鹿鹿茸(购自吉林云鹿集团),经中国中医科学院医学实验中心形态学实验室王毅研究员鉴定为梅花鹿(Cervusnippon)的鹿茸。
1.2 线虫品系
秀丽隐杆线虫A30P(Pdat-1::α-sny::GFP)、缺陷型大肠杆菌菌株(E.coli OP50),均由日本Tomoki Kuwahara博士惠赠。
1.3 实验试剂
琼脂(国药试剂)、细菌蛋白胨(Oxoid)、叠氮钠(Sigma)、5-氟尿嘧啶(Sigma)、BCA蛋白试剂盒(碧云天),其他所需化学试剂均购自国药集团化学试剂北京有限公司。
1.4 实验仪器
FD-1D-50冷冻干燥机(北京博医康实验仪器有限公司),R-215旋转蒸发仪(瑞士步琦有限公司),P1000D透析袋(索莱宝公司),85-2A磁力搅拌器(郑州恒岩仪器有限公司),恒温培养箱(Taisite公司),OSE-MC8离心机(Tiangen biotech公司),体视显微镜(Motic公司),MPE FV1000双光子显微镜(奥林巴斯公司)。
1.5 药材处理
新鲜鹿茸直接液氮速冻后置入超微粉碎机中,加适量水粉碎至肉糜状。取已经破碎的鹿茸糜状物,按照1∶10(W/V)的比例加入双蒸水,取适量冰醋酸调节pH=4,搅拌过夜后离心取上清并浓缩。将浓缩好的上清液放入透析袋透析脱盐,将除盐的鹿茸蛋白提取物溶液旋蒸并冻干保存。
1.6 蛋白含量测定
采用BCA试剂盒法检测所得鹿茸蛋白提取物中蛋白含量。按照BCA蛋白试剂盒说明书配置梯度蛋白标准品,并以50∶1的比例混合A液与B液。取各个稀释要求浓度的标准品和待测蛋白质样品25 μL加入到96孔板中,并且每个样品孔加入200 μL工作液振荡混匀。37℃孵育30分钟,在595 nm下测量OD值,并计算蛋白浓度。
1.7 蛋白分子量测定
分别配置10%分离胶和5%浓缩胶进行SDS-PAGE蛋白电泳。首先将鹿茸蛋白提取物干粉溶解配置成为1 mg/mL浓度蛋白溶液。按比例加入5×上样缓冲液后,50℃煮沸3分钟。上样体积分别为20 μL与10 μL。起始电压为80 V,待溴酚蓝指示剂进入分离胶时调整电压升高至120 V,溴酚蓝指示剂消失即停止电泳。然后用考马斯亮蓝染液摇床振荡染色45分钟后脱色过夜。完全脱色后观察鹿茸蛋白及标准蛋白条带分布并进行对比。
1.8 样品制备
取适量冻干的鹿茸蛋白提取物干粉,加入M9缓冲液完全溶解后,用0.22 μm微孔滤膜过滤除菌,4℃保存备用。待使用时按浓度要求稀释。
1.9 线虫培养与线虫同步化
将OP 50大肠杆菌均匀涂抹在NGM琼脂板上,37℃培养过夜。每隔2天转移线虫到新的含菌NGM琼脂板上,20℃培养箱恒温培养[9]。用M9轻轻从NGM板上洗下产卵期A30P线虫,收集在1.5 mL离心管中。静置后4000 g离心1分钟后弃上清液,加入适量M9,反复清洗3次。加入1 mL线虫裂解液,振荡混匀1分钟,离心去上清。加入M9反复清洗3~5次后加入空白NGM板中孵育过夜,即得到同步化L1期A30P线虫。
1.10 生长发育实验
将同步化后L1期的A30P线虫加入到混有不同浓度鹿茸蛋白提取液与OP50大肠杆菌的NGM板上。培养线虫48小时后,用MOTIC体视显微镜拍照并计算线虫体长。每组统计10条线虫。
1.11 生殖实验
将同步化的L1期A30P线虫加入到混有不同浓度鹿茸蛋白提取液与OP50大肠杆菌的NGM板上。培养线虫48小时到达怀孕期后,转移线虫至新的不含药的NGM板中。每板1条线虫,每组10板。待24小时后,移出孕虫。计数每板子代卵的数量。
1.12 生存率实验
将同步化的L4期A30P线虫加入不同浓度的鹿茸蛋白提取液中,置于96孔板,每孔约20条线虫。置于20℃培养箱培养24小时,在显微镜下计数各组线虫存活个数。线虫死亡标准:身体僵直,铂丝轻触头部无反应。
1.13 身体弯曲频率实验
将同步化后培养至L4期的A30P线虫加入到混有不同浓度鹿茸蛋白提取液与OP50大肠杆菌的含有5-氟尿嘧啶的NGM板上。培养线虫3天后,转移线虫至新的不含药的NGM板中恢复1分钟。显微镜下观察录制线虫30秒内身体弯曲次数,身体呈Ω型记为一次弯曲次数。每组统计10只线虫。
1.14 神经恢复实验
将同步化后培养至L4期的A30P线虫加入到混有不同浓度鹿茸蛋白提取液与OP50大肠杆菌的含有五氟尿嘧啶的NGM板上。培养线虫3天后,将线虫用2 mM叠氮麻醉后转移至含有2%琼脂垫的载玻片上,盖上载玻片,双光子显微镜下观察拍照。每一条点状树突记为1分,每一条线状树突记为2分,计算每一只线虫树突得分(注:恢复1条点状树突、2条线状树突,树突得分即为5)。统计各组线虫树突评分,每组统计10条线虫。
1.15 统计学处理
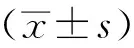
2 结果
2.1 鹿茸蛋白提取物中蛋白含量与分子量分析
BCA试剂盒法测得蛋白线性回归方程y=2.8419x-0.2857R2=0.9962,计算得出鹿茸蛋白提取物中蛋白含量为76%。从SDS-PAGE蛋白电泳图可以得出鹿茸蛋白广泛分布于55~250 kD之间,多为大分子蛋白。着重分布于130 kD附近,以及70~55 kD之间。见图1。
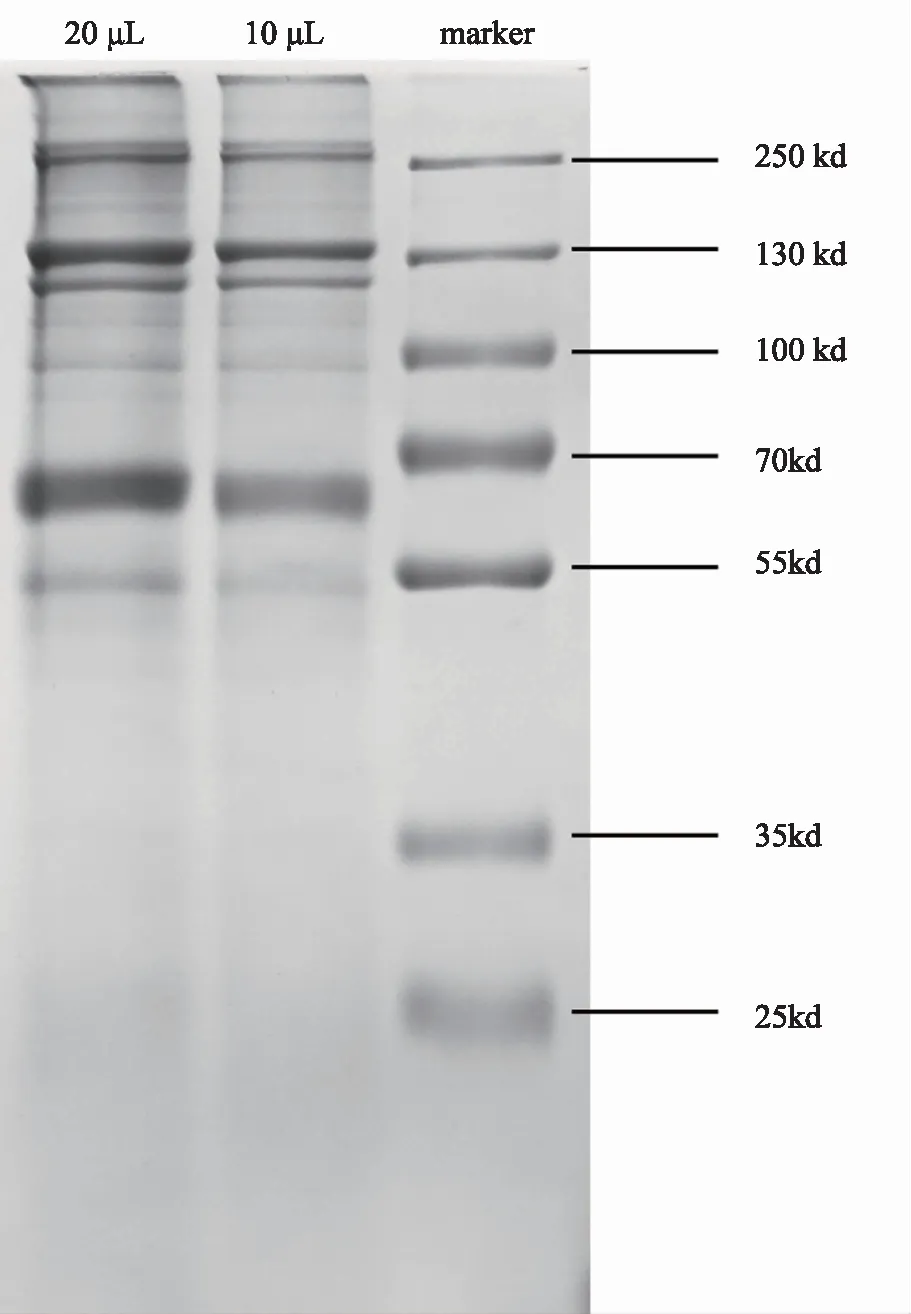
图1 鹿茸蛋白提取物SDS-PAGE蛋白电泳图
2.2 不同浓度鹿茸蛋白提取物对A30P线虫生长发育的影响
0、0.125、0.25、0.5、1、2、4、8 mg/mL鹿茸蛋白提取物培养A30P线虫48小时后,A30P线虫体长如表1所示。与0 mg/mL浓度相比,各浓度给药组体长并无统计学差异(P>0.05)。
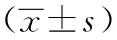
表1 不同浓度鹿茸蛋白提取物对A30P线虫体长的影响
2.3 不同浓度鹿茸蛋白提取物对A30P线虫生殖能力的影响
0、0.125、0.25、0.5、1、2、4、8 mg/mL鹿茸蛋白提取物培养A30P线虫至孕期后,A30P线虫24小时内排卵量如表2所示。与0 mg/mL浓度相比,当给药浓度达到8 mg/mL时,A30P线虫产卵量降低(P<0.05),4 mg/mL药物浓度时有明显的下降趋势但无统计学差异(P>0.05),2 mg/mL以下浓度组线虫排卵量并无明显差异(P>0.05)。
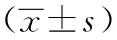
表2 不同浓度鹿茸蛋白提取物对A30P线虫生殖能力的影响
2.4 不同浓度鹿茸蛋白提取物对A30P线虫生存率的影响
0、0.125、0.25、0.5、1、2、4、8 mg/mL鹿茸蛋白提取物暴露A30P线虫24小时后,A30P线虫存活率如表3所示。与0 mg/mL浓度相比,4 mg/mL对线虫存活率有下降趋势但无统计学差异,2 mg/mL及以下浓度对A30P线虫的生存没有影响。但是当浓度为8 mg/mL暴露时,A30P线虫的生存率显著降低(P<0.05)。
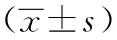
表3 不同浓度鹿茸蛋白提取物对A30P线虫生存率的影响
2.5 不同浓度鹿茸蛋白提取物对A30P线虫运动的影响
0、0.125、0.25、0.5、1、2、4、8 mg/mL鹿茸蛋白提取物培养L4期线虫3天后,A30P线虫运动及身体弯曲频率如表4所示。图2a为0 mg/mL浓度A30P线虫连续6秒内运动,线虫身体呈现半圆形转动。图2b为给药2 mg/mL组A30P线虫连续6秒内运动,线虫身体Ω型爬行。与0 mg/mL浓度相比,1、2 mg/mL以及4 mg/mL浓度对线虫身体弯曲频率明显增加,且有统计学显著差异(P<0.01),4 mg/mL与其他两组比较有明显差异(P<0.01)。
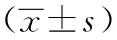
表4 不同浓度鹿茸蛋白提取物对A30P线虫身体弯曲频率的影响
2.6 不同浓度鹿茸蛋白提取物对A30P线虫神经恢复的影响
0、0.125、0.25、0.5、1、2、4、8 mg/mL鹿茸蛋白提取物培养L4期A30P线虫3天后,A30P线虫树突恢复情况如图3所示。A为0 mg/mL浓度,A30P线虫树突退化,其余给药组树突有不同程度恢复。B、C几乎没有树突恢复,D分别恢复一条线状树突与点状树突,E清晰可见恢复一条线状树突与一条点状树突,F、G分别恢复两条与三条线状树突,H恢复一条点状树突。与0 mg/mL浓度相比,0.25 mg/mL以上浓度能显著恢复A30P线虫树突比率,0.25、0.5、1、2、4、8 mg/mL恢复比率依次升高(P<0.01)。见表5。
2、4、8 mg/mL相比于0.25 mg/mL浓度明显升高,差异有统计学意义(P<0.01)。1 mg/mL及以上浓度对A30P线虫树突恢复评分有明显增长趋势,差异有统计学意义(P<0.05)。见表6。

表5 不同浓度鹿茸蛋白提取物对A30P线虫的树突恢复比率的影响
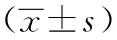
表6 不同浓度鹿茸蛋白提取物对A30P线虫的树突计分的影响
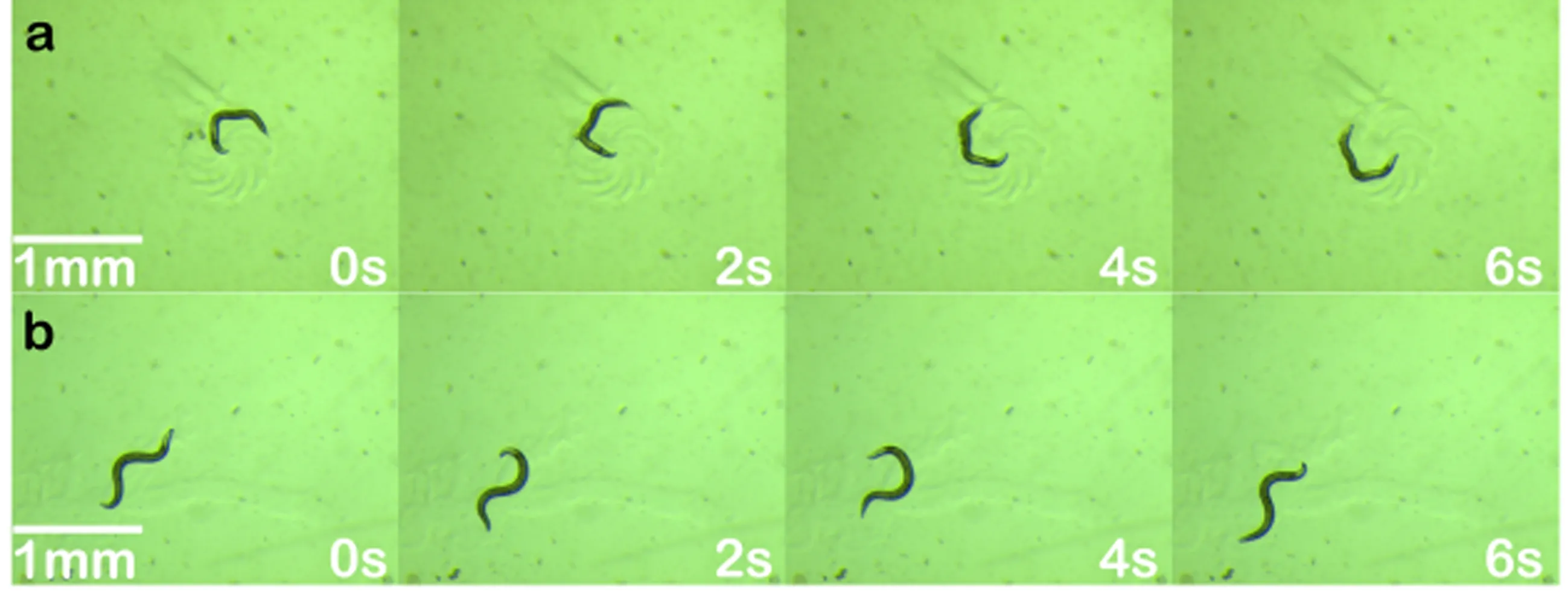
注:图为12倍镜显微镜下的A30P线虫;a为0 mg/mL浓度组,b为给药2 mg/mL浓度组。

注:图为25倍双光子显微镜下拍摄A30P线虫荧光图片;A~H给药浓度依次为0、0.125、0.25、0.5、1、2、4、8 mg/mL。
3 讨论
秀丽隐杆线虫在由英国Brenner[10]提出并作为一种新的模式生物,广泛应用在分子生物学和发育生物学等研究领域。随后Sulston[11]绘制完成了线虫细胞谱系图,使得线虫成为了唯一一种体内细胞均能被追踪的模式生物。秀丽隐杆线虫体型小、体长仅1 mm。身体透明,在普通光学显微镜下均能追踪观察。生命周期短暂却完整,在20℃条件下,秀丽隐杆线虫的平均寿命为2~3周,而产生下一代仅需要四天左右。以上诸多优势使秀丽隐杆线虫成为了当今生命科学和医学领域研究中最重要的模式生物之一。目前,科学家建立了大量的秀丽隐杆线虫疾病模型和成熟的方法来模拟人类疾病,如糖尿病模型、肥胖模型、衰老模型、帕金森模型、阿尔茨海默症模型等[12-13]。
就帕金森病模型而言,通常采用MPP+[14]或鱼藤酮[15]诱导秀丽隐杆线虫神经元损伤的方法仅仅模拟外部环境因素对机体造成的损伤。而帕金森病模型线虫A30P模拟了人体遗传因素导致的帕金森病。本实验研究采用的帕金森模型线虫A30P转入了人的α-突触核蛋白,在8个多巴胺神经元中可以检测到Pdat-1::EGFP荧光(头部6个,即CEP和ADE神经元,后部区域有2个,即分别是PDE神经元)以及多巴胺神经元的前后神经突。并且线虫CEP树突的EYFP标记随着生长发育持续减少,3日龄A30P线虫表达EYFP减少90%[16]。符合人类帕金森发病机理,神经元不断退化缺失,并且线虫行为表现为运动障碍,不能正常爬行前进。故以A30P线虫作为帕金森病模型研究鹿茸蛋白提取物的毒性作用与药理作用。
对于鹿茸蛋白提取物毒性实验采用三个指标,生存率、体长以及产卵率。生存率是研究药物毒性最直观的评价指标;体长及体宽反映线虫生长发育情况;后代数反映出药物对线虫生殖能力的影响;不同浓度鹿茸蛋白提取物暴露A30P线虫后,8 mg/mL鹿茸蛋白提取物降低了A30P线虫的存活率(P<0.05),且抑制A30P线虫产卵(P<0.05)。4 mg/mL鹿茸蛋白提取物有降低A30P线虫的存活率及抑制A30P线虫产卵的趋势,但无统计学差异。培养线虫48小时后,对线虫体长的影响差异无统计学意义。根据毒性实验结果推测这一现象与药物渗透压有关。鹿茸蛋白提取物多部分为55 kD以上大分子蛋白质,蛋白含量为76%。并且随着浓度的增加,渗透压也随之升高(结果未在本实验显示)。线虫结构简单,皮下组织及肠道共同调节线虫体内渗透压平衡。并且由排泄细胞、导管细胞和孔细胞代替人体“肾”的功能[17]。一旦渗透压平衡被打破,线虫的生理结构功能则会出现异常,甚至吸水胀破而导致死亡。
对于药理实验采用两个指标:评价树突恢复以及评价运动能力。线虫的运动行为能反映其神经系统基本功能,常用线虫的身体弯曲频率作为其运动行为的评价指标。结果表示,1、2 mg/mL以及4 mg/mL浓度对线虫身体弯曲频率明显增加,且有显著统计学差异(P<0.01),4 mg/mL与其他两组比较有明显差异(P<0.01)。0.25 mg/mL及以上浓度能够提高线虫树突恢复比例,1 mg/mL及以上浓度对A30P线虫树突恢复评分有明显增长趋势。2、4、8 mg/mL对A30P线虫树突有明显恢复作用。说明鹿茸蛋白提取物能够保护A30P线虫神经元的退化缺失,恢复A30P线虫运动能力,从而达到治疗A30P线虫帕金森病的目的。综合毒性实验结果及药理实验结果,1、2 mg/mL以及4 mg/mL鹿茸蛋白提取物为安全有效剂量。
本实验以帕金森模型线虫为研究对象,探究了不同浓度鹿茸蛋白提取物对线虫的毒性作用与药理作用,以确定鹿茸蛋白提取物最佳给药浓度,为后续鹿茸蛋白提取物治疗帕金森病提供研究依据。
