基于培养池阵列微流控芯片的单线虫并行分离条件考察
2020-12-14钟润涛杨倩倩刘清清邱怡华李沛然王梦雨孙野青
钟润涛,杨倩倩,刘 琦,张 普,刘清清,邱怡华,彭 威,李沛然,王梦雨,王 巍,孙野青
(大连海事大学 环境系统生物学研究所,辽宁大连 116026)
秀丽隐杆线虫(Caenorhabditiselegans),是重要的模式生物,是一种微小的多细胞无脊椎[1]、无毒无害、可以独立生存的小型土壤动物,其主要特点包括:易于培养[2]、雌雄同体、较快的繁殖时间(约3d,20℃)和较短的寿命(约两周,20℃)[3]、较小的身体尺寸(成虫体长约1mm长,体宽约50μm)[1]、通身透明,神经系统简单、基因组测序已完成[4]、遗传背景清楚等。
常规线虫研究方法,往往需要每天将线虫转移到新的培养基上,以和后代区分[5-6],操作繁琐、费时费力、通量低,同时难以对单个线虫实现精确的刺激传递、操控和追踪,无法获得单线虫的分析检测数据,在一定程度上影响了结果的准确性和研究深度。单线虫水平的研究充分考虑了线虫的个体差异,可以获得更丰富、更准确的信息,从而避免群体研究时平均值所带来的偏差。单线虫的分离和操控对于单线虫的研究有很重要的意义,但传统研究手段难以实现对一定数量单线虫的精确控制,且现有方法可能会对线虫生理产生影响[7]。
微流控芯片,又叫芯片实验室(Lab-on-a-Chip),是一种以在微米尺度空间对流体操控为主要特征的技术,可以实现常规化学或生物实验室的各种功能[1]。微流控技术的特点使其在生物医学研究方面实现了微型化、自动化、高时效性、高通量及大规模检测等诸多优势[5]。随着微流控技术的发展,微流控芯片系统已成为模式生物线虫,特别是秀丽隐杆线虫这种微小生命体研究的强大工具[8-10]。
本研究基于微流体控制技术,设计了培养池阵列微流控芯片,同时提出一种单线虫并行分离的方法,通过考察液体培养时的线虫密度、线虫体宽及其分布等影响因素,分析在芯片上进行线虫进样和单线虫并行分离的条件。通过改变无菌液体培养时的线虫密度,得到不同尺寸的线虫样品,比较其对芯片线虫分离的效果,进一步验证线虫样品的尺寸对单线虫并行分离的影响。本试验结果将为后续进一步优化单线虫分离条件提供基础数据,并为构建自动化单线虫并行培养和长期观测微流控分析系统奠定技术基础。
1 材料与方法
1.1 材料与试剂
秀丽隐杆线虫株系为野生型线虫(N2),购于美国NIH Nation Center for Research Resources(NCRR)资助的线虫保种中心(CGC, Caenorhabditis Genetics Center, University of Minnesota, Minneapolis, MN)。
线虫液体培养基CeMM(C.elegansMaintenance Medium)按文献中的方法配制而成[11],主要包括水溶性部分、TEA可溶性部分、氨基酸、核酸取代物(Thymine等)、其他生长因子及能量(D-glucose)。
1.2 线虫培养与同步化
用蒸馏水将配好的培养基调整至合适的最终体积,并充分混合,使用0.2 μm醋酸纤维素过滤器过滤。
线虫扩繁:取1 mL在CeMM中培养的线虫溶液,加入10 mL 的CeMM液体培养基,常规培养7 d后,进行线虫同步化。
线虫同步化:取3.5 mL线虫溶液,加入0.5 mL NaOH和NaClO裂解液,处理约5.5 min,期间注意观察溶液的状态,至线虫溶液变微黄,且肉眼看不到明显的线虫残片。同步化后,用移液枪取部分线虫卵溶液至载玻片上,在显微镜下观察同步化后的线虫卵是否完整。
1.3 微流控芯片的设计与加工
1.3.1 微流控芯片结构 用于线虫分析的培养池阵列微流控芯片结构见图1,从左至右依次包括并行排列的3个进样通道和入口、进样储液池、若干条线虫分析通道组成的阵列(本试验采用含8条线虫分析通道的结构)以及出口处的储液池和出口。多条线虫分析通道并行排布,分析通道的两端分别与进样储液池和出口储液池相连,各分析通道之间互不干扰,可在压力作用下进行多条单线虫的并行控制;每条线虫分析通道由进样端的锥形线虫捕获结构、椭圆形的培养池以及出口端的细通道连接结构组成,具体尺寸见图1。培养池两端的线虫捕获结构和细通道连接结构的最小宽度由线虫样品的尺寸决定,可满足早期成虫样品(体宽大于35 μm)的控制要求,实现线虫分离及单线虫控制,从而可进行线虫样品的长期培养及观测分析。微流控芯片通道深度约50 μm,可用于线虫控制;培养池深度约250 μm,可用于线虫长期培养及正常活动,也可满足线虫样品视频监测的需求。
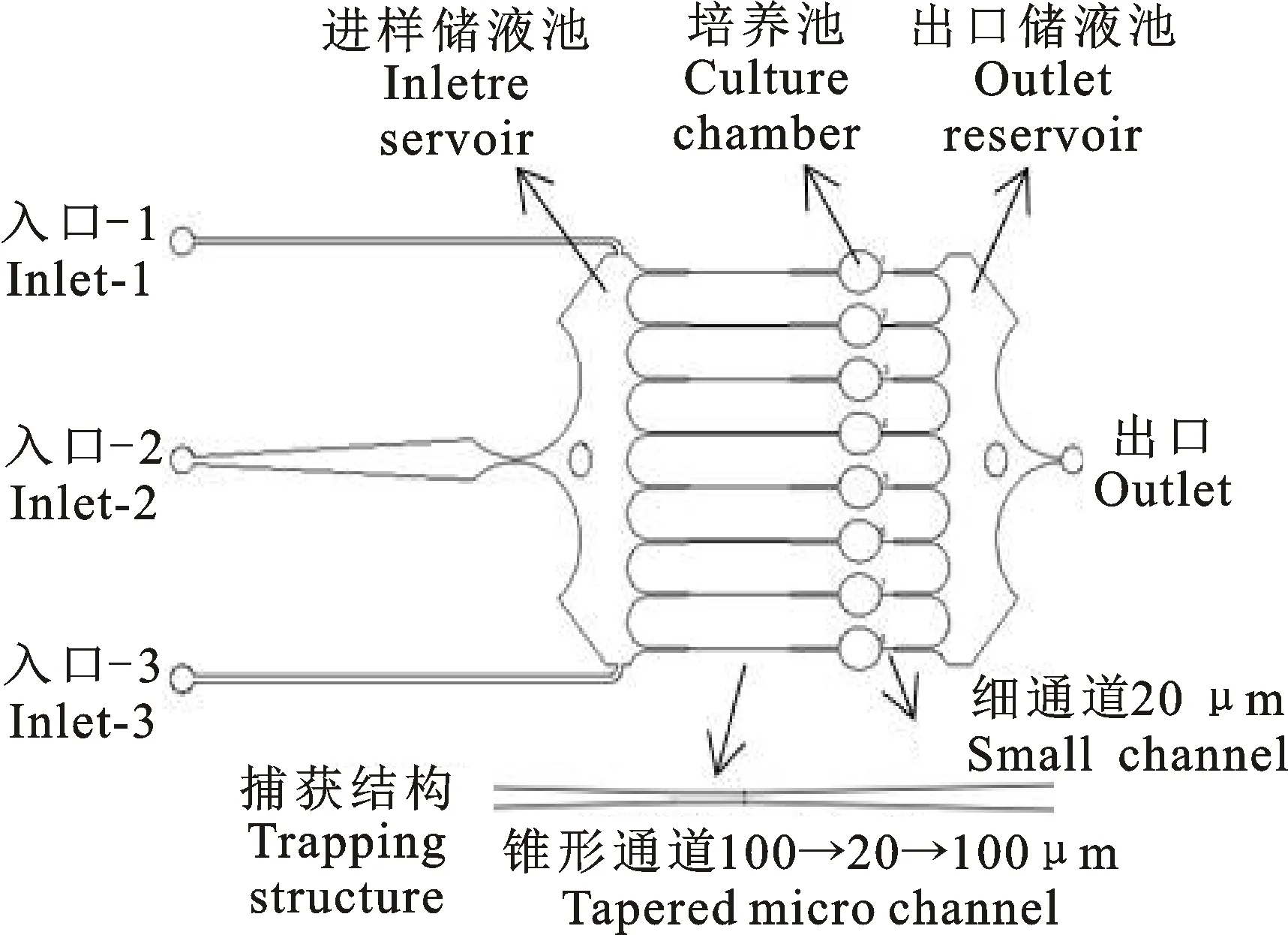
图1 培养池阵列微流控芯片结构示意图Fig.1 Schematic diagram of microfluidic chip with an array of culture chambers
1.3.2 微流控芯片加工 所用的微流控芯片采用软光刻法制备[12-15],芯片模板为UV光刻法加工的SU-8阳模。PDMS(聚二甲基硅氧烷)芯片采用浇注法制作,单体和固化剂的比例为10∶1,经混匀、脱气、固化(60 ℃×3 h)、脱模和切割、打孔后,将PDMS芯片和预先切割的PMMA(聚甲基丙烯酸甲酯)空白底板封接[16]。试验前,先用10% 的F-127溶液润湿整个PDMS/PMMA芯片的通道及培养池,静置5~10 min后用无菌水将芯片通道清洗干净,55 ℃烘干,再放置于真空干燥器中抽真空1 h。使用时,将芯片从真空干燥器中取出,吸取适量CeMM培养液浸润整个芯片通道,无明显气泡即可。
1.4 微流控芯片线虫分离试验方法
使用3个注射泵(TJ-2A/ L0107-2A,保定兰格恒流泵有限公司)和聚四氟乙烯(PTFE)塑料管,进行微流控芯片上的流体控制(图2),可准确设定流速和体积等参数。
线虫经同步化处理后,在CeMM液体培养基中培养6~7 d,在显微镜下观察并测量部分线虫的体宽。当测量的线虫样品大部分(>70%)体宽超过35 μm时,取线虫悬浮液,清洗掉杂质后,调整线虫密度约为2000~3 000条/mL,备用。
用含有CeMM培养液的注射器-2和PTFE管抽取10 μL线虫溶液(约含有线虫20~30条),并将该PTFE管插入微流控芯片的入口-2,同时将注射器-1和注射器-3分别接至入口-1和入口-3,随后按如下流程进行线虫分离试验:
线虫加样与捕获:关闭注射泵-1和注射泵-3,开启注射泵-2,并以150 μL/h的流速推动线虫样品进入进样储液池,约3~5 min后,部分线虫被捕获至锥形结构的细通道处。
清除多余线虫:断开注射泵- 2与入口-2的连接管,同时开启注射泵-1和注射泵-3(流速均为300 μL/h)3~5 min,将进样储液池中多余的线虫从入口-2处清除,并将注射泵-2连接管内可能残留的线虫排除。
线虫进样与分离:将注射泵-1和注射泵-3的流速调为50 μL/h,同时将注射泵-2与入口-2连接并开启注射泵-2,采用快推模式将捕获结构处的线虫迅速冲入培养池中,实现线虫的分离。
每一步操作结束后,在显微镜下观察并记录结果。试验完成后,将微流控芯片中的液体抽吸干净,随后用无水乙醇和无菌水清洗通道,放入55 ℃烘箱烘干,备用。
1.5 数据处理
数据以“平均数±标准差”表示,采用t检验分析,P<0.05代表有显著性差异,P<0.01代表有极显著差异。
2 结果与分析
前期研究初步考察了基于微流控芯片的线虫进样和分离的基本条件,包括各个步骤的流速、时间和注射泵的状态等(详见试验方法部分),发现线虫样品的体宽及其分布对微流控芯片上线虫的分离效果有显著影响[14, 17-19]。本试验主要从影响线虫体宽及其分布的无菌液体培养条件,即液体培养时的线虫密度方面,来考察其对线虫尺寸和芯片上线虫分离效果的影响。
2.1 不同密度下培养对线虫体宽的影响
在CeMM液体培养基中驯化的线虫样品,经同步化处理后,分别采用较高密度(约700 条/mL)和较低密度(约300条/mL)进行无菌液体培养,并定期观测其尺寸变化。培养6~7 d后,统计线虫平均体宽,结果如图3所示。由图3可知,在较高密度下进行线虫无菌液体培养时,得到的线虫样品体宽偏小,且尺寸分布较分散(35.5 μm±5.2 μm)。当降低线虫培养的密度时,得到的线虫样品体宽较大,尺寸分布较均匀 (40.0 μm±1.8 μm),与高密度下培养的线虫尺寸之间存在显著性差异,表明密度对线虫的体宽有明显影响。
2.2 不同密度下培养的线虫对芯片上线虫分离的影响
分别采用高密度和低密度下培养的线虫样品,将其稀释至合适的密度后,每次取20~30条线虫进行芯片上的分离试验,每种样品重复3次。试验过程中,分别记录加样与捕获阶段和清除多余线虫阶段每个捕获通道处的线虫数,以及进样与分离阶段每个培养池中的线虫数,并采集相应图像(图4)。
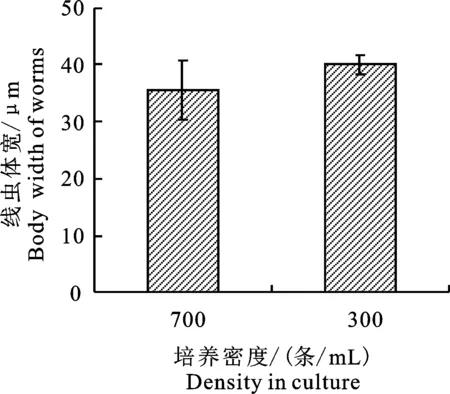
图3 不同培养密度下线虫体宽分布结果Fig.3 Distribution of nematode body width under different culturing densities
图5为高密度与低密度下培养的线虫样品在芯片上分离的结果。经统计可知,采用两种不同的样品时,在加样与捕获阶段,含有线虫的捕获通道的数量分别为6.3±0.6和8±0,且两种样品间存在显著性差异;在清除多余线虫阶段,含有线虫的捕获通道的数量分别为5±1和7.3±1.2,统计分析显示两种样品间不存在显著性差异;在进样与分离阶段,含有线虫的培养池的数量分别为4.3±0.6和6.7±0.6,且两种样品间存在极显著性差异,表明线虫体宽及其分布对芯片上的线虫分离有明显影响,具体分析如下。
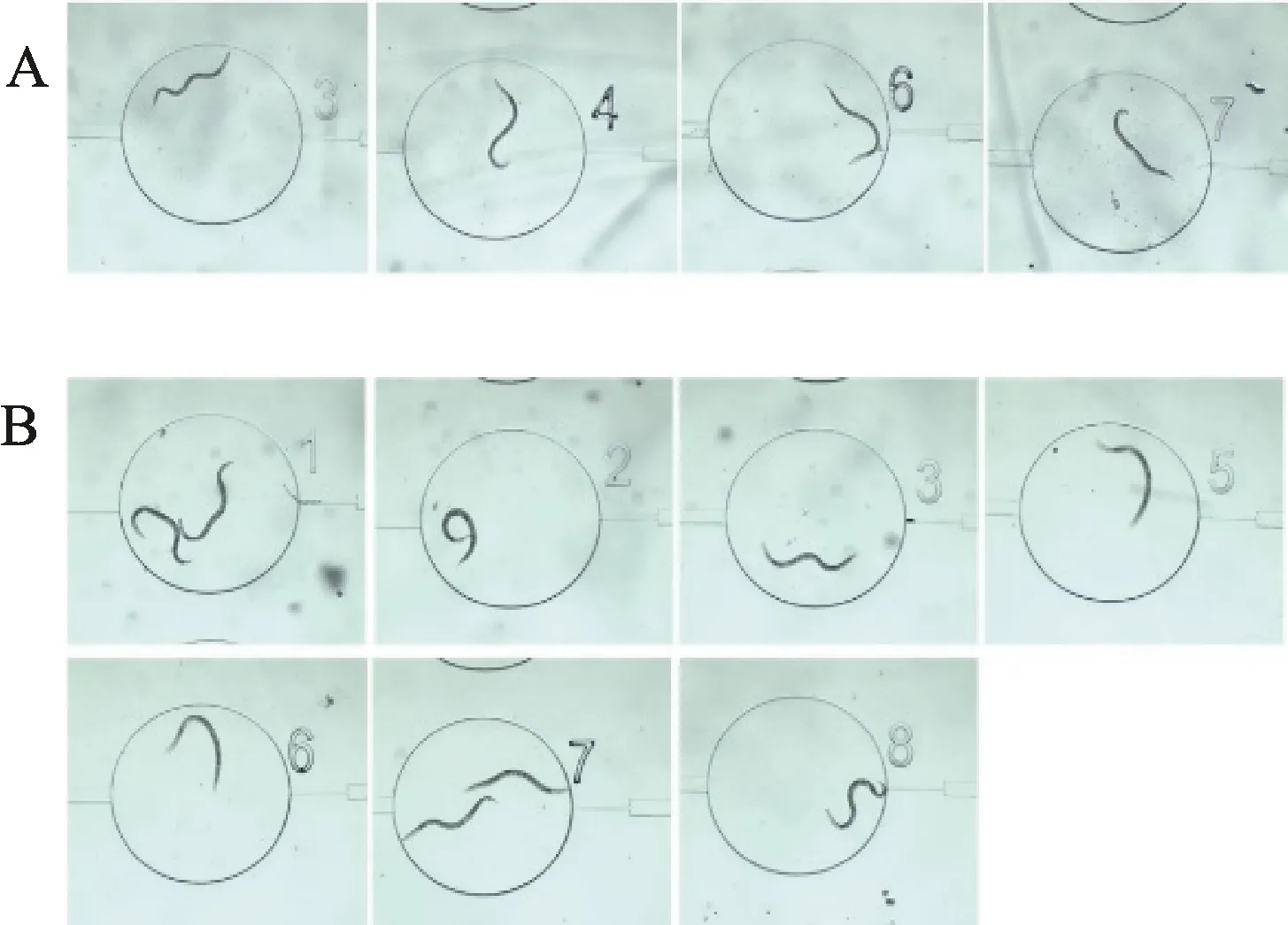
A.较高密度下培养的线虫样品;B.较低密度下培养的线虫样品
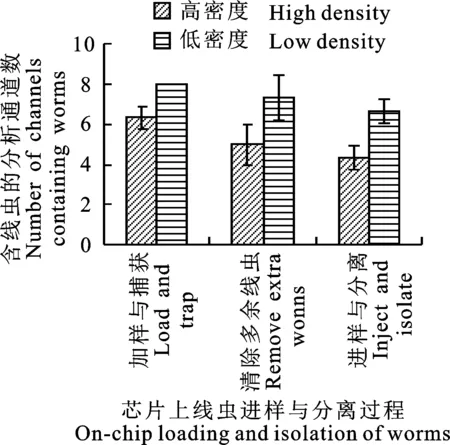
图5 不同密度下培养的线虫进行芯片上分离的统计结果Fig.5 Experimental results for microfluidic chip-based isolation of C.elegans cultured with different densities
2.2.1 高密度 在高密度下培养的线虫样品在加样与捕获阶段,有1~2个捕获通道处不含线虫,且不含线虫的捕获通道在芯片上的位置呈随机分布,其余捕获通道均含有单条线虫;在清除多余线虫阶段,有2~4个捕获通道处不含线虫,且上一阶段捕获的线虫易发生丢失;在进样与分离阶段,有3~4个培养池中不含线虫,部分线虫进一步丢失。
在加样与捕获阶段,线虫样品溶液以较低流速(150 μL/h)进入芯片进样储液池中,因线虫体宽差别较大,线虫随液流分布在芯片的不同位置,部分较小的线虫先进入捕获通道,随后直接进入培养池;较大的线虫被捕获到锥形结构的细通道处,导致该通道的流动阻力增大,从而影响后续线虫进入。线虫捕获过程结束后,改变3个注射泵的状态,同时以较大流速(300 μL/h)将进样储液池中剩余的线虫全部清除,此时,少数被捕获的线虫因体型较小而被流体带入进样储液池,最后被一起清除。当进样储液池中无残留线虫后,再次改变注射泵的状态,采用注射泵快推模式 (~1 s),将通道中捕获的线虫迅速冲入培养池,减少因线虫尺寸不一致而导致的运动不同步情况,尺寸较小的线虫则可被冲出培养池,进入出口端的储液池。
以上结果初步验证了采用含有培养池阵列的微流控芯片进行单线虫并行分离的可行性(含有单线虫的培养池数量占所有培养池的比例约 54.2%),同时也表明,线虫并行分离过程受线虫体宽及其分布的影响较大,需进一步验证和考察。
2.2.2 低密度 在低密度下培养的线虫样品在加样与捕获阶段,所有捕获通道处均含有线虫,其中1~2个通道含有两条线虫,且通道位置呈随机分布,其他通道均含有单条线虫;在清除多余线虫阶段,仅有个别位置发生线虫丢失现象,大部分线虫仍保持被捕获状态;在进样与分离阶段,出现少数线虫丢失情况。在各步试验操作过程中,因线虫体宽分布较均匀,明显改善了线虫运动的同步性,从而提高芯片上线虫并行分离的效果(含有线虫和单线虫的培养池数量占所有培养池的比例分别为 83.3%和66.7%)。同时,因线虫体宽较大,易被捕获且不易被冲出培养池,当个别通道进入两条线虫时,这两条线虫均可进入培养池并被保留,导致部分培养池最终含有两条线虫(图6)。进一步改进线虫加样与捕获条件(线虫尺寸、数量,注射泵开关状态、流速、时间等),有望降低同一通道捕获两条线虫的比例。为进一步减少被捕获线虫的丢失,可详细考察影响线虫清除和进样的因素,并优化试验条件。
3 讨论与展望
已有的线虫在植物和农业方面的研究,如线虫对植物生长的影响[20]、园艺线虫防治[21]等,多数是基于线虫群体水平的研究,而常规方法较难实现单线虫遗传发育的纵向研究,在一定程度上影响了结果的准确性和研究深度。单线虫水平的研究充分考虑了线虫的个体差异,可以获得更丰富、更准确的信息,从而避免群体研究时平均值所带来的偏差。单线虫的分离和操控对于单线虫的研究有很重要的意义。Hulme等[14]设计一种研究线虫寿命的多通道微流控芯片,成功实现线虫个体发育连续观察20 d。但该方法需要手动加样、每次加入单条线虫,芯片结构和操作过程复杂,难以实现单线虫自动化并行控制。Kopito等[18]利用微流控芯片记录单线虫的产卵数等指标,但过程中线虫活动受到限制,无法长期正常生长。Gokce等[22]设计的芯片可以实现单线虫的固定并进行显微操作,但线虫释放后会造成混合培养,无法实现单线虫的精确追踪。Mondal等[19]设计的芯片可以实现大规模单线虫分离和高分辨率成像,但难以实现单线虫长期培养和观测。Atakan等[23]设计的微流控芯片可以实现8种不同种类单线虫分离,但难以实现单线虫长期追踪,同时线虫进样、分离、培养过程需要人为控制和操作。综上所述,虽然基于微流控技术的单线虫分析已有相关报道,但现有芯片结构大多不含有单线虫培养池,难以实现单线虫的长期培养和追踪,且操作繁琐、不确定性高、自动化程度低,降低了研究结果的精确性和准确度,极大限制了单线虫研究的广度和深度。
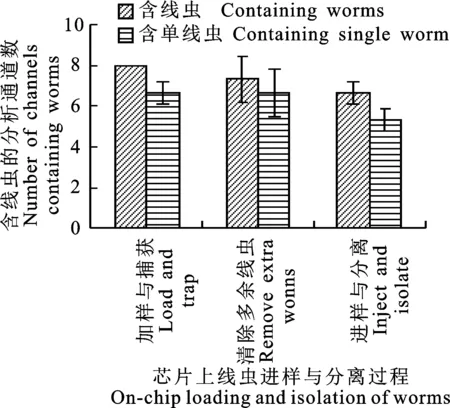
图6 较低密度下培养的线虫进行芯片分离的结果Fig.6 Experimental results for microfluidic chip-based isolation of C.elegans cultured with low density
为解决上述问题,本研究设计培养池阵列微流控芯片,其中包含8个并行排列的线虫分析通道,同时提出单线虫并行分离的方法,并考察线虫体宽及其分布对芯片上单线虫并行分离的影响。通过改变无菌液体培养时的线虫密度,发现低密度下(约300条/mL)得到的线虫样品,其体宽较大且分布均匀性较好(40.0 μm±1.8 μm),这可能是因为线虫生存环境的优化,改善线虫生长的一致性;同时,该线虫样品在芯片上各步操作过程中运动的同步性明显改善,提高芯片上线虫捕获和并行分离的效果(含有线虫和单线虫的培养池所占比例分别为83.3%和66.7%)。
本试验为解决单线虫的并行分离和控制等问题提供一种可行的方案。进入培养池中的单线虫可通过定期更换培养液而实现长期培养和观测,以获取不同线虫生长周期更丰富、更完整的单线虫研究结果。单线虫并行分离和控制方法,可同时获得更多单线虫的信息,使单线虫研究结果具有生物学统计意义。
本试验提出的单线虫分析通道阵列可扩展至更大数量,并可通过对流体的程序控制实现自动化操作,将为基于微流控芯片的单线虫长期培养、精准刺激、可逆捕获及荧光成像观测等提供便利,同时可为微生物源和植物源农药筛选及植物线虫防治等工作提供技术支持[24]。
