N-乙酰半胱氨酸对PM2.5诱导肥大细胞活化作用的影响
2020-08-25林志鹏李锦濯曾倩雯黄显琼孙仁山
林志鹏 李锦濯 曾倩雯 黄显琼 孙仁山
陆军军医大学大坪医院皮肤科,重庆,400042
城市大气细颗粒物(fine particulate matter,PM2.5)主要来源于机动车尾气排放和工业生产等,其粒径≤2.5 μm,可长期悬浮于空气中,成分中富集的有机碳、无机碳、金属无机盐及多环芳烃等可引起一系列呼吸和心血管系统疾病,严重威胁人类健康[1]。近年发现,PM2.5能导致过敏性疾病如哮喘[2]、荨麻疹[3,4]等发病增加。大气PM2.5浓度每增高10 μg/m3,过敏性皮肤病如湿疹、特应性皮炎(AD)的发生危险增加0.52%[5]。肥大细胞(mast cell)是速发型超敏反应的核心[6],外界过敏原如尘螨、颗粒物等可以激活肥大细胞表面的蛋白酶激活受体2(proteinase-activated receptor-2,PAR2)引起过敏炎症,促进组胺、胰蛋白酶和白细胞介素4(IL-4)等分泌[7,8]。实验发现PM2.5可以刺激肥大细胞(LAD2)脱颗粒释放组胺并生成活性氧(ROS),引起细胞损伤和氧化应激反应[9]。N-乙酰半胱氨酸(N-acetylcysteine,NAC)是含有巯基(-SH)的抗氧化剂。研究表明NAC可显著抑制氧化应激与气道炎症,从而控制哮喘等发作,提示其具有良好的抗过敏作用[10]。本实验以NAC体外作用PM2.5诱导的肥大细胞脱颗粒模型,测定PAR2表达和β-氨基己糖苷酶(β-Hex)、IL-4释放水平,探索肥大细胞PAR2在NAC抗过敏中的作用。
1 材料与方法
1.1 实验细胞 小鼠肥大细胞株(P815,中科院上海细胞库)。
1.2 试剂与设备 DMEM培养液(美国HyClone公司);胎牛血清、青-链霉素(美国Gibco公司);NAC、ROS检测试剂盒、CCK-8试剂盒(上海碧云天公司);小鼠IL-4 ELISA 试剂盒、BCA蛋白浓度测定试剂盒、山羊抗小鼠IgG(北京索莱宝公司);PAR2小鼠单克隆抗体、β-actin抗体、氨基己糖溶液(美国Sigma公司);曲拉通 X-100溶液、甘氨酸缓冲液、PBS缓冲液(上海生工生物公司);CO2细胞培养箱,高速冷冻离心机(美国Thermo公司);冷冻干燥机(美国Labconco公司);电泳仪、电泳槽和蛋白质含量测定仪(美国Bio-rad公司);多功能酶标仪(美国MD公司)。
1.3 PM2.5的制备 PM2.5收集滤纸来自于重庆市九龙坡区卫生监督局下属检测站(图1),采集期间(2018年10~12月)市区PM2.5日平均浓度[11]为48.88 μg/m3。改良Jin等[12]的方法提取PM2.5,步骤如下:将滤纸剪成1 cm×1 cm小块,浸于双蒸水中振荡60 min,过滤振荡液,12000 g冷冻离心5 min取上清,真空冷冻干燥48 h,钴-60辐照灭菌后,存放于-20℃。临用前溶于DMEM培养液,充分振荡,制成混悬液(10 mg/mL)。
图1 PM2.5采样点示意图
1.4 细胞模型建立及分组 采用PM2.5刺激肥大细胞脱颗粒建立模型。取对数生长期细胞,计数后接种于6孔板(浓度5×105个/mL),同步处理24 h。设空白组、模型组、NAC高、中、低剂量组(浓度分为100、50、25 μmol/L)。空白组、模型组用等体积DMEM培养液代替受试药物NAC;NAC各剂量组加入不同质量浓度的药物,每个浓度设4个副孔。37℃,5% CO2条件下培养6 h,加入PM2.5混悬液,调节终浓度100 μg/mL(空白组加入等量DMEM培养液),进行下述实验。
1.5 检测指标
1.5.1 细胞活力检测 PM2.5处理6、12 h后,采用CCK-8法分别检测各组细胞增殖情况。
1.5.2 ROS释放检测 PM2.5处理6、12 h后,细胞重悬于DCFH-DA(10 μmol/L)荧光探针中,避光培养30 min,PBS缓冲液洗涤3次后,吸取200 μL 接种96孔板,酶标仪测定488 nm激发波长,525 nm发射波长下的荧光值。
1.5.3 β-Hex释放率测定 PM2.5处理6 h后,吸取50 μL上清于96孔板,加入50 μL氨基己糖底物(1 mmol/L);总酶组中加入500 μL 1% 曲拉通X-100裂解细胞后,吸取50 μL上清于96孔板,加入50 μL等量氨基己糖底物;于37℃培养2 h,加入100 μL终止液(200 mmol/L pH 10.7甘氨酸缓冲液)后,酶标仪检测410 nm光密度OD值。以PM2.5实验组β-Hex释放量与曲拉通组裂解细胞后总β-Hex释放量之比,衡量PM2.5刺激细胞后的β-Hex释放率。β-Hex释放率(%)=[(OD实验-OD空白)/(OD总酶-OD空白)]×100%。
1.5.4 IL-4分泌量检测 PM2.5处理6 h后,取500 μL细胞培养液,500 g离心5 min,取上清。按小鼠IL-4 ELISA试剂盒说明检测IL-4浓度。
1.5.5 PAR2蛋白检测 PM2.5处理6 h后,裂解细胞提取总蛋白,BCA法测定细胞样品蛋白浓度,每孔取蛋白20 μg,进行12% SDS-PAGE电泳,转移至PVDF膜、在5%脱脂奶粉-TBST室温封闭2 h,分别加入PAR2抗体(1∶1000稀释)与β-actin抗体(1∶5000稀释),4℃过夜。加入二抗(1∶5000稀释),37℃反应1 h,用TBST洗涤3次,每次15 min。采用Western blot印迹法进行蛋白检测,以目的蛋白条带与内参β-actin的灰度值之比作为蛋白相对表达量。
1.6 统计学方法 采用SPSS 24.0统计软件行单因素方差分析(one-way ANOVA),两两比较采用Bonferroni检验,数据以均数±标准差表示。以P<0.05为差异具有统计学意义。
2 结果
2.1 各组细胞增殖活性比较 模型组细胞存活率均显著低于空白组与中、高剂量NAC组(P<0.05),见表1。说明NAC可能改善PM2.5对肥大细胞增殖活性的损害,提升存活率。

表1 各组细胞存活率比较 %
2.2 各组ROS生成比较 PM2.5刺激6 h后,模型组ROS生成量显著高于空白组与中、高剂量 NAC组(P<0.05);PM2.5刺激12 h后,模型组ROS生成量显著高于空白组与各NAC浓度组(P<0.05),低剂量组ROS显著高于高剂量组(P<0.05),见表2。说明NAC可能抑制肥大细胞ROS,浓度越高,抑制作用越强。

表2 各组ROS生成比较
2.3 各组β-Hex释放率比较 模型组β-Hex释放率高于空白组(P<0.05);各NAC浓度组均能抑制β-Hex释放,而高剂量组释放率显著低于其他各组(P<0.05),见表3。说明NAC可能抑制肥大细胞活化释放β-Hex,且浓度越高,抑制作用越强。
2.4 各组IL-4分泌量比较 模型组IL-4分泌高于空白组(P<0.05);各NAC浓度组均能减少IL-4分泌,且高剂量组抑制作用强于模型组与低剂量组(P<0.05),见表3。说明高剂量NAC可能降低肥大细胞IL-4的分泌。

表3 各组β-Hex释放率、IL-4分泌比较
2.5 各组PAR2蛋白表达比较 模型组与空白组比较,PAR2蛋白表达量显著增高(P<0.05);各NAC浓度组PAR2蛋白表达量较模型组显著降低(P<0.05),低剂量组表达量高于中、高剂量组(P<0.05),见图2。说明NAC可能抑制PAR2蛋白表达。
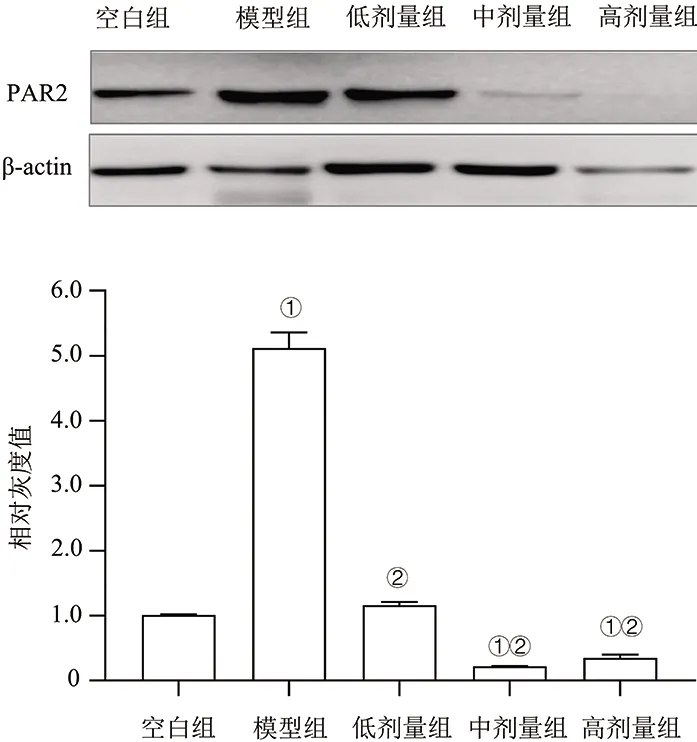
注:①与空白组比较,P<0.05;②与模型组比较,P<0.05
3 讨论
近年来,我国城市PM2.5污染程度仍在加重,尤其是冬季雾霾,除了危害呼吸、心血管及神经系统,增加健康负担,更是各类过敏性疾病发病率迅速增加的重要原因。作为各型超敏反应的核心,肥大细胞和嗜碱粒细胞脱颗粒可以释放组胺、类胰蛋白酶、白三烯(LTs)、白介素(IL)及肿瘤坏死因子(TNF-α)等I型超敏反应介质[13],诱发肥大细胞“细胞因子瀑布”,加剧过敏炎症反应[6,14]。早期研究指出,蛋白酶激活受体2(PAR2)在过敏性炎症的病理过程中起到重要作用[15]。Li等[16]证实尘螨可通过PAR2受体激活气道上皮细胞,促进IL-6、IL-8和粒细胞-巨噬细胞集落刺激因子(GM-CSF)等细胞因子和趋化因子的分泌。除此之外,PM2.5能够提高细胞氧化应激反应,影响NF-κB、ASK1-JNK及p53等胞内信号通路,上调炎性因子基因转录及蛋白表达[17],也可直接激活氧化钙调蛋白激酶(Ox-CaMKII),启动脱颗粒,引发过敏性疾病[18]。故探索PM2.5诱发过敏性疾病的防治措施具有重要的价值和意义。
NAC是左旋精氨酸的衍生物,具有多种药理活性,能够调节细胞代谢,清除体内氧自由基,有效抑制氧化应激反应[19],已广泛用于临床治疗。李剑等[20]发现NAC可降低哮喘患者TNF-α、IL-6,改善呼吸峰值流量(PEF),起到控制气道炎症效果。NAC联合糖皮质激素能调节重度哮喘患者TNF-α和IL-8水平,改善肺功能[21]。已有文献报道,IL-29可上调肥大细胞PAR-2表达并增加IL-4分泌,而使用阻断抗体AG490或LY294002后肥大细胞IL-4释放水平降低[22]。此外,PAR-2受体的激活,可促进肥大细胞(P815)分泌Th2 细胞因子IL-4,从而调控 IgE 合成型 B 细胞的转化,参与过敏性炎症反应[7]。本实验结果表明,NAC能够提高PM2.5体外刺激肥大细胞后的细胞存活率,调节ROS生成,阻断PAR2蛋白的表达,抑制脱颗粒释放β-Hex和IL-4。提示NAC可能减轻PM2.5对肥大细胞的损伤,抑制其活化脱颗粒。
肥大细胞是荨麻疹的主要效应细胞,研究发现皮肤风团周围的真皮组织肥大细胞发生活化、脱颗粒并释放局部炎性细胞因子和神经肽等,诱导Th2型炎症[23]。此外,PAR2受体可影响肥大细胞活化,改变皮肤细胞和感觉神经间的联系,在皮肤神经性炎症发展中起重要作用[24]。在小鼠皮炎模型中,应用PAR2受体抑制剂PZ-235可抑制肥大细胞IL-4分泌,缓解皮肤瘙痒症状,对AD有良好疗效[25]。Kim等[26]研究提示抗氧化剂NAC可以抑制支气管上皮细胞(A549)内胸腺基质淋巴细胞生成素(TSLP)和ROS水平,改善PAR2介导的过敏性炎症,降低支气管高反应性。传统医学研究还发现中药 “防风”能通过阻断PAR2受体,降低IL-6与组胺分泌,调节肥大细胞功能起到抗过敏作用[27],这与本研究结果相似。同时,近年还发现其它抗氧化剂如维生素E[28]、Trametes Orientalis多糖[29]、橘红[30]等也具有抗过敏及免疫调节作用,能够减轻PM2.5导致的肺部氧化应激和炎症损伤。实验初步发现,NAC对肥大细胞活化具有一定的保护作用,但对PAR2受体的具体作用途径仍不明确,有待利用PAR2阻断剂做进一步研究。
综上所述,NAC可能通过抑制PAR2表达,调节PM2.5诱导的肥大细胞活化,减少相关细胞因子和炎症介质的分泌,达到抗过敏的作用,从而进一步为药物防治PM2.5诱发过敏疾病提供新思路。
