重组聚合酶扩增法在HIV-1 DNA检测中的初步应用
2020-08-25董潇潇董晓庆许文炯吴咏梅张洪英
董潇潇 王 燕 董晓庆 许文炯 吴咏梅 张洪英
南京市疾病预防控制中心,江苏南京,210003
我国艾滋病病毒(human immunodeficiency virus,HIV)的感染人数逐年增加,2018年我国估计存活HIV感染者/艾滋病(acquired immunodeficiency syndrome, AIDS)患者125万[1]。目前全球范围内尚无有效预防HIV感染的疫苗和治愈的药物,及早诊断作为控制艾滋病流行的首要环节显得尤为重要[2]。
HIV感染的诊断目前广泛采用的是HIV-1抗体检测方法[3],但在实际应用中存在窗口期长[4],结果不确定需随访复检[5,6],母婴垂直传播的婴幼儿感染者受母源抗体干扰等问题[7]。核酸扩增技术很好的解决了这些问题,其中,依赖于PCR技术的HIV病毒核酸RNA检测因其良好的灵敏性、特异性和准确性,已被推广使用。然而PCR技术的应用依赖于昂贵的设备、实验室良好的基础设施、可靠的电力供应和训练有素的人员操作,而我国一些资源配置水平较低的地区,却恰恰是HIV高感染率地区。因此我们急需建立一种高质量的诊断方法,又不需要高成本配置,等温扩增技术的发展为这种需求提供了可能。
重组酶聚合酶扩增技术(recombinase polymerase amplification, RPA)是Piepenburg等[8]于2006 年提出的新型等温扩增技术。与以往的等温核酸技术例如环介导的等温扩增技术(LAMP)[9]和解旋酶依赖的扩增技术(HDA)[10]相比,RPA技术将反应温度降低到25℃~43℃,时间缩短至20 min内,能耗成本更低,临床应用也更方便。RPA利用重组酶将寡核苷酸引物插入到目标双链DNA分子的等温扩增方法,其利用上、下游引物对目标区域的DNA的指数放大方式类似于PCR,但是效率大大高于PCR,同时适用于RNA和DNA的扩增。RPA可以采用荧光检测仪,只有普通电话机大小,装上电池即可使用,也可以采用可视化检测。它是核酸检测技术的一个质的飞越[8,11]。
美国有科学家尝试将RPA技术应用到HIV-1前体DNA检测中,他们从63组引物探针中筛选出2组引物探针,分别针对HIV-1基因组的长片段末端重复序列(long terminal repeat,LTR)和pol区,可以检测出3个拷贝的艾滋病毒前体DNA分子,且针对基因组pol区的引物探针可以扩增HIV-1病毒的不同重组体[12]。但在国内尚未见相关报道,因此本文拟参考文献,在本实验室建立RPA的检测方法,观察该方法的灵敏性和特异性,并初步应用于临床样本HIV-1 DNA的检测,期望获得一种更为快速、简便、有效的HIV-1检测方法。
1 资料和方法
1.1 主要仪器与试剂 Bio-Rad MiniOpticon实时荧光定量PCR仪,由美国Bio-Rad公司生产;恒温扩增荧光检测仪Axxin T8-ISO,由澳大利亚Axxin公司生产;QIAamp DNA Blood Mini Kit,购自德国QIAgen公司;TwistAmpTM DNA amplification kits(TwistAmpTM exo kit),购自英国 TwistDx 公司;人类免疫缺陷病毒抗原抗体诊断试剂盒(酶联免疫法),购自珠海丽珠公司;人类免疫缺陷病毒HIV(1+2)型抗体检测试剂盒(胶体硒法),购自Alere公司;人类免疫缺陷病毒(HIV1+2)型抗体检测试剂盒(免疫印迹法),购自MP公司。
1.2 阴阳性对照和临床样品 由上海生工公司合成HIV-1 pol基因并克隆至pUC57载体,命名为pHIV-1-pol,由本实验室保存,作为RPA实验的阳性对照;以无RNA酶水作为阴性对照。13份临床样本,用EDTA抗凝管采集全血,离心分离血浆和淋巴细胞富集液。
1.3 临床样品的HIV抗体检测 临床样品HIV抗体检测流程参考《全国艾滋病检测技术规范(2015修订版)》,采用两种初筛试剂进行筛查,有反应的样本继续进行补充试验,检测方法参照试剂说明书。
1.4 临床样品淋巴细胞富集液中DNA的提取 按照说明书要求的比例配制AW1缓冲液和AW2缓冲液;取200 μL待提取的淋巴细胞富集液,加入20 μL QIAgen蛋白酶(或者蛋白酶K),再加入200 μL Buffer AL,盖紧盖子,涡旋震荡15 s,56℃孵育10 min;瞬时离心,去除残留在离心管上的液滴;加入无水乙醇200 μL,盖紧盖子,涡旋震荡15 s,使之充分混匀,瞬时离心;将上述混合物转入QIAamp mini 离心管柱,14000 r/m离心1 min,弃去滤液;QIAamp mini提取柱中加入AW1缓冲液500 μL,8000 r/m离心1 min,弃滤液;加入AW2缓冲液500 μL,14000 r/m离心3 min,弃滤液,再次14000 r/m离心1 min;QIAamp mini提取柱加入AE缓冲液或双蒸水100 μL溶解收集DNA,并于-80℃保存或直接进行实验。避免反复冻融。
1.5 引物探针 选取Boyle等[12]针对HIV-1遗传保守的pol区的引物和探针,所有引物探针均由上海生工公司合成。
上游引物: 5’-TGGCAGTATTCATTCACAATTT TAAAAGAAAAGG-3’ 下游引物:5’-CCCGAAAATT TTGAATTTTTGTAATTTGTTTTTG-3 探针:5’-TGC TATTATGTCTACTATTCTTTCCCCFGCHCQGTACCCCC CAATCCCC/C3-spacer/-3’(F=dT-FAM,H=THF,Q=dT-BHQ)。
1.6 RPA反应体系及程序 依据TwistAmpTM exo kit配置50 μL RPA 反应体系,其中29.5 μL rehydration 缓冲液,2.1 μL上游引物(10 μM),2.1 μL下游引物(10 μM),0.6 μL HIV-1 FAM标记的探针(10 μM),2.5 μL镁离子(280 mM),3.2 μL水和10 μL模板DNA。将模板和镁离子之外的所有试剂加入含有冻干酶制剂的反应管中预混,并将2.5 μL MgAc 加在反应管盖上,将10 μL DNA模板加入反应体系中,盖紧后瞬时离心,放入Bio-Rad MiniOpticon实时荧光定量PCR仪或恒温扩增荧光检测仪Axxin T8-ISO 39℃反应10、20、30 min,实时收集FAM荧光值。
1.7 临床样品的结果判断 反应设置3个阴性对照(NC)和1个阳性对照(PC),A值为等温扩增的终末与起始绝对荧光差值,临界值COV=阴性对照的平均A值+1倍标准差S,A<0按照0计算,若样本A值≥COV即判断为阳性,否则为阴性。
2 结果
2.1 质粒的拷贝数计算 检测合成的质粒pHIV-1-pol的浓度为116 ng/μL,碱基数为3208 bp,根据下列公式,计算重组质粒pHIV-1-pol拷贝数:拷贝数(copies/μL)=6.02×1023×质粒浓度(ng/μL)×10-9/(质粒碱基数×660),得知该质粒的拷贝数为3.3×1010copies/μL。经过倍比稀释,使pHIV-1-pol拷贝数在107~100copies/μL 之间。
2.2 RPA实验条件的优化 为确定本实验室RPA的最佳反应时间,选择106copies/μL的pHIV-1-pol作为DNA模板进行RPA等温扩增,以无RNA酶水作为阴性对照(NC),Bio-Rad MiniOpticon检测,对荧光扩增曲线进行分析。结果如图1所示,39℃条件下RPA反应进行到10 min时,106copies/μL的pHIV-1-pol曲线持续扩增;当反应进行到20 min时,pHIV-1-pol扩增曲线进入平台期;当反应进行到30 min时,pHIV-1-pol扩增曲线在平台期后继续上升,扩增反应不稳定。为排除非特异性扩增,本研究中RPA反应的最佳反应时间确定为20 min。为进一步验证RPA反应条件的可靠性,选择107~105copies/μL的pHIV-1-pol作为模板等温扩增20 min,Bio-Rad MiniOpticon检测,扩增结果如图2所示,107~105copies/μL的pHIV-1-pol均出现特异性扩增曲线,阴性对照并没有扩增。
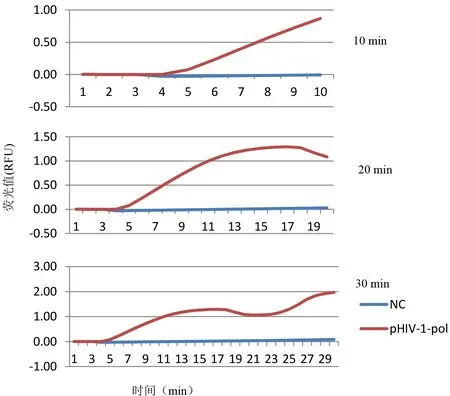
图1 HIV-1 DNA的RPA实验检测时间优化

7~5:107、106、105 copies/μL pHIV-1-pol
2.3 RPA检测敏感性实验 我们将pHIV-1-pol倍比稀释至103~100copies/μL,验证RPA方法能否检测低浓度DNA模板,从而了解该方法的检测灵敏度,如图3显示,103和102copies/μL出现了明显的扩增曲线,可见该方法可以稳定检测102copies/μL的DNA,而101copies/μL在反应进行到15 min以后扩增曲线也呈现上升趋势,100copies/μL和阴参未出现特异性扩增。说明该实验方法灵敏度较高。

3~0:103、102、101、100 copies/μL pHIV-1-pol
2.4 RPA检测特异性实验 选择经HIV抗体筛查确定为阴性的健康人群的淋巴细胞富集液提取DNA样本HIV Ab(-)1~3,验证RPA方法的检测特异性,以106copies/μL的pHIV-1-pol作为阳参,无RNA酶水作为阴参,结果如图4所示,三份HIV Ab(-)样本及无RNA酶水均未产生特异性的扩增,结果为阴性,只有阳参出现了特异性扩增,说明该方法具有良好的特异性。
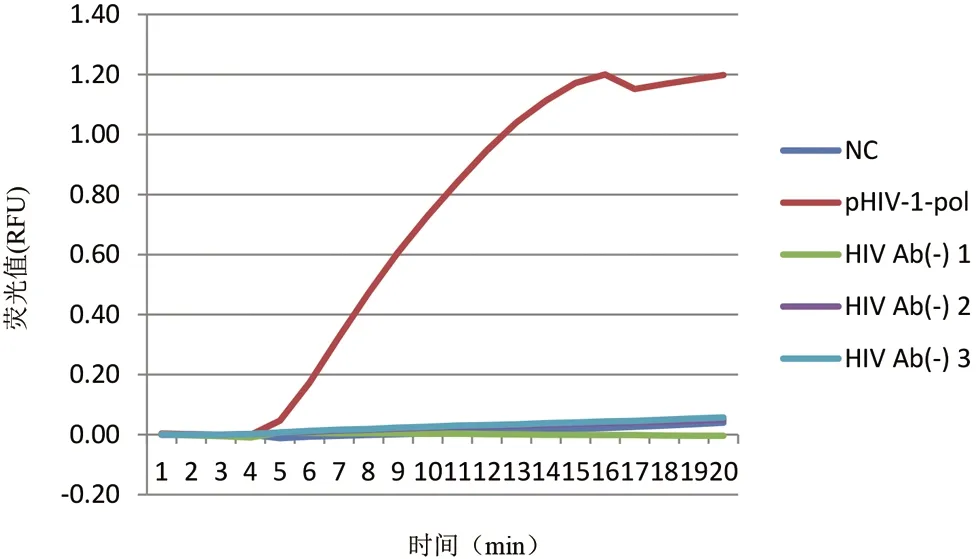
图4 HIV-1 DNA的RPA检测特异性实验
2.5 恒温扩增荧光检测仪检测临床样品 在本实验室条件下,确定RPA方法检测HIV-1病毒pol区的敏感性、特异型和有效性后,我们选择小型便携的恒温扩增荧光检测仪Axxin T8-ISO重复,反应体系和条件不变。按照资料和方法1.7临床样品的结果判断的要求设置阴性对照和阳性对照,临界值COV经计算为73 mV,计算过程详见表1。如表2所示,经检测101~106copies/μL pHIV-1-pol样本A值均大于COV,呈阳性,100copies/μL pHIV-1-pol的A值为77,略高于COV,为弱阳性,同时检测结果2.4中的HIV Ab(-)1-3,均为阴性,体现该方法的高灵敏度和特异性。进一步选择保存的13份待检测临床样本用RPA方法检测,检测结果用血清/血浆HIV抗体进行验证。临床样本的结果如表3所示,经RPA检测有5份样本A值大于COV,呈阳性,其余8份样本呈阴性反应,其对应血浆样本的HIV抗体检测结果与之完全一致。
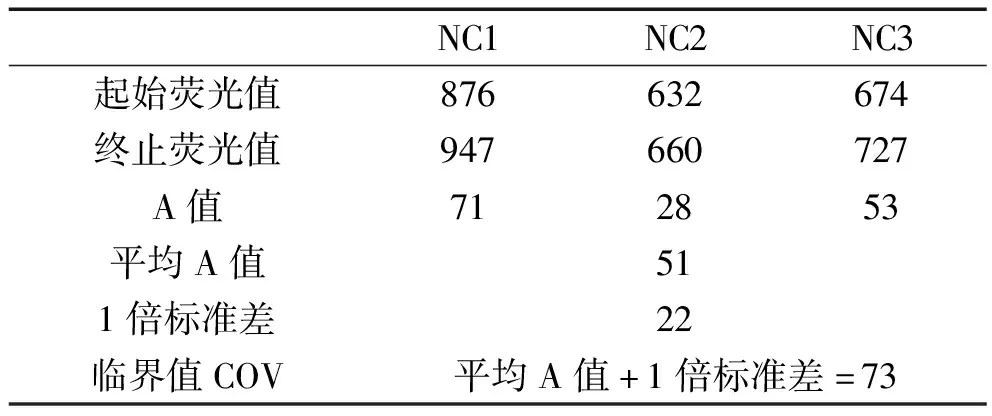
表1 RPA方法临界值的计算 (荧光值单位:mV)

表2 Axxin T8-ISO用于HIV-1 DNA的RPA敏感性和特异性检测 (荧光值单位:mV)
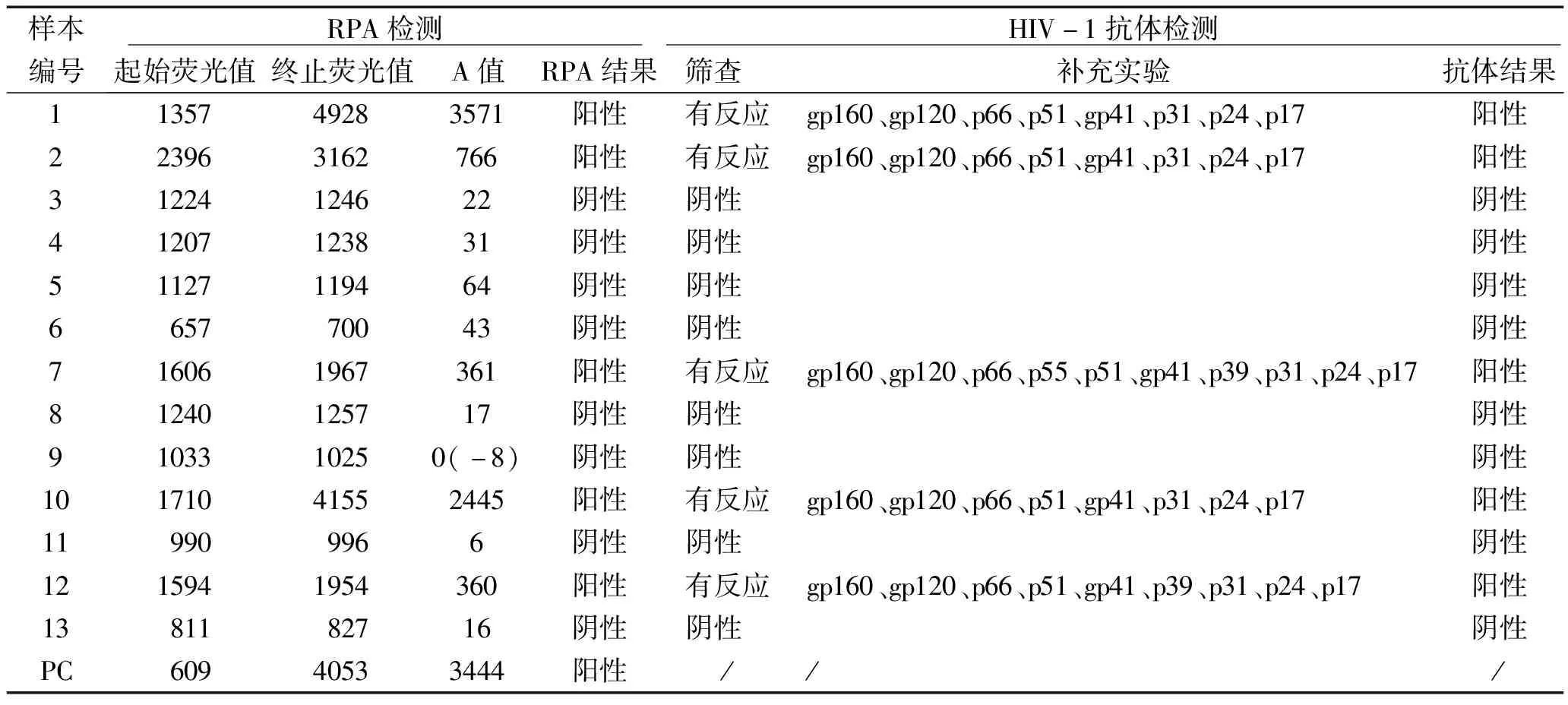
表3 临床样品的RPA检测结果(荧光值单位:mV)与HIV-1抗体检测结果比对
3 讨论
本研究对RPA方法在HIV-1 DNA检测的灵敏度、特异性进行了验证实验,检测效率不低于甚至优于传统的荧光定量PCR方法。我们利用该方法借助小巧便携且可视化的恒温扩增荧光检测仪成功对13份临床待检测样本进行了快速而准确的结果判断。与传统的PCR技术相比,RPA方法将核酸扩增时间从超过1 h缩短至15~30 min[11],本研究中的RPA最佳检测时间为20 min。此外RPA方法的试剂采用冻干粉运输保存,更为方便,对仪器设备的要求也大大降低,除了本研究中采用的便携式仪器外,有报道称一般水浴锅甚至依赖人的体温即能完成等温扩增的过程[13,14]。虽然对仪器设备的要求降低,但该检测方法对实验室人员操作要求较高,需避免反应体系混合不均而造成的结果不稳定。综上所述RPA方法使HIV-1的快速检测不再局限于HIV-1抗体的快速检测试剂,只需规范的人员培训,就可实现病毒核酸现场快速诊断。
HIV病毒DNA主要是血浆游离病毒RNA感染CD4+T细胞后整合到宿主细胞的病毒前体DNA,感染早期即可产生,抗病毒治疗可以清除血浆游离的病毒和感染的活化CD4+T细胞,然而受感染的静息期CD4+T细胞依然存在,其中的前体DNA构成HIV-1病毒储存库,目前前体DNA是长期存在于体内无法清除的[15,16]。因此HIV-1前体DNA不仅是一个合格的早期诊断指标,与游离病毒RNA相比更是一个特异性的检测指标,在婴幼儿的早期诊断和抗病毒疗效观察方面也有重大作用。然而病毒储存库的DNA含量对检测方法的敏感性要求极高,在本研究中,RPA成功扩增了101copies/μL的DNA,且恒温扩增荧光检测仪Axxin T8-ISO检测100copies/μL的DNA呈弱阳性反应,具有良好的敏感性。HIV-1病毒DNA作为一个更全面更有价值的检测指标,具有广泛的前景。
本研究在本实验室条件下建立了检测HIV-1 DNA的RPA方法,并验证其灵敏度和特异性,并初步应用到临床样本的检测中,结果均较为稳定,重复性较好。但还需进一步扩大临床样本检测量,并拓展RPA方法检测HIV-1DNA在婴幼儿和治疗后等人群方面的应用,以期望更全面评价RPA方法的检测价值。
