穿心莲内酯纳米粒对口腔鳞癌HN6 细胞株和白斑Leuk1 细胞株抑制作用的实验研究
2020-08-19李宏权姜继宗马亭云吴玉波钱文昊王长虹
李宏权, 姜继宗, 马亭云, 吴玉波, 钱文昊, 王长虹
(1. 上海市徐汇区牙病防治所,上海 200032;2. 上海中医药大学中药研究所,上海 201203)
口腔白斑为口腔最重要的潜在恶性病变,是口腔鳞癌(oral squamous cell carcinoma,OSCC)的主要来源之一。 白斑由增生到异常增生再到癌变,是一个致癌基因改变逐步积累后,导致细胞异常和不可控生长,直到癌症发生的多步骤过程[1]。2015 年全球有354 864 例新发口腔癌[2],口腔鳞癌已成世界范围的健康问题。 目前,筛选中药有效成分被认为是一个探求肿瘤化学预防药物的有效途径。
穿心莲内酯(andrographolide,AND)是源于穿心莲(andrographis paniculata)的二萜内酯类化合物,具有抗炎[3]、抗肿瘤[4]等活性。Yang 等[5]证实,AND 有抗OSCC 增殖的活性。Manoharan 等[6]证实AND 有防治仓鼠颊囊癌变的活性。 陈博艺等[7]总结出AND是通过诱导肿瘤细胞凋亡、影响不同细胞周期蛋白的表达、抑制肿瘤细胞周期进展等方面,发挥其抗肿瘤作用。 但AND 溶解度低、 生物利用度差的缺点,限制了其临床应用。 纳米载体是提高药物生物利用度的有效方式[8]。Yang 等[9]证实,载有AND 的固体 脂 质 纳 米 粒 (AND-solid lipid nanoparticles,AND-SLNs)可增加AND 溶解度,SLNs 是增加AND生物利用度的理想载体。 本研究通过对比纳米化的AND(AND-SLNs)与普通AND,对OSCC 或白斑细胞株细胞抑制作用的差异, 探讨纳米化能否增强AND 的抗肿瘤增殖作用,为体内实验提供基础。
1 材料和方法
1.1 药物与试剂
1.1.1 实验用药物 AND-SLNs 与AND 由上海中医药大学王长虹教授团队提供,保存于恒温干燥箱中。 AND 纯度为98%。 实验用每批次AND-SLNs 浓度由王长虹教授团队制备后用HPLC 法测量获得;现用现配,80 ℃水浴后用0.22 μm 滤器过滤。
1.1.2 实验用细胞系及培养条件 OSCC 细胞系HN6 由上海交通大学医学院附属第九人民医院口腔肿瘤实验室(上海市口腔重点实验室)提供,口腔白斑细胞系Leuk1 由美国马里兰州马里兰大学牙科学院毛力教授提供。 将HN6 细胞置于DMEM 高糖培养液 (上海源培生物科技股份有限公司,C40306)中培养。 将Leuk1 细胞置于人角化上皮细胞培养液[(keratinocyte serum free medium, K-SFM)+表皮生长因子]中培养。 所有细胞均在37 ℃、5%CO2及饱和湿度的培养箱内培养。 参照美国模式培养物集存库(American type culture collection,ATCC)提供的标准培养条件在10 cm 培养皿中养殖细胞。 待细胞在预成培养液中生长至70%~80% 时接种。
1.2 细胞实验
1.2.1 细胞摄取药物定量实验研究[10]HN6、Leuk1 细胞系以1×105个/mL 的细胞密度分别接种在2 块24 孔板中孵育,每孔1 mL。 孵育24 h 细胞贴壁后,24 孔板培养液中加入适量的AND-SLNs 和AND 药物储存液, 使培养液中2 种药物均有8、80 μg/mL共2 种质量浓度,在37 °C 培养箱内孵育2 h,各有3 个复孔。 去除培养液,24 孔板内加入300 μL/孔的4%的多聚甲醛溶液固定10 min; 磷酸缓冲盐溶液(phosphate buffer saline,PBS)洗涤1 次,时长5 min。按200 μL/孔加入细胞裂解液EBC(不加蛋白酶抑制剂),轻微振荡15 min。 细胞裂解液中的AND 药物质量浓度用高效液相色谱仪(HPLC)检测。
1.2.2 细胞增殖抑制试验(MTS 法)[11]HN6 和Leuk1细胞以30 个/μL 的细胞密度接种于96 孔板内。 在96 孔板最外一圈的孔内只加入PBS, 排除边缘效应。 96 孔板置于37 ℃、5% CO2饱和湿度的培养箱内过夜。 次日,吸除一侧纵行6 孔内培养液,立即加入用培养液配制好的药液,AND-SLNs 和AND 在96 孔板中从200 μg/mL 的原始质量浓度依次稀释9 次, 即200、100、50、25、2.5、0.25、0.025、0.002 5、0.000 25 和0.000 025 μg/mL 共10 个质量浓度梯度,每个质量浓度的药物各有6 个复孔, 放入培养箱内,分别培养24、48、72、96 h。 在1 mL 的CellTiter 96®AQueous One Solution Reagent 内加入5 mL 的PBS(1∶5 稀释)混合备用。 在各个时间点,吸去相应孔内培养液。 立即在每孔内加入120 μL 准备好的CellTiter 96®Aqueous One Solution Reagent/PBS 混合液。将96 孔板置于培养箱内,作用4 h 后取出。用SunriseTM光吸收酶标仪检测每孔在490 nm 的吸光度值(optical density,OD 值)。 存活率=实验组OD值/空白对照组OD值× 100%。 实验重复3 次。
1.2.3 流式细胞仪检测细胞增殖周期阻滞实验[12]以细胞增殖抑制实验获得2 种药物在48 h 时HN6、Leuk1 细胞的IC50 值为实验组药物质量浓度,配取相应培养液及没有药物的培养液作为阴性空白对照。 HN6 和Leuk1 以3 × 104个/mL 的细胞密度各10 mL 接种于6 个10 cm 的培养皿中,饥饿过夜、待细胞贴壁。 37 ℃培养箱孵育12 h,0.25%胰酶消化,每组收集大约6×105个细胞, 室温下以1 000 r/min的速率离心3 min, 用3 mL 预冷的PBS 洗涤1 次,在4 ℃下用3 mL 预冷的70%乙醇溶液固定4 h或过夜。 细胞再以1 000 r/min 速率离心3 min,用预冷的PBS 洗涤1 次, 用402.75 μL 冷的PBS 重悬细胞,加入2.25 μL 的核糖核酸酶A(RNase A)(10 mg/mL)和45 μL 的碘化丙啶(propidium iodide,PI)(1 mg/mL),4 ℃避光孵育30 min。流式细胞仪分析。 实验重复3 次。
1.2.4 流式细胞仪检测细胞凋亡实验[13]HN6 和Leuk1以3×104个/mL 的细胞密度接种,2.5 mL/孔,各3 块6 孔板,过夜待细胞贴壁。 次日,吸除1 块6 孔板中的培养液, 加入含有48 h IC50 质量浓度的药物培养液,培养箱内孵育12 h;再去除1 块6 孔板中的培养液, 加入含有48 h 的IC50 质量浓度的药物培养液,培养箱内孵育6 h;第3 块6 孔板作为阴性空白对照。孵育结束后,按Alexa Fluor ®488 Annexin V/Dead Cell Apoptosis Kit 试剂盒要求收集细胞,用冷的PBS 洗涤1 次。转移细胞悬液至流式管内,1 000 r/min 速率离心3 min,重新离心细胞,弃上清液, 并用1 × 膜联蛋白结合缓冲液100 μL 重悬细胞。在含有约2.25 × 105个细胞的悬液100 μL 中加入5 μL 的Annexin V-FITC (Annexin V-fluorescein isothiocyante)和5 μL 的50 μg/mL PI 工作液;在室温、避光条件下,共同孵育15 min。在冰上,将400 μL的1 × 膜联蛋白结合缓冲液加入100 μL 的细胞悬液中并轻柔混合后,用流式细胞仪和随机软件分析细胞凋亡结果。 实验重复3 次。
1.3 统计方法
2 结果
用SPSS 19.0 软件统计处理实验数据, 用独立样本t检验分析。 用GraphPad Prism 6.0 作统计图。P<0.05 判断为差异有统计学意义。
2.1 细胞定量摄取实验
HN6 细胞经AND-SLNs 处理后以8、80 μg/mL的质量浓度分别孵育2 h 后,吸收AND 的量为24.20、82.84 μg/mL,对应AND 组的吸收量为0.00、9.17 μg/mL。AND-SLNs 组细胞吸收量均比AND 组多,且随药物质量浓度的增加细胞吸收量也增加(图1A)。
Leuk1 细胞经AND-SLNs 处理后以8、80 μg/mL的质量浓度分别孵育2 h 后, 吸收AND 的量为6.28、13.46 μg/mL, 对应AND 组的吸收量为6.06、16.81 μg/mL。 同质量浓度AND-SLNs 和AND 的药物吸收量相差不明显,但均随药物质量浓度的增加而增加(图1B)。

图1 HPLC 定量检测细胞摄取药物实验Figure 1 Cellular uptake in quantitive examination by HPLC
2.2 细胞生长增殖抑制试验(MTS 法)
如图2A 和2B 所示, 药物作用于HN6 细胞48 h后,AND-SLNs 和AND 的IC50 分别为6.09、13.75 μg/mL。 药物作用于Leuk1 细胞48 h 后,AND-SLNs 和AND 的IC50 分别为0.72、26.14 μg/mL。
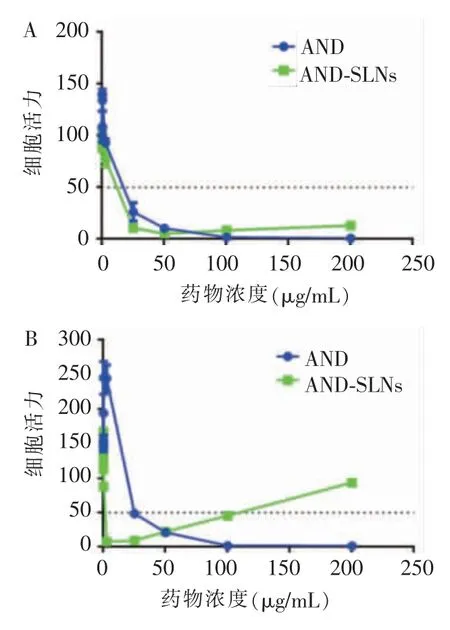
图2 用MTS 方法进行细胞增殖抑制实验Figure 2 Cell viability assay by MTS
2.3 流式细胞仪分析细胞周期阻滞实验
6.09 μg/mL 的AND-SLNs 和13.75 μg/mL 的AND 作用于HN6 细胞12 h, 在细胞G0/G1 期为(55.41±2.00)%对(30.75±9.33)%,P=0.01;在细胞增殖期(G2/M+S)为(44.59±2.00)%对(69.25±9.33)%,P=0.039。 详见图3A、3B。
0.72 μg/mL 的AND-SLNs 和26.14 μg/mL 的AND 作用于Leuk1 细胞12 h, 在细胞G0/G1 期为(61.65±7.62)%对(41.49±4.34)%,P=0.016;在细胞增殖期(G2/M+S)为(38.35±7.62)%对(58.51±4.34)%,P=0.026。 详见图3C、3D。
2.4 流式细胞仪分析细胞凋亡实验
6.09 μg/mL 的AND-SLNs 和13.75 μg/mL 的AND 作用于HN6 细胞6 h 或12 h 后的情况如下。6 h 的早期凋亡率为(5.45±0.36)%对(3.74±0.04)%,P=0.022;晚期凋亡率为(2.62±0.32)%对(1.59±0.23)%,P>0.05;总凋亡率为(8.06±0.68)%对(5.33%±0.27)%,P=0.034(图4A、4B)。 12 h 早期凋亡率为(3.24±0.23)%对(3.38±0.39)%,P>0.05;晚期凋亡率为(7.04±0.38)%对(1.46±0.08)%,P=0.002;总凋亡率为(10.28±0.16)%对(4.84±0.30)%,P=0.002(图4C、4D)。 部分差异有统计学意义,与药物抑制增殖曲线相符。

图3 流式细胞仪检测细胞周期阻滞实验Figure 3 Cell cycle analysis by flow cytometry
0.72 μg/mL 的AND-SLNs 和26.14 μg/mL 的AND 作用于Leuk1 细胞6 h 或12 h 后的凋亡率如下。 6 h 早期凋亡率为(0.47±0.17)%对(0.36±0.02)%,P>0.05; 晚期凋亡率为 (11.30±0.04)%对 (11.53±0.04)%,P>0.05; 总 凋 亡 率 为 (11.77±0.13)%对(11.88±0.01)%,P>0.05(图4E、4F)。 12 h 早期凋亡率为(0.30±0.01)%对(0.43±0.13)%,P>0.05;晚期凋亡率为(23.73±0.11)%对(14.27±0.69)%,P=0.003;总的凋亡率为(23.99±0.11)% 对(14.70±0.81)%,P=0.004(图4G、4H)。 部分差异有统计学差异,与药物抑制增殖曲线相符。
3 讨论
3.1 关于穿心莲有效成分通过纳米技术提高生物利用度的思考
纳米化学预防最早由Mukhtar 团队提出[14]。 姜黄[15]、染料木黄酮[16]等化学预防药物研究显示,纳米粒子载药系统能使天然植物药物减毒。
AND 纳米化研究证明, 纳米剂型改变的AND可优化细胞表面转运方式、 提高生物利用度、 增强AND 生物活性,可作为治疗疾病的新剂型[17-18]。为研究植物天然产物AND 应用于预防和治疗OSCC 的可能,本课题组与上海中医药大学中药研究所王长虹教授的团队合作, 其中关于AND-SLNs 及AND的制备和特性已发表[9,19]。 通过体外细胞实验,探索具有抗癌活性的AND 纳米化后, 被细胞摄取的情况和抑制OSCC 和白斑细胞增殖的效果。
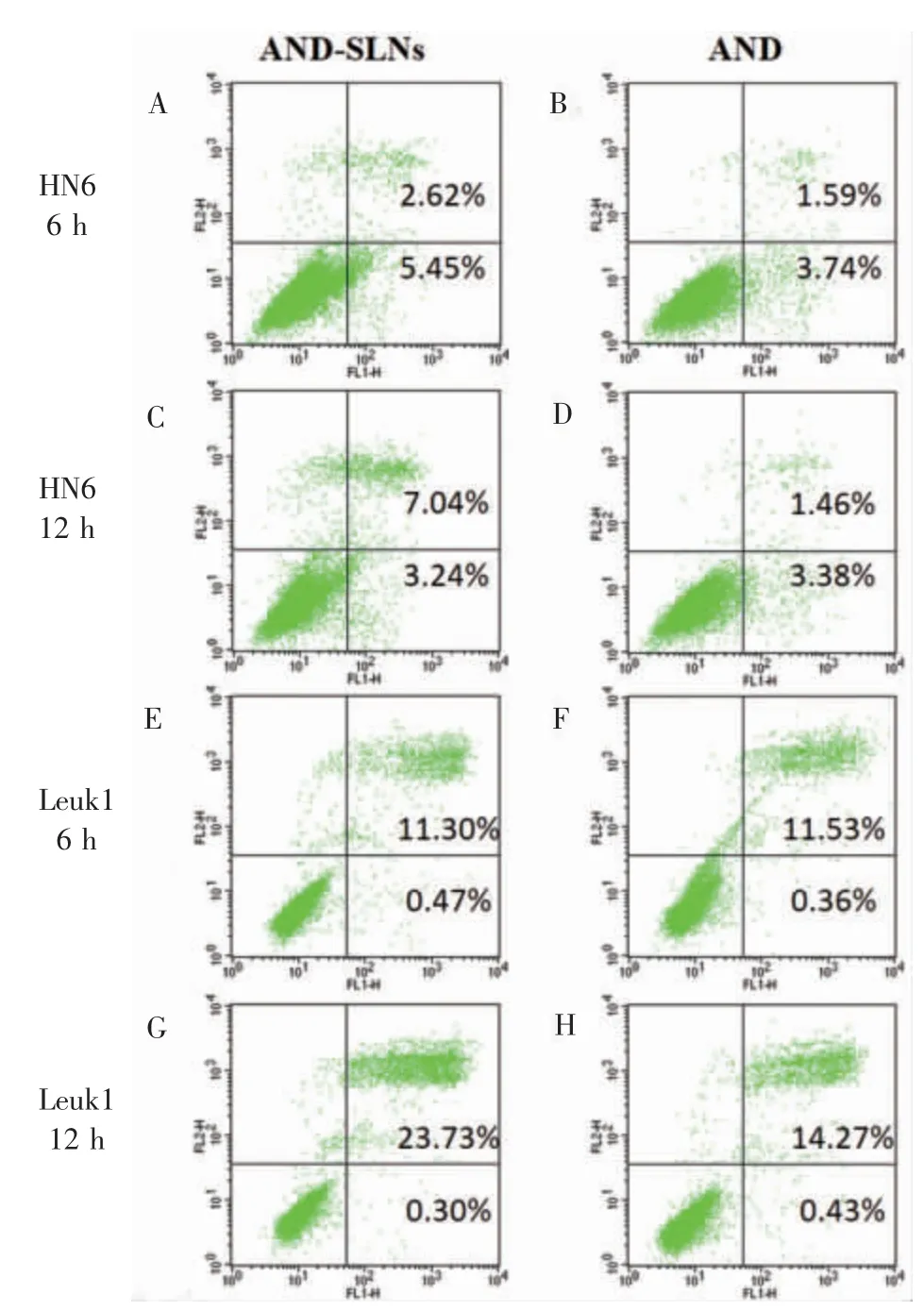
图4 Annexin V-PI 凋亡实验Figure 4 Annexin V-PI apoptosis assay
3.2 AND 及其固体脂质纳米粒抗OSCC 细胞和白斑细胞的有效性和差异性
细胞定量摄取药物实验结果显示,AND-SLNs更能促进HN6 细胞对AND 的吸收,且具有浓度-时间依赖性和一定的细胞特异性。 本实验说明ANDSLNs 更能促进细胞对AND 的吸收, 固体脂质纳米粒作为载体促使AND 进入细胞内达到较高程度的聚集,从而提高AND 的生物利用度。
细胞增殖抑制实验结果证明,AND 纳米化后仍具有抑制OSCC 增殖的活性, 同时两者也均有抑制白斑细胞增殖的活性。 这与Wang 等[20]的研究结果相符。 实验结果显示AND-SLNs 对2 个细胞系在48 h 的IC50 均小于AND,且具有时间-浓度依赖性和一定的细胞特异性, 证明AND-SLNs 抑制OSCC和白斑细胞增殖的生物活性比单纯AND 更强。
细胞周期阻滞实验结果证明,AND-SLNs 比单纯的AND 更明显阻滞HN6 和Leuk1 细胞增殖周期于G0/G1 期, 其阻滞细胞增殖周期的活性更强,进而能更强地抑制细胞进入生长增殖期。
细胞凋亡实验证明,AND-SLNs 在作用HN6 和Leuk1 细胞6 h 和12 h 后,与AND 的作用相比均有统计学差异,说明AND-SLNs 具有更强的诱导细胞凋亡的生物活性, 从而证明AND-SLNs 抗OSCC 和白斑细胞的活性更强。
3.3 AND 及其固体脂质纳米粒抗OSCC 细胞和白斑细胞可能的机制
Roy[17]、Yang[9]、Yen[18]及杨涛等[19]对AND 纳米化的研究结果均表明,以相应的纳米粒作为载体能够增强细胞对AND 的摄取, 提高AND 的生物利用度,增强AND 的生物活性,加强对寄生虫的杀灭,显著恢复小鼠受损的肝功能, 更好地稳定血压、更强地抑制癌细胞增殖和抑制胃肠道炎症反应。
本研究提示可能由于纳米载体促进了细胞对药物摄取,提高药物在靶细胞中的浓度,从而明显抑制细胞生长增殖、阻滞细胞周期、诱导细胞凋亡,表现出更强的抗OSCC 细胞和白斑细胞活性。 但其具体作用机制和信号通路还待进一步研究。
3.4 体外细胞实验结果与体内实验研究展望
Wang[20]、Manoharan[6]、Hsieh[21]及Yang 等[5]均 通过体内实验证明了AND 具有防治口腔黏膜癌变的活性。 本次实验显示,纳米化的AND 抗OSCC 细胞和白斑细胞的增殖活性强于单纯的AND,因而可考虑进一步应用合适的动物模型,通过体内实验来阐明纳米化的AND 在白斑恶性转变过程的作用。 此外, 相关AND 的靶向配体可靶向连接纳米粒到癌细胞表面过度表达的特异性受体。 因此,研究AND的靶向配体可为临床上使用AND 化学预防白斑癌变提供实验依据。
综上所述, 本文的体外细胞实验初步证明,纳米化的AND 对OSCC 细胞和白斑细胞具有更显著的抗增殖活性的潜能。 本次实验表明AND-SLNs 纳米剂型有望成为抗癌化学预防药物的第1 步,为下一步的体内研究提供了实验基础。
