长链非编码RNA DLX6-AS1 调控微小RNA-15b 和磷脂酶D1 影响口腔鳞状细胞癌侵袭转移的分子机制研究
2020-08-19杨利杰田欣欣管臻洁
杨利杰, 田欣欣, 管臻洁
(郑州大学第一附属医院口腔医学中心,河南 郑州 450002)
口腔鳞状细胞癌简称口腔鳞癌,占口腔颌面部恶性肿瘤的80%[1], 其较高的发病率严重威胁人类生命健康。 口腔鳞癌常发生淋巴结转移和远处转移,多为局部复发,因此治疗效果不佳[2]。 探讨口腔鳞癌发生、发展的分子机制并寻找治疗靶点是当前口腔医生的重要任务。 长链非编码RNA(lncRNA)是一类小分子单链非编码RNA,其可作为竞争性内源RNA(competing endogenous RNA, ceRNA)与微小RNA (miRNA) 相互作用调控miRNA 靶基因的表达,与肿瘤发生、发展密切相关[3]。 生长停滞特异性蛋白6-反义RNA1(DLX6-AS1)是近年来新发现的一种lncRNA,其在非小细胞肺癌、宫颈癌、结直肠癌等肿瘤细胞中表达增高,降低其表达可抑制肿瘤细胞的增殖、迁移和侵袭,是肿瘤治疗的潜在靶点[4-6]。 但DLX6-AS1 在口腔鳞癌中的表达及其对口腔鳞癌细胞迁移和侵袭的影响,目前还未知。 生物信息学软件预测显示,miR-15b 可能是DLX6-AS1的靶基因,DLX6-AS1 可能作为miR-15b 的内源性RNA 调控miR-15b 靶基因的表达。 有报道称,miR-15b 在口腔鳞癌组织中表达降低, 过表达miR-15b可抑制口腔鳞癌细胞Cal27 增殖,并诱导细胞凋亡,在口腔鳞癌中发挥抑癌基因作用[7]。 生物信息学软件预测显示,磷脂酶D1(PLD1)是miR-15b 的靶基因。 磷脂酶可将磷脂酰胆碱水解生成磷脂酸和胆碱,影响细胞的增殖、迁移和侵袭等生理功能[8]。 研究显示,PLD1 可促进胰腺癌、前列腺癌、结直肠癌等肿瘤的发生和发展[9-11],但其在口腔鳞癌中的作用还未知。 本研究以miR-15b/PLD1 轴为切入点,深入探讨DLX6-AS1 对口腔鳞癌细胞增殖、 迁移和侵袭的影响,以期为该肿瘤复发、转移分子机制的阐明及治疗靶点的选择提供一定实验依据。
1 材料和方法
1.1 一般资料
收集2016 年12 月—2018 年5 月于本院确诊并进行手术治疗的38 例口腔鳞癌患者的癌组织和对应的癌旁组织,液氮保存,其中癌旁组织距离癌组织边缘>3 cm,病理检测未发现癌细胞。38 例患者中男性25 例,女性13 例,年龄47~72 岁,平均年龄(65.29±5.78)岁。 TNM 分期:Ⅰ期9 例,Ⅱ期11 例,Ⅲ期10 例,Ⅳ期8 例;淋巴结转移16 例,淋巴结未转移22 例。 排除标准:①术前行放、化疗等治疗的患者;②心脏、肾等重要器官功能不全者;③临床资料不完整的病例;④患有免疫系统疾病者。 本研究经医院伦理委员会批准同意,患者或其家属自愿签署知情同意书。
1.2 细胞和实验试剂
口腔鳞癌细胞HSC3 (中国科学院上海细胞库),胎牛血清(fetal bovine serum,FBS)(浙江天杭生物科技股份有限公司),RPMI 1640 培养基和二喹啉甲酸(bicinchoninic acid,BCA)蛋白检测试剂盒(北京索莱宝科技有限公司), 四甲基噻唑蓝(MTT)和胰蛋白酶 (美国Sigma 公司),LipofectamineTM 2000 试剂盒和TRIzol 试剂(美国Invitrogen 公司),逆转录试剂盒和PCR 试剂盒(深圳晶美生物工程有限公司),PCR 引物(昆明擎科生物科技有限公司),兔抗人p21、MMP-2、E-cadherin 及PLD1 多克隆 抗体(美国Santa Cruz 公司),双荧光素酶活性检测试剂盒(美国Promega 公司),DLX6-AS1 小干扰RNA、乱序无意义阴性序列、miR-15b 模拟物、miR-15b 抑制剂及阴性序列、PLD1 过表达载体及荧光素酶报告载体(上海吉玛制药技术有限公司)。
1.3 实验方法
1.3.1 HSC3 细胞培养 复苏HSC3 细胞, 将其培养于含10 % FBS 的RPMI 1640 培养基中, 并置于37 ℃、5%CO2、97%湿度的培养箱中培养。 显微镜下观察细胞生长情况,及时更换新鲜培养基。 当培养瓶底部的细胞融合至80%左右时,0.25%胰蛋白酶溶液消化,进行传代培养。
1.3.2 细胞分组和转染 调整对数增殖期HSC3 细胞浓度为2.5×104个/mL, 以每孔2.5 mL 的量接种于6 孔板中。 待细胞融合至60%时, 参照LipofectamineTM 2000 试剂盒说明书,分别转染DLX6-AS1小干扰RNA(si-DLX6-AS1 组)、乱序无意义阴性序列 (si-NC 组)、DLX6-AS1 过表达载体(pcDNA3.1-DLX6-AS1 组)、空载体(pcDNA3.1 组)、miR-15b 模拟物(miR-15b 组)、模拟物对照(miR-NC 组)、miR-15b 抑制剂 (anti-miR-15b 组)、 抑制剂对照(antimiR-NC 组), 共 转 染DLX6-AS1 小 干 扰RNA 与miR-15b 抑制剂 (si-DLX6-AS1+anti-miR-15b 组)、DLX6-AS1 小干扰RNA 与抑制剂阴性对照(si-DLX6-AS1 +anti-miR-NC 组)、DLX6-AS1 小 干 扰RNA 与PLD1 过表达载体(si-DLX6-AS1+pcDNA3.1-PLD1 组)、DLX6-AS1 小 干 扰RNA 与 空 载 体(si-DLX6-AS1+pcDNA3.1 组)至HSC3 细胞。 转染24 h后,更换新鲜培养基。 继续培养24 h,收集细胞用于后续实验。
1.3.3 RT-qPCR 检测DLX6-AS1、miR-15b 和PLD1 mRNA 表达水平 应用TRIzol 试剂提取口腔鳞癌组织或细胞中总RNA, 微量核酸仪检测RNA 浓度和纯度后, 参照逆转录试剂盒说明书将其合成为cDNA。 然后以cDNA 为模板,进行扩增。 DLX6-AS1上游引物:5′-AGTTTCTCTCTAGATTGCCTT-3′,下游引 物:5′-ATTGACATGTTAGTGCCCTT-3′;miR-15b上 游 引 物:5′-ACACTCCAGCTGGGTTAGCAGCACATCAT-3′,下游引物:5′-CACAGCTCGTAGAACAG GAGG-3′;PLD1 上游引物:5′-GAGCCACGGGTAAA TACCTCT-3′, 下游引物:5′-CCGCGTGTCCAGATT TTCTATG-3′;GAPDH 上 游 引 物:5′-GTCACCTTCACCGTTCCAGTTTT-3′, 下游引物:5′-CTTAGTTGCGTTACACCCTTTCTT-3′;U6 上 游 引 物:5′-CTCGCTTCGGCAGCACATATACT-3′ , 下 游 引 物:5′ -ACGCTTCACGAATTTGCGTGTC-3′。PCR 扩增条件:95 ℃5 min,95 ℃10 s,60 ℃30 s,72 ℃30 s,共35 个循环。 DLX6-AS1 和PLD1 以GAPDH 为内参,miR-15b 以U6 为内参, 采用2-△△Ct法计算DLX6-AS1、miR-15b 和PLD1 mRNA 的相对表达水平。
1.3.4 MTT 法检测HSC3 细胞增殖 调整各组转染后的HSC3 细胞浓度为2.5×104个/mL,以每孔200 μL 的量接种于96 孔板中, 每组设置3 个复孔。培养48 h 后,加入20 μL 的MTT(5 g/L),继续孵育4 h。 取出培养板,将培养基吸弃后每孔加入150 μL的二甲基亚砜,振荡混匀,于酶标仪490 nm 处测定吸光度值。细胞存活率(%)=A实验组/A对照组×100%。实验重复3 次,取平均值。
1.3.5 Transwell 检测HSC3 细胞迁移和侵袭 用不含FBS 的RPMI 1640 培养基调整各组转染后的HSC3 细胞浓度为5×104个/mL。 迁移实验中,在Transwell 上室中直接加入100 μL 细胞悬液, 在下室中加入500 μL 含FBS 的RPMI 1640 培养基。 侵袭实验中, 先在Transwell 上室铺设Matrigel 基质胶, 然后加入100 μL 细胞悬液, 下室加入500 μL含FBS 的RPMI 1640 培养基。 培养48 h 后,吸弃培养基,取出上室。 经4 %多聚甲醛固定30 min,0.4%结晶紫染色15 min,棉签擦去未穿膜细胞,倒置显微镜观察,随机选取5 个视野,对穿膜细胞进行计数。
1.3.6 Western Blot 检测HSC3 细胞中p21、MMP-2、E-cadherin 和PLD1 蛋白表达 各组转染后的细胞培养48 h 后,收集细胞。 加入RIPA 蛋白裂解液,置于冰上充分裂解30 min,提取细胞中总蛋白。 用BCA 蛋白试剂盒测定蛋白浓度并进行定量。 取适量蛋白溶液,100 ℃煮沸5 min,变性后,以每泳道30 μg 上样量行十二烷基磺酸钠-聚丙烯酰胺凝胶电泳。 电泳后,将分离的蛋白湿转至聚偏乙烯二氟膜, 并于5%脱脂奶粉溶液中封闭2 h。 分别加入p21 (稀释度1∶800)、MMP-2 (稀释度1∶1 000)、Ecadherin(稀释度1∶600)和PLD1(稀释度1∶800)抗体,4 ℃孵育过夜。加入辣根过氧化物酶标记的二抗(稀释度1∶200),37 ℃下孵育1 h。 滴加增强化学发光(enhanced chemiluminescence,ECL)显影液,避光显影后,凝胶成像系统曝光拍照。
1.3.7 双荧光素酶报告基因实验 生物信息学软件预测显示,miR-15b 与DLX6-AS1 和核苷酸序列存在连续结合位点,PLD1 的3′非翻译区(3′untranslated region,3′UTR) 存在与miR-15b 结合的核苷酸序列。 PCR 分别扩增含miR-15b 结合位点的DLX6-AS1 序列及PLD1 的3′UTR 序列, 并通过基因定点突变技术将结合位点突变, 分别构建DLX6-AS1 野生型(WT-DLX6-AS1)、突变型(MUT-DLX6-AS1)和PLD1 野生型(WT-PLD1)、突变型(MUT-PLD1)荧光素酶载体。 分别将荧光素酶载体与miR-15b 模拟物或阴性对照共转染至HSC3 细胞。 转染24 h 后,收集各组细胞。 参照双荧光素酶活性检测试剂盒说明书,检测各组的荧光素酶活性。
1.4 统计学分析
SPSS 22.0 软件分析实验数据。 计量资料以均数±标准差(±s)表示。 2 组间比较采用独立样本t检验,多组间比较采用单因素方差分析,进一步两两比较采用SNK-q 检验。 以P<0.05 表示差异有统计学意义。
2 结果
2.1 口腔鳞癌组织中DLX6-AS1、miR-15b 和PLD1的表达水平
与癌旁组织比较, 口腔鳞癌组织中DLX6-AS1和PLD1 mRNA 表达水平升高 (P<0.001),miR-15b表达水平降低(P<0.001)。TNM 分期为Ⅲ~Ⅳ期的口腔鳞癌组织中的DLX6-AS1 表达水平高于Ⅰ~Ⅱ期口腔鳞癌组织(P<0.001),而miR-15b 的表达水平低于Ⅰ~Ⅱ期口腔鳞癌组织(P<0.001)。 发生淋巴结转移的患者口腔鳞癌组织中的DLX6-AS1 表达水平高于未发生淋巴结转移患者的口腔鳞癌组织(P<0.001),而miR-15b 表达水平低于未发生淋巴结转移的患者口腔鳞癌组织(P<0.001)。 详见表1、图1。
2.2 抑制DLX6-AS1 表达对HSC3 细胞活性、迁移和侵袭的影响
si-DLX6-AS1 组HSC3 细胞DLX6-AS1 表 达 水平低于si-NC 组(P<0.001),表明DLX6-AS1 小干扰RNA 转染成功,HSC3 细胞中DLX6-AS1 表达受到抑制。 与si-NC 组比较,si-DLX6-AS1 组HSC3 细胞存活率、迁移和侵袭数及MMP-2 蛋白水平降低(P<0.001),p21 和E-cadherin 蛋白水平升高(P<0.001)。详见图2。
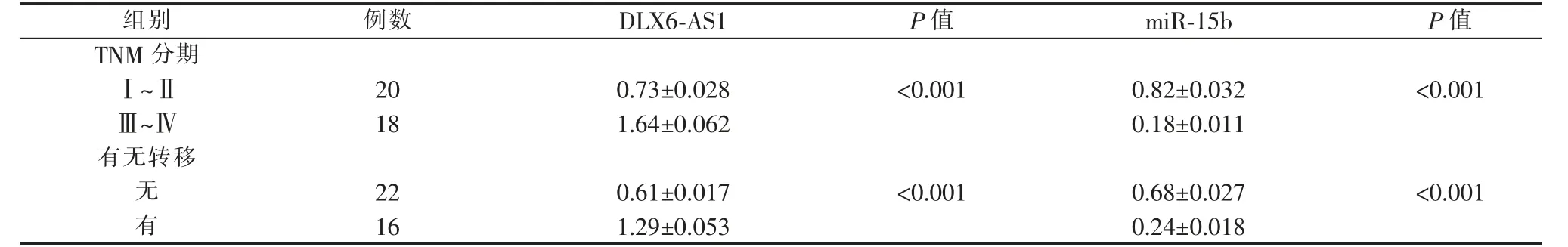
表1 DLX6-AS1、miR-15b 与临床分期及转移之间的关系Table 1 Relationship between DLX6-AS1, miR-15b and clinical stage and metastasis
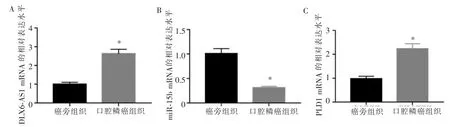
图1 口腔鳞癌组织中DLX6-AS1、miR-15b 和PLD1 mRNA 的表达水平Figure 1 Expression level of DLX6-AS1, miR-15b and PLD1 mRNA in oral squamous cell carcinoma
2.3 DLX6-AS1 靶向负调控miR-15b
生物信息学软件预测显示,DLX6-AS1 与miR-15b 的核苷酸序列存在结合位点。 双荧光素酶活性检测显示,miR-15b 模拟物可降低WT-DLX6-AS1 载体的荧光素酶活性(P<0.001), 对MUT-DLX6-AS1载体的荧光素酶活性无显著影响(P>0.05)。 pcDNA3.1-DLX6-AS1 组miR-15b 表达水平低于pcDNA3.1 组(P<0.001),si-DLX6-AS1 组miR-15b 表达水平高于si-NC 组(P<0.001)。 详见图3。
2.4 抑制miR-15b 表达降低抑制DLX6-AS1 对HSC3 细胞活性、迁移和侵袭的抑制作用
与si-DLX6-AS1+anti-miR-NC 组比较,si-DLX6-AS1+anti-miR-15b 组HSC3 细胞存活率、 迁移和侵袭数及MMP-2 蛋白表达水平升高 (P<0.001),miR-15b 及p21、E-cadherin 蛋 白 表 达 水 平 降 低 (P<0.001)。 详见图4。
2.5 过表达PLD1 降低抑制DLX6-AS1 对HSC3 细胞活性、迁移和侵袭的抑制作用
与si-DLX6-AS1+pcDNA3.1 组比较,si-DLX6-AS1+pcDNA3.1-PLD1 组HSC3 细胞存活率、迁移和侵袭数及PLD1、MMP-2 蛋白 表达水平 升高 (P<0.001),p21 和E-cadherin 蛋白表达水平降低 (P<0.001)。 详见图5。
2.6 miR-15b 靶向负调控PLD1 表达
生物信息学软件预测显示,PLD1 的3′UTR 与miR-15b 的核苷酸序列存在结合位点。 双荧光素酶活性检测显示,miR-15b 模拟物可降低WT-PLD1 载体的荧光素酶活性(P<0.001),对MUT-PLD1 载体的荧光素酶活性无显著影响(P>0.05)。 miR-15b 组PLD1 的mRNA 和蛋白水平低于miR-NC 组 (P<0.001),anti-miR-15b 组PLD1 的mRNA 和 蛋 白 水 平高于anti-miR-NC 组(P<0.001)。 详见图6。
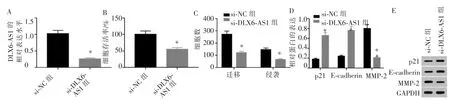
图2 抑制DLX6-AS1 对HSC3 细胞的细胞活性、迁移和侵袭及p21、E-cadherin 和MMP-2 蛋白表达的影响Figure 2 Inhibition of DLX6-AS1 on the cell activity, migration and invasion of HSC3 cells, and the expression of p21, E-cadherin andMMP-2

图3 DLX6-AS1 靶向调控miR-15bFigure 3 DLX6-AS1 targeting regulation miR-15b
3 讨论

图4 抑制miR-15b 表达降低抑制DLX6-AS1 对HSC3 细胞的细胞活性、迁移、侵袭及p21、E-cadherin 和MMP-2 蛋白表达的影响Figure 4 Inhibition of miR-15b reduces the effect of inhibition of DLX6-AS1 on cell activity, migration, invasion and expression of p21,E-cadherin and MMP-2 in HSC3 cells

图5 过表达PLD1 能减弱抑制DLX6-AS1 对HSC3 细胞的细胞活性、迁移、侵袭及p21、E-cadherin 和MMP-2 蛋白表达的影响Figure 5 Overexpression of PLD1 attenuates the inhibition of DLX6-AS1 on cell activity, migration, invasion and expression of p21, Ecadherin and MMP-2 in HSC3 cells
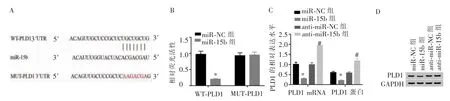
图6 MiR-15b 靶向调控PLD1Figure 6 MiR-15b targeting PLD1
近年来,lncRNA 在肿瘤中的作用受到广泛关注。 DLX6-AS1 是一种新型lncRNA。 Fang 等[12]的研究结果显示,膀胱癌组织中DXL6-AS1 表达上调,其高表达通过介导miR-223 基因沉默而上调HSP90B1 蛋白的表达,增强膀胱癌细胞的增殖和侵袭能力,促进膀胱癌发展。 Liang 等[13]的研究显示,DLX6-AS1 在胃癌组织和细胞系中表达上调, 其高表达与肿瘤T3、T4 期的侵袭、远处转移及预后不良有关。 DLX6-AS1 通过与miR-204-5p 结合并上调蛋白表达,促进了胃癌细胞增殖、迁移、侵袭和上皮间质转化, 是潜在的胃癌预后生物标志物和治疗靶标。 目前,DLX6-AS1 对口腔鳞癌复发转移的影响还未知。
本研究显示, 口腔鳞癌组织中DLX6-AS1 表达水平升高, 且其表达与患者TNM 分期及淋巴结转移情况密切相关, 提示DLX6-AS1 可能参与口腔鳞癌的发生与发展。转染DLX6-AS1 小干扰RNA 至口腔鳞癌细胞HSC3 后的结果显示, 抑制DLX6-AS1表达后,HSC3 的细胞存活率及迁移和侵袭的细胞数降低, 提示抑制DLX6-AS1 表达可抑制HSC3 细胞增殖、迁移和侵袭,是降低口腔鳞癌复发和转移的潜在分子靶点。p21 是肿瘤抑制因子,参与细胞周期的调控, 其表达增加可抑制肿瘤细胞增殖[14]。MMP-2 可降解细胞外基质和基底膜,促进肿瘤细胞的迁移和侵袭[15]。 E-cadherin 是黏附因子,其表达降低或缺失能使细胞获得侵袭性表型[16]。本研究显示,抑制DLX6-AS1 表达后,HSC3 细胞中MMP-2 蛋白表达降低,而p21 和E-cadherin 蛋白表达升高,提示抑制DLX6-AS1 表达通过下调MMP-2 蛋白表达和上调p21、E-cadherin 蛋白表达而抑制HSC3 细胞的增殖、迁移和侵袭。
生物信息学软件预测显示,miR-15b 可能是DLX6-AS1 的靶基因。 本研究通过双荧光素酶活性报告实验证实了DLX6-AS1 可与miR-15b 的核苷酸序列靶向结合。 此外,上调HSC3 细胞中DLX6-AS1表达后,miR-15b 表达降低,而下调DLX6-AS1 表达后,miR-15b 表达升高,提示DLX6-AS1 在HSC3 细胞中靶向负调控miR-15b。 本研究还显示,miR-15b在口腔鳞癌组织中表达降低,与相关研究报道结果一致[7]。抑制miR-15b 表达降低了抑制DLX6-AS1 表达对HSC3 细胞增殖、 迁移和侵袭及相关蛋白表达的影响, 提示DLX6-AS1 通过靶向上调miR-15b 表达发挥抗口腔鳞癌作用。
为了进一步探究DLX6-AS1 靶向调控miR-15b表达抑制口腔鳞癌细胞增殖、迁移和侵袭的作用机制, 本研究应用生物信息学软件预测, 结果显示PLD1 是miR-15b 的靶基因。 PLD1 参与调控细胞的增殖、侵袭等恶性生物学行为。 如Kang 等[17]的研究显示,结直肠癌细胞中PLD1 表达升高,抑制PLD1表达, 通过抑制Wnt/β-catenin 和PI3K 信号通路的激活降低结直肠癌细胞的增殖能力,是结直肠癌的潜在治疗靶点。目前,还未见PLD1 影响口腔鳞癌细胞恶性生物学行为的相关报道。 本研究显示,口腔鳞癌组织中PLD1 mRNA 表达水平升高, 提示其在该肿瘤中也发挥促癌基因作用。 本研究还显示,miR-15b 靶向负调控PLD1,过表达PLD1 降低了抑制DLX6-AS1 表达对HSC3 细胞增殖、 迁移和侵袭及相关蛋白表达的影响,提示DLX6-AS1 作为miR-15b 的内源性RNA 与miR-15b 相互作用,通过下调PLD1 表达抑制口腔鳞癌复发和转移。 然而,DLX6-AS1 下游靶miRNA 及miR-15b 下游靶mRNA 众多,进一步研究DLX6-AS1 下游miRNA/mRNA 通路是下一步的重点。
综上所述, 口腔鳞癌组织中DLX6-AS1 呈高表达, 抑制DLX6-AS1 表达可降低口腔鳞癌细胞的增殖、迁移和侵袭,其可能通过与miR-15b 相互作用进而下调PLD1 表达发挥作用,为口腔鳞癌复发、转移分子机制的阐明及治疗靶点的选择提供了新思路。
