钙粘蛋白11 在头颈部鳞癌中相关作用的研究
2020-08-19沈禹辰刘苗苗李建豪夏燕云李吉辰朴松林
沈禹辰, 刘苗苗, 李建豪, 夏燕云, 李吉辰, 朴松林
(哈尔滨医科大学附属口腔医院口腔颌面外科,黑龙江 哈尔滨 150001)
头颈部鳞状细胞癌(HNSCC)简称头颈部鳞癌,是口腔颌面部最常见的恶性肿瘤, 且发病率逐年上升。 Bray 等[1]于2018 年统计的癌症报告显示,HNSCC 全球发病人数约355 000 例, 死亡人数约177 000 例, 在美拉尼西亚的发病率最高。 诱发HNSCC 的原因众多,包括遗传倾向、化学制剂、辐射、吸烟、饮酒等[2]。 在过去的30 年里,尽管HNSCC 的治疗有了很大的改善, 但5 年生存率仍然很低,仅为50%~55%[1]。 因此,寻找HNSCC 发生、发展的潜在影响因子,帮助预测肿瘤行为和指导治疗是亟须解决的难题。
钙粘蛋白11(CDH11),也称成骨细胞钙粘蛋白,是一种Ⅱ型经典钙粘蛋白,其首次在成骨细胞中被发现, 是一种参与细胞-细胞粘附的完整膜蛋白,可能在骨的发育和维持中发挥作用[3]。 有研究表明,CDH11 在前列腺癌和乳腺癌中促进侵袭和转移,尤其是在乳腺癌中, 由于癌细胞对高度表达CDH11的成骨细胞的高亲和力, 使CDH11 促进癌细胞的骨转移[4-5]。 然而在食管癌、结直肠癌和胃癌中,CDH11 被甲基化沉默,并具有抑癌作用,能抑制食管癌和鼻咽癌细胞的侵袭和迁移[6-7]。 由于CDH11功能的差异性,在研究其对肿瘤发展过程中的影响时,需充分考虑细胞环境因素。 由于CDH11 在口腔鳞癌中的表达与功能尚不明确,所以本研究旨在通过选择性地对CDH11 进行沉默,检测HNSCC 行为及分子水平改变,进而揭示其在HNSCC 中的功能,以期为研究HNSCC 的发病机制并遏制其侵袭转移行为提供新思路。
1 材料和方法
1.1 细胞来源
UM-SCC-29 和UM-SCC-47 头颈部鳞癌细胞系均由美国密歇根大学Carey 教授馈赠;HOK16B 永生化角质形成细胞由美国加州大学洛杉矶分校的Park 博士馈赠。
1.2 主要试剂
CDH11 兔抗人单克隆抗体购自美国CST 公司(编号:A16652),E-钙粘蛋白单克隆抗体购自美国BD 公司(编号:610182),Twist-1 单克隆抗体购自美国Proteintech 公司(编号:25465-1-AP), 肌动蛋白(Actin) 单克隆抗体购自美国BD 公司 (编号:612656),RNAiMAX 转 染 试 剂 购 自 美 国Invitrogen公司, 细胞裂解液购自美国CST 公司,siRNA7 和siRNA78 均购自美国Dharmacon 公司,BCA 试剂盒购自沈阳万类生物公司。
1.3 Western 印迹法
应用细胞裂解液对细胞进行裂解,离心取得的上清液即为细胞总蛋白。 应用BCA 法测定样本蛋白浓度。应用Bio-Rad mini 4 分析系统,应用十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)快速制胶试剂盒(上海雅酶生物科技公司)进行凝胶的制备,在蛋白质样品中加入蛋白上样缓冲液,100 ℃金属浴,冰上静置3 min,上样量20 μL,并加入5 μL标志物,进行电泳。 于电转液中进行转膜。 应用含5%脱脂奶粉的封闭液慢摇1.5 h。TBST 缓冲液洗膜3 次,倒入带抗体的封闭液,过夜。TBST 缓冲液洗膜3 次,倒入带有二抗的封闭液。 TBST 缓冲液洗膜3次,应用超敏增强化学发光(enhanced chemiluminescence,ECL)试剂进行化学发光,并上机成像。
1.4 转染
为了下调HNSCC 细胞系中CDH11 的表达,我们用小干扰RNA (small interfering RNA,siRNA)对细胞系进行转染。 选取的空白对照组遵循如下序列:siNT:5′-GUGAUUUCAUAGCGAGUUU-3′; 实验组选取了2 种siRNA,分别遵循如下序列:siCDH11-7:5′-GGAAAUAGCGCCAAGUUAG-3′,siCDH11-8:5′-CCUUAUGACUCCAUUCAAA-3′。将HNSCC 细胞接种在6 孔板中, 并使用RNAiMAX 试剂盒转染siRNA。
1.5 细胞增殖检测
细胞转染后24~48 h, 细胞以等密度接种(UMSCC-29 细胞:1×104个,UM-SCC-47 细胞:2×104个)。用Countess 全自动细胞计数仪 (美国Invitrogen 公司)在第1、3、5 天对活细胞、非活细胞和总细胞进行定量。
1.6 细胞侵袭实验
细胞转染后24~72 h,将基质胶(美国BD 公司)按1∶8 稀释,包被Transwell 小室底部膜的上室面,置于37 ℃孵箱使基质胶聚合;制作细胞悬液,将200 μL 细胞悬液加入Transwell 小室,培养细胞36 h; 取出Transwell 小室, 无钙磷酸缓冲盐溶液(phosphate buffer saline,PBS)清洗2 遍,将未迁移细胞用甲醇固定, 用0.1%结晶紫染色, PBS 清洗3 遍;400 倍显微镜下随机选取5 个视野观察细胞,计数。
1.7 统计学分析
采用Image J 软件对Western 印迹法图像进行分析, 采用GraphPad prism 7.0 软件对基因间的数据进行处理。 统计学方法采用t检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 Western 印迹法
我们应用Western 印迹法对多组HNSCC 细胞系及非恶性永生化角质形成细胞 (HOK16B 细胞)进行检测。 结果显示:CDH11 在UM-SCC-29 和UMSCC-47 细胞中表达高于在HOK-16B 细胞中(图1A)。侵袭是HNSCC 的一个重要特征, 与上皮间充质转化和细胞间粘附丧失相关。 由于CDH11 在多种癌症中对侵袭、转移有不同的调节作用,我们研究了上皮间充质转化标志物的表达与CDH11 的相关性[4-8]。应用Western 印迹法对HNSCC 细胞系及角质形成细胞中的上皮标志物(E-钙粘蛋白)和间充质标志物(Twist-1)进行检测,用肌动蛋白(Actin)做对照。结果显示,与HOK16B 细胞相比,UM-SCC-29 和UM-SCC-47 细胞中E-钙粘蛋白的表达上调,而Twist-1 的表达下调(图1B)。我们猜测高水平CDH11可能促进E-钙粘蛋白的表达,抑制Twist-1 的表达。

图1 CDH11 及上皮和间充质转化标志物在HNSCC 细胞及HOK16B 细胞中的表达情况Figure 1 Expression of CDH11 and epithelial mesenchymal transformation markers in HNSCC cells and HOK16B cells
2.2 转染
我们选择了siRNA7、siRNA8,通过Western 印迹法证实其对细胞内CDH11 有下调作用 (图2A、2B)。 在降低CDH11 表达后,检测上皮和间充质标志物以确定CDH11 是否对其有负调节作用。 结果显示: 在UM-SCC-29 细胞中,Twist-1 与CDH11 表达呈负相关,而与E-钙粘蛋白表达呈正相关(图2C);在UM-SCC-47 细胞中,E-钙粘蛋白与CDH11 呈正相关,与Twist-1 表达呈显著负相关(图2D)。重要的是,在HNSCC 细胞中降低CDH11 表达后,显微镜下可以观察到细胞间粘附降低(图3)。 因此,CDH11的表达与上皮间充质转化呈负相关关系,其中包括上调上皮标志物(E-钙粘蛋白)及下调间充质标志物(Twist-1)。

图2 CDH11 被沉默后HNSCC 细胞中上皮和间充质转化标志物表达变化情况Figure 2 Changes in the expression of epithelial and mesenchymal transformation marker in HNSCC cells after CDH11 was knocked down
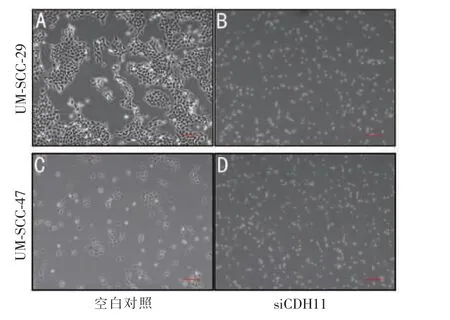
图3 转染后HNSCC 细胞形态的变化(×4)Figure 3 Changes in cell morphology after transfection of HNSCC cells(×4)
2.3 细胞增殖与侵袭实验
siRNA7、siRNA8 诱导的2 种细胞系(UM-SCC-29、UM-SCC-47)在72 h 时,增殖能力增强;在120 h时,增殖能力显著增强(图4)。侵袭是一种促进肿瘤扩散的致癌行为。 如图5A 所示,转染36 h 时,分别经siRNA7、siRNA8 沉默CDH11 后,UM-SCC-29 细胞侵袭能力均增强 (siRNA7:P<0.001,siRNA8:P<0.05); 如图5B 所示,UM-SCC-47 细胞侵袭能力均增强(siRNA7:P<0.05,siRNA8:P<0.01)。 这些发现与图2C、2D 中的结果一致, 证实了CDH11 作为HNSCC 中抑癌基因的作用。

图4 HNSCC 细胞转染后细胞增殖能力的变化Figure 4 Changes in cell proliferation after transfection of HNSCC cells
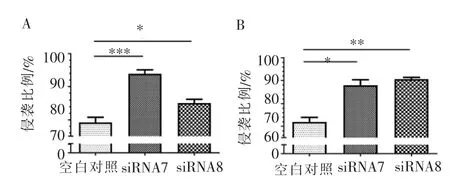
图5 HNSCC 细胞转染36 h 后细胞侵袭能力的变化Figure 5 Changes in cell invasion after transfection for 36 h of HNSCC cells
3 讨论
钙粘蛋白是一种跨膜糖蛋白,通过钙依赖性相互作用调节细胞间的亲和力[9]。 钙粘蛋白含有一个带负电荷的结构域,它可以与Ca2+结合,而钙粘蛋白家族成员间的细胞质结构域有所差异[3]。 钙粘蛋白超家族成员超过80 个,而CDH11 是钙粘蛋白超家族经典亚类的成员[3,9]。Ⅰ型经典钙粘蛋白包括:E-钙粘蛋白/钙粘蛋白1,N-钙粘蛋白/钙粘蛋白2,P-钙粘蛋白/钙粘蛋白3,R-钙粘蛋白/钙粘蛋白4,CDH11 属于Ⅱ型经典钙粘蛋白[9]。 其他钙粘蛋白包括原生钙粘蛋白、桥粒钙粘蛋白、七通道跨膜钙粘蛋白和Ret 酪氨酸激酶[9]。 经典的钙粘蛋白调节细胞间的相互作用、组织稳态和组织形态的形成。 一个细胞上的钙粘蛋白同型二聚体与另一个细胞上的同型二聚体结合形成转二聚体,促进细胞间的粘附。 鉴于这些重要作用,钙粘蛋白的破坏会引起细胞正常功能的失调,进而引发疾病的产生[10]。
CDH11 基因位于16 号染色体上[11],其与成骨细胞分化相关, 促进软骨成骨, 抑制脂肪生成[3,9]。CDH11 可以促进前列腺癌细胞的侵袭和骨转移,在结直肠肿瘤中表达上调[5,8,12]。 但Mueller 等[13]发现黑色素瘤组织中CDH11 的表达缺失。Marchong 等[6]发现CDH11 在视网膜母细胞瘤中发生基因组缺失,且其缺失与肿瘤侵袭能力增加有关。 在视网膜母细胞瘤和恶性嗜铬细胞瘤中的研究表明,CDH11 具有抑制肿瘤转移的作用[6,14]。 此外,CDH11 的表达升高一定程度上降低了肺癌的转移潜能, 并在骨肉瘤中成为了一种提示预后较好的预测因子[15]。 有关CDH11 与肿瘤关系的研究目前仍存在争议, 不同类型癌症的CDH11 致癌或抑癌功能也不尽相同。本研究中,Western 印迹法的结果显示,上皮标志物(E-钙粘蛋白) 表达水平较高, 而间充质标志物(Twist-1) 表 达 水 平 较 低 的HNSCC 细 胞 系,其CDH11 的表达水平较正常细胞有所提高,即与正常角质细胞相比,在上皮间充质转化过程尚未发生或在上皮间充质转化水平较低的HNSCC 细胞中,CDH11 呈现较高的表达水平。 在功能研究中,我们发现降低CDH11 的表达后,HNSCC 细胞上皮标志物 (E-钙粘蛋白) 的表达降低, 而间充质标志物(Twist-1)的表达升高,且出现了细胞间粘附能力降低、增殖能力增强、侵袭能力加强的表现,这充分说明了CDH11 在HNSCC 细胞中具有抑制肿瘤细胞上皮间充质转化过程的作用。 虽然在本研究中,CDH11 的表达水平升高, 但其对HNSCC 细胞系的功能影响与Mueller 等[13]、Marchong 等[6]的研究结果相一致。
综上所述, 不同种类HNSCC 细胞系的组织来源各异,如此前提到,对CDH11 的研究应考虑肿瘤细胞的来源。 本实验中的CDH11 虽在UM-SCC-29、UM-SCC-47 细胞中总体呈现高表达的趋势,但其在其他来源HNSCC 细胞系的表达情况需进一步研究。 CDH11 在调控肿瘤细胞的过程中,可能对多种不同的信号通路均有影响。 近期的研究表明,CDH11 通过调节β-连环蛋白(β-catenin)来调节经典WNT 信号通路[16],这为我们发掘CDH11 调控肿瘤尤其是HNSCC 的机制,提供了有力依据。 为了更好地利用CDH11 在肿瘤发生、发展过程中的作用,促进肿瘤生物治疗的发展, 有关CDH11 在HNSCC中发生、发展的分子机制有待进一步研究。
