茶黄素-3,3′-双没食子酸酯对骨质疏松的作用及机制初探
2020-08-19艾泽馨吴洋欧李生娇
艾泽馨, 李 家, 吴洋欧, 于 淼, 李生娇
(1. 上海牙组织修复与再生工程技术研究中心,同济大学口腔医学院·同济大学附属口腔医院口腔颌面外科教研室,2. 口腔修复教研室,上海 200072)
骨质疏松是一种全身性疾病,颌骨的骨质疏松会影响种植体与骨组织的骨结合[1-4]。 该病的预防仍是目前的难点和热点。 骨质疏松时,成骨细胞的成骨能力下降。 因此,如何促进其成骨能力一直是研究的热点。目前,骨形成的机制尚不明确。现有研究表明,影响骨形成的因素有很多,包括激素、细胞因子、转录因子、miRNA 等[5-8]。 与骨形成关系最密切的是成骨细胞,其增殖分化受多种因素影响[9-11]。 目前的研究证明氧化应激会导致成骨细胞凋亡增加,骨形成减少[12]。 另有报道证明,红茶中的茶黄素-3, 3′-双没食子酸酯(TF3)具有较强的抗氧化能力[13]。TF3 能否改善骨质疏松及其作用机制未见相关报道。 本研究建立小鼠骨质疏松模型和MC3T3-E1 细胞氧化应激模型, 探讨TF3 对骨质疏松小鼠骨丢失的作用,并对其机制进行初步探讨。
1 材料和方法
1.1 材料
MC3T3-E1 细胞 (武汉普诺赛生命科技有限公司,中国);茶黄素-3, 3′-双没食子酸酯(上海伏龙生物科技有限公司,中国);α-MEM 培养基(Hyclone 公司,美国);胎牛血清(BI 公司,以色列);胰蛋白酶(凯基公司,中国);CCK-8 试剂盒(碧云天公司,中国);DCFH-DA 荧光染料(Sigma 公司,美国);TRIzol试剂、逆转录试剂盒(Takara 公司,日本);实时荧光定量PCR(real-time quantitative polymerase chain reaction,qRT-PCR)试剂盒(翊圣公司,中国)。
1.2 药物配制
电子天平称取10 mg TF3 溶于1 150 μL 无水乙醇中, 配制得到浓度为1×104μmol/L 的储存液,避光置于-20 ℃下保存。用α-MEM 培养基将储存液分别稀释至1 μmol/L 和10 μmol/L 作为工作液,工作液避光保存于4 ℃下。
1.3 动物实验分组及Micro-CT 扫描
雌性C57BL/6J 小鼠(8 周龄)24 只,SPF 级,由上海斯莱克实验动物有限责任公司提供[生产许可证号:SCXK(沪)2017-0005]。 所有动物实验在同济大学实验动物中心进行,且获得同济大学动物伦理委员会批准。 将小鼠随机分为假手术组(Sham 组)、卵巢切除组(OVX 组)、低浓度TF3 治疗组和高浓度TF3 治疗组,每组各6 只。Sham 组仅切除卵巢周围脂肪组织, 其余组切除小鼠双侧卵巢。 术后1 周,治疗组腹腔注射TF3 (1 mg/kg 和10 mg/kg),Sham组和OVX 组腹腔注射0.9%氯化钠溶液,每周给药3 次。 连续给药3 个月后,处死小鼠, 取双侧股骨并剔净软组织, 4%多聚甲醛固定。 将各组股骨进行Micro-CT 分析。
1.4 细胞培养
MC3T3-E1 细胞于含10% 胎牛血清及1%青霉素、链霉素混合液的α-MEM 完全培养基中,培养于37 ℃、5% CO2的培养箱中。 细胞融合至80%~90%时以1∶3 的比例传代。
1.5 CCK-8 实验
细胞以2×103/孔的密度接种于96 孔细胞培养板中,24 h 后加入300 μmol/L H2O2和不同浓度的TF3(0、1、10、20、40 μmol/L)。 4 h 后去除培养液,每孔加入新鲜配制的含10 μL CCK-8 和90 μL α-MEM 培养基的液体,避光孵育2 h 后,于450 nm 波长处测量吸光度值。
1.6 建立细胞氧化应激模型
用浓度为300 μmol/L 的H2O2处理MC3T3-E1细胞4 h。 并将实验分为4 组:阴性对照组(NC 组):不做任何处理, 用α-MEM 完全培养液培养4 h;阳性对照组(C 组):加入300 μmol/L H2O2处理4 h;低浓度药物组(L 组):加入300 μmol/L H2O2和1 μmol/L TF3 处理4 h;高浓度药物组(H 组):加入300 μmol/L H2O2和10 μmol/L TF3 处理4 h。
1.7 细胞内ROS 检测
细胞以3×104/孔的密度铺于24 孔细胞培养板中,24 h 后, 按上述分组分别加入不同的处理因素作用4 h,然后去除培养液,磷酸缓冲盐溶液(phosphate buffer saline,PBS)洗3 次。 将新鲜配制的浓度为10 μmol/L 的DCFH-DA 溶液加入每孔中, 避光孵育30 min 后,去除染液,用PBS 洗3 次,在荧光显微镜下拍照。
1.8 实时荧光定量PCR 检测
细胞以1.5×105/孔的密度接种于6 孔细胞培养板中,按上述分组分别处理细胞4 h。用TRIzol 法提取细胞总RNA, 将1 μg 总RNA 逆转录为cDNA,然后进行实时荧光定量PCR 检测。 引物序列见表1。小鼠GAPDH 基因用作内参。
1.9 统计分析
所有数据均使用SPSS 20.0 进行分析, 使用的统计学方法是单因素方差分析。P<0.05 被认为差异具有统计学意义。
2 结果
2.1 TF3 对股骨骨小梁丢失的作用
为了检测TF3 对骨质疏松的作用,我们建立了OVX 骨质疏松小鼠模型。 Micro-CT 分析结果表明,TF3 可以减少OVX 引起的骨小梁丢失,并随剂量增加,效果越明显(图1)。

表1 引物序列Table 1 Primers sequence
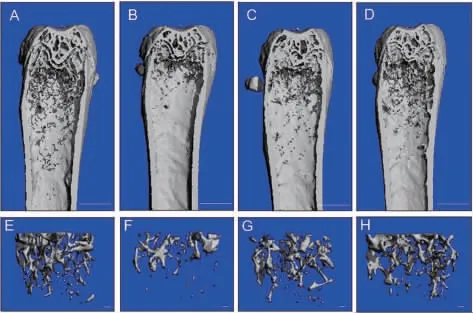
图1 Micro-CT示TF3 对小鼠股骨骨小梁丢失的作用Figure 1 Micro-CT images showing the effect of TF3 on the loss of femoral trabecular bone
2.2 TF3 对MC3T3-E1 细胞活性的作用
结合文献[14],用300 μmol/L H2O2处理MC3T3-E1细胞4 h 可建立氧化应激模型。 我们在此基础上检测了不同浓度的TF3(0 、1、10、20、40 μmol/L)对细胞活性的影响。 结果表明,20 μmol/L 以下的TF3 不会影响细胞的活性(图2)。根据实验结果,我们分别选择了1、10 μmol/L 作为后续实验的药物浓度。
2.3 TF3 对细胞内ROS 的作用
为了检测TF3 对H2O2诱导的MC3T3-E1 细胞内ROS 的产生情况,我们使用DCFH-DA 荧光染料检测细胞内ROS 的水平。 结果表明,与NC 组相比,H2O2显著增加了细胞内ROS 的产生, 而TF3 处理组(L 组和H 组)细胞内ROS 的水平显著降低,且随TF3 浓度增高,效果越明显(图3)。
2.4 TF3 对细胞抗氧化基因表达的作用
为了阐明TF3 减少ROS 的原因, 我们从基因水平方面研究了TF3 的作用机制。 结果显示,TF3可以提高抗氧化基因Nrf2 的表达水平,并增加其下游基因HO-1、CAT 的表达, 并随着TF3 浓度增加,效果越明显(图4)。
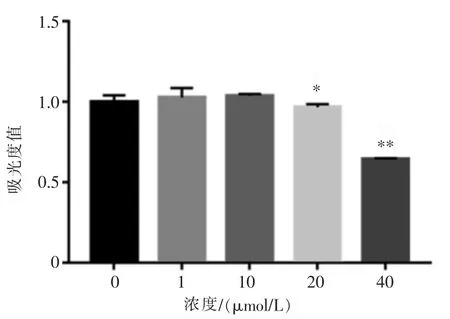
图2 TF3 对细胞活性的影响Figure 2 The effect of TF3 on cell viability

图3 TF3 对细胞内ROS 的作用(×100)Figure 3 The effect of TF3 on intracellular ROS (×100)
3 讨论
TF3 是红茶中的主要成分,具有抗炎、抗氧化等多种药理活性[15-16]。 TF3 可以通过抑制ROS 的产生减少破骨细胞的形成,抑制骨吸收[17-19]。 细胞内ROS的含量受到转录因子Nrf2 的调控, 当细胞内ROS升高时,胞质中的Nrf2 进入细胞核,与抗氧化反应元件(antioxidant responsive element,ARE)结合[20-22],促进下游抗氧化酶的表达, 进而清除过多的ROS。有关TF3 对骨质疏松的作用及作用机制, 目前尚未见报道。
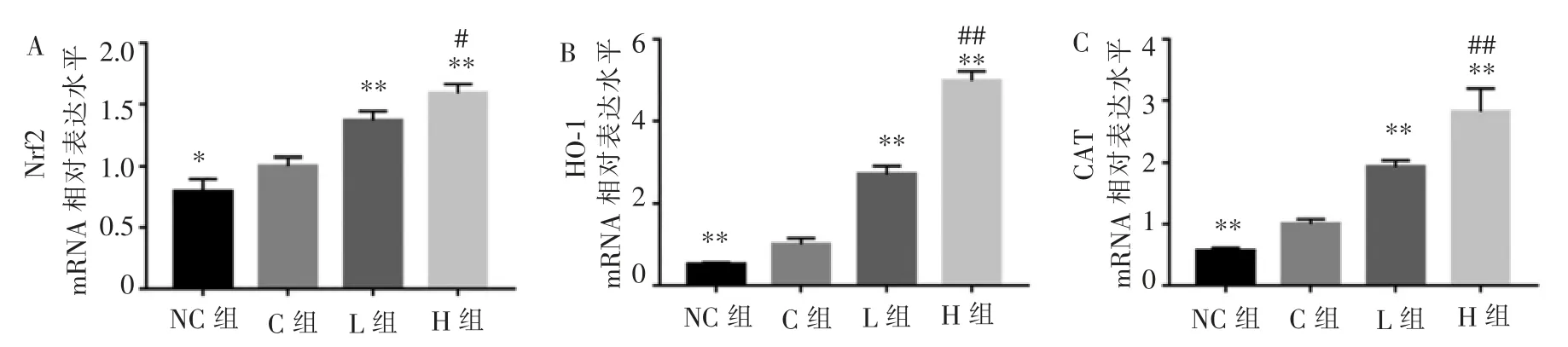
图4 TF3 对细胞抗氧化基因表达的作用Figure 4 The effect of TF3 on antioxidant gene expression
OVX 骨质疏松模型是一种能很好地模拟因雌激素减少引起骨质疏松的经典模型。 雌性动物卵巢被切除后,雌二醇水平降低,模拟了绝经后妇女的高转换型骨质疏松状态。 这类模型成功率高、重复性好、适用范围广。 因此,我们建立了小鼠OVX 模型以检测TF3 在小鼠体内对骨质疏松的预防作用。 股骨Micro-CT 分析结果显示, 注射3 个月TF3 后,OVX 引起的骨小梁丢失程度可以降低,治疗组骨小梁的数目和体积明显大于OVX 组, 且随着TF3 剂量的增加,这种预防作用更加明显。
为了进一步探讨TF3 预防骨质疏松的原因,我们使用前成骨细胞系MC3T3-E1 进行机制部分的探讨。骨质疏松时,细胞内ROS 水平增加,细胞处于氧化应激状态, 可影响成骨细胞的增殖和功能[14,23-25]。因此本实验用H2O2建立了细胞氧化应激模型,研究TF3 对细胞氧化应激的作用及机制。 CCK-8 实验结果与既往研究结果不同, 可能与细胞类型不同、处理时间不同有关。 DCFH-DA 染色结果显示,经H2O2处理后, 能够建立较为成功的氧化应激模型,这与以往的研究结果一致[14]。 TF3 在H2O2诱导的细胞氧化应激过程中确实发挥了抗氧化作用,减少了细胞内ROS 的产生, 对H2O2诱导的MC3T3-E1 细胞的氧化损伤具有保护作用。由于Nrf2 在抗氧化过程中发挥了重要作用,我们进一步检测了抗氧化基因的表达。 qRT-PCR 结果表明,TF3 可以促进Nrf2及其下游基因HO-1、CAT 的表达,清除细胞内过多的ROS。
综上所述,TF3 可能通过增加抗氧化基因Nrf2、HO-1 及CAT 的表达,清除过多的ROS,发挥抗氧化作用,保护细胞免受氧化应激损伤,从而抑制OVX骨质疏松小鼠股骨的骨小梁丢失,这可为骨质疏松的预防和治疗提供潜在的靶点。 关于TF3 影响成骨分化的具体机制尚有待于进一步研究。
