黄芩苷通过调控c-Myc介导的细胞周期抑制胆管癌细胞增殖
2020-08-17徐杨肖斌魏嵋代荣阳向远彩
徐杨,肖斌,魏嵋,代荣阳,向远彩△
胆管癌(cholangiocarcinoma,CCA)是一种恶性胆管上皮性瘤[1]。近年来,CCA 的发病率在全球范围内逐步攀升[2]。目前,手术切除是临床治疗CCA的主要手段,但仅对早期患者有效。由于胆管特殊的解剖学位置、检测手段局限以及发病隐匿等因素,导致大部分患者发病时已处于不宜手术的中晚期,所以局部或全身化疗仍是这类人群的主要治疗方式。目前,化疗对CCA的治疗效果不甚理想,因此,亟待寻找新的治疗CCA的有效方法。
天然药物对机体的不良反应小,且具有抗肿瘤细胞突变、促进肿瘤DNA损伤以及抑制肿瘤细胞增殖等特点,在治疗肿瘤方面具有较大的潜力,近几年逐渐成为抗肿瘤领域的研究热点[3]。黄芩苷(Baicalin,BC)又名贝加灵,是从植物黄芩的根中提取的一种重要的黄酮类化合物[4],对肝癌、胃癌和乳腺癌等肿瘤具有显著的抑制作用[5]。深入研究发现,BC 可通过降低肿瘤细胞转移抑制肿瘤生长[6]。然而,BC对CCA的作用及机制尚不明确。本研究以人源CCA 细胞QBC939 和RBE 为研究对象,探究黄芩苷对CCA细胞增殖的影响及其潜在机制。
1 材料与方法
1.1 材料与试剂 CCA细胞QBC939和RBE(北纳创联生物科技有限公司,中国);RPMI-1640 培养基(Gibco 公司,美国);胎牛血清(Biological Industries 公司,以色列);黄芩苷单体(Sigma-Aldrich公司,德国);CCK-8试剂盒、细胞周期与凋亡检测试剂盒、RIPA细胞裂解液、BCA蛋白定量试剂盒、100 U/mL 青霉素和0.1 g/L 链霉素混合溶液(上海碧云天生物技术有限公司,中国);0.2 μm 硝酸纤维素膜(GE Healthcare 公司,英国);兔抗周期素依赖激酶抑制剂(cyclin-dependent kinase inhibitor,p27)单克隆抗体、兔抗细胞周期蛋白D1(cyclin protein D1,Cyclin D1)单克隆抗体、兔抗原癌基因蛋白质(proto-oncogene proteins,c-Myc)单克隆抗体、鼠抗内参β-actin单克隆抗体、辣根过氧化物酶标记的山羊抗兔及山羊抗鼠 IgG 二抗、RNA 干扰阴性对照(siRNA-Negative Control,si-NC)及 c-Myc 干扰 RNA(siRNA-c-Myc,si-c-Myc,货号6552S,Cell Signaling Technology 公司,美国);Lipofectamine™3000转染试剂盒(赛默飞公司,美国);多功能酶标仪(伯腾仪器有限公司,美国);流式细胞仪(BD Bioscience公司,美国);红外成像仪(Odyssey公司,美国)。
1.2 细胞培养及干预 将QBC939 和RBE 细胞置于37 ℃恒温培养箱(95%湿度,5%CO2)中,并用RPMI-1640 完全培养基(10%胎牛血清+1%青霉素和链霉素溶液)培养,取对数生长期细胞,将其接种于60 mm 培养皿中生长,当细胞汇合度达到80%时进行实验。黄芩苷单体经二甲基亚砜(DMSO)稀释至200 mmol/L后,放置-20 ℃储存。药物处理时,弃掉培养皿中的培养基,更换为含相应浓度黄芩苷的新鲜培养基,然后置于培养箱24 h后提取蛋白进行后续实验。
1.3 CCK-8法检测CCA细胞增殖活性 参照CCK-8试剂盒说明书,96孔板中接种细胞悬液(每孔100 μL,约1×104个细胞),置于恒温培养箱中培养24 h。(1)黄芩苷对CCA 细胞增殖活性影响实验。设置空白对照组(仅含培养基)、对照组(0 μmol/L 的黄芩苷)和6 个实验组(12.5、25、50、100、200、400 μmol/L黄芩苷),每组设置4个复孔,随后用完全培养基将黄芩苷母液稀释成相应浓度,并以100 μL/孔替换实验组原培养基。(2)敲低c-Myc 对CCA 细胞增殖活性影响实验。设置空白对照组、对照组(si-NC)和3 个实验组(BC、si-c-Myc、BC+si-c-Myc),根据组别分别使用BC和si-c-Myc处理细胞。待培养24 h 后,弃掉培养基,每孔加入100 μL 检测混合液(90 μL 培养基+10 μL CCK-8 溶液),置于37 ℃温育2 h。在酶标仪上设置对应孔位,读取450 nm的吸光度(A)。计算细胞存活率(%)=[A(实验)-A(空白)]/[A(对照)-A(空白)]×100%。并绘制生长柱状图。实验重复3次。
1.4 显微镜观察细胞生长 6 孔板中接种细胞悬液(每孔2 mL,约2×105个细胞),置于恒温培养箱24 h,待细胞汇合度达70%时,用 50、100 和 200 μmol/L 黄芩苷培养 24 h 后,在高倍显微镜下观察细胞生长状态并拍照。
1.5 流式细胞术检测细胞周期 用DMSO(0.1%)和黄芩苷(200 μmol/L)处理QBC939 和 RBE 细胞24 h 后,弃掉原培养基,用预冷的磷酸缓冲盐溶液(PBS)清洗2 次。然后加入适量胰酶消化液,数秒后,用适量的完全培养基终止消化,并将细胞收集到离心管中,1 000 r/min离心5 min,弃上清,再加入1 mL 预冷的PBS 后离心,重复清洗2 次,去除残留的胰酶。随后加入适量预冷的70%乙醇,轻轻吹打细胞。置于-20 ℃固定过夜。次日,经1 000 r/min离心5 min后弃上清,用预冷的PBS 清洗2 次去除残留乙醇,然后按照试剂盒细胞周期检测的操作步骤操作并上机检测。实验重复3次。
1.6 细胞转染 当QBC939 和RBE 细胞生长到70%汇合度时,用Lipofectamine 3000转染试剂瞬时转染si-NC、si-c-Myc(50 nmol/L),8 h 更换含10%胎牛血清的RPMI-1640 培养液继续培养16 h,再用200 μmol/L的黄芩苷处理细胞。
1.7 蛋白免疫印迹(Western blot)实验检测p27、Cyclin D1及c-Myc蛋白表达 用RIPA细胞裂解液裂解细胞,超声破碎3次(5 s/次),随即冰上放置30 min,12 000 r/min 离心15 min。取上清,采用BCA 法进行蛋白定量。取等量的蛋白样品(50 μg),并加入1/3体积的蛋白上样缓冲液,涡旋混匀后,放置金属浴中100 ℃变性10 min,然后置于冰上冷却。将制备好的样品用10%十二烷基苯磺酸钠-聚丙烯酰胺凝胶电泳(SDSPAGE)分离蛋白(80~120 V),随后湿转至硝酸纤维素膜(NC)上,并用5%脱脂牛奶封闭1 h,然后用0.5%TBST清洗3次(5 min/次)。截取不同位置的条带并用相应的蛋白一抗,p27(1∶2 000)、Cyclin D1(1∶2 000)、c-Myc(1∶2 000)、β-actin(1∶5 000),于4 ℃孵育过夜。待孵育完成后,用TBST 清洗3次(每次5 min),随后分别加入相应的辣根过氧化物酶标记的山羊抗兔IgG二抗(1∶10 000)和辣根过氧化物酶标记的山羊抗鼠IgG二抗(1∶10 000),在室温避光孵育1 h。最后再用TBST 清洗3 次,并用Odyssey 红外成像系统显色曝光。各条带的灰度值用Image J软件进行分析。实验重复3次。
1.8 统计学方法 采用GraphPad Prism 5.0统计软件分析完成。符合正态分布的计量资料以均数±标准差()表示,2组间均数比较采用两独立样本t检验,多组间均数比较采用单因素方差分析,组间多重比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 黄芩苷抑制CCA 细胞增殖活性 CCK-8 实验结果显示,与 0 μmol/L 组相比,12.5、25、50、100、200、400 μmol/L 黄芩苷处理组的 QBC939 和 RBE 细胞的存活率降低,见图1A、B。在高倍显微镜下观察发现,随着黄芩苷处理组浓度的增加,QBC939 和RBE 细胞的生长速度明显变缓,这在200 μmol/L 处理组中尤为明显,见图1C、D。由此,选取200 μmol/L黄芩苷作为后续实验的给药浓度。
2.2 黄芩苷阻滞CCA 细胞的细胞周期 流式细胞术结果显示,与0 μmol/L组相比,200 μmol/L黄芩苷处理细胞24 h后,QBC939细胞的S期细胞比例明显增加,但对RBE细胞周期没有明显影响,见图2A、B。Western blot 进一步检测发现,黄芩苷可显著性下调S 期辅助性的周期蛋白Cyclin D1,并上调周期素依赖激酶抑制剂p27的蛋白水平,见图2C、D。
2.3 黄芩苷抑制c-Myc 蛋白表达 Western blot 结果显示,与 0 h 组相比,12 h 和 24 h 200 μmol/L 黄芩苷处理QBC939和RBE 细胞后可显著降低c-Myc 的蛋白表达,且处理时间越长,抑制作用越明显,见图3A、B。此外,不同浓度的黄芩苷处理细胞24 h后,与0 μmol/L 组相比,50、100、200 μmol/L c-Myc 的蛋白表达明显减少,见图3C、D。
2.4 黄芩苷通过抑制c-Myc 降低CCA 细胞增殖活性 Western blot结果显示,与对照组相比,用siRNA敲低QBC939和RBE细胞中的c-Myc后,p27蛋白的表达水平明显增加,同时Cyclin D1 显著下调,这与黄芩苷处理时的变化一致。此外,与单独的黄芩苷处理组相比,敲低c-Myc 联合黄芩苷处理后,p27 蛋白的表达显著增加,Cyclin D1 蛋白的表达明显减少(均P<0.05),见图4A、B。并且,细胞增殖活性检测也发现,单独敲低c-Myc 后可明显抑制QBC939 和RBE 细胞的存活率;敲低c-Myc 与黄芩苷联用时,2种细胞的存活率(%)与单独敲低c-Myc组相比均进一步降低(均P<0.05),见图4C、D。
3 讨论
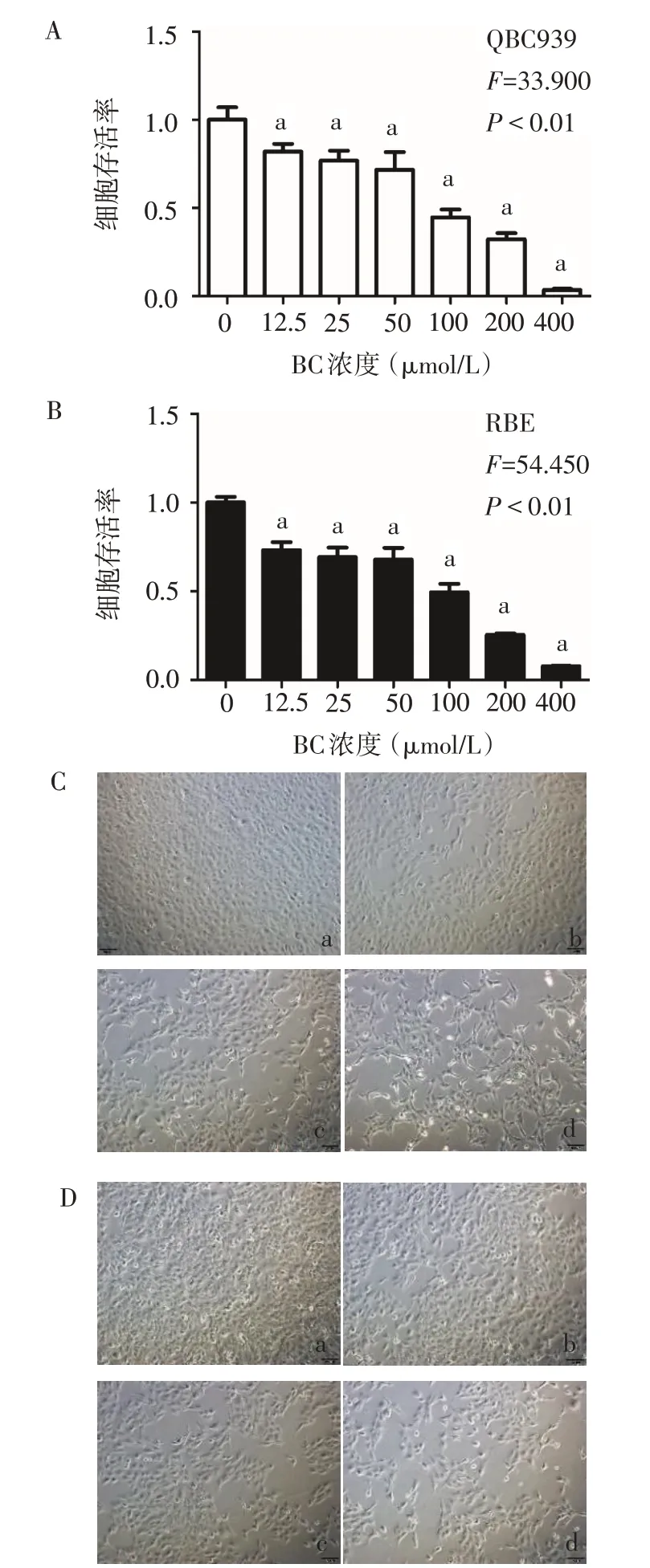
Fig.1 Effectsofbaicalinontheproliferationofcholangiocarcinomacells图1 黄芩苷对胆管癌细胞增殖的影响
3.1 CCA 的研究现状 CCA 是一种胆管上皮的恶性实体瘤,起病隐匿,且易发生转移[7]。CCA的发病机制常与年龄偏高、胆管结石、慢性胆管炎、肝炎、肝硬化、吸烟、化学毒素及寄生虫感染等相关[8]。当前最常用的化疗手段是顺铂与吉西他滨联合治疗,但大范围使用不仅会引起肿瘤耐药性,而且对患者肝肾等器官有较大的损害。即便如此,患者的平均生存期仍不超过21.4个月[9]。本文探究了天然黄酮类化合物黄芩苷对CCA 细胞的作用,结果显示黄芩苷能显著抑制2种CCA细胞的增殖活性。
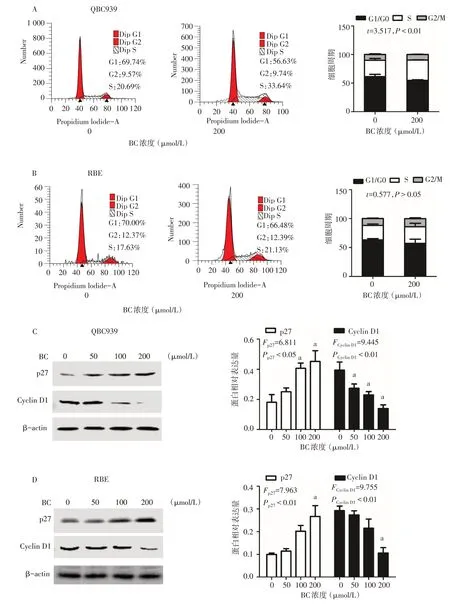
Fig.2 Effects of baicalin on the cell cycle of cholangiocarcinoma cells图2 黄芩苷对胆管癌细胞周期的影响
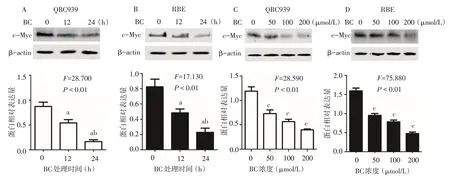
Fig.3 Effects of baicalin on the expression of c-Myc protein of cholangiocarcinoma cells图3 黄芩苷对胆管癌细胞中c-Myc蛋白表达的影响

Fig.4 Effects of baicalin on the protein expression of cell cycle and survival rate through inhibiting the protein expression of c-Myc图4 黄芩苷抑制c-Myc蛋白表达对周期蛋白表达及细胞存活率的影响
3.2 黄芩苷阻滞CCA细胞周期 镜下观察到黄芩苷可抑制CCA 细胞生长,提示黄芩苷可能抑制细胞周期进程。本研究采用Western blot检测周期相关蛋白,发现黄芩苷可调节Cyclin D1与p27的蛋白表达水平,提示黄芩苷可能阻滞CCA 细胞周期。早期的研究揭示Cyclin D1 与S 期进程受阻有关[10]。为进一步明确黄芩苷对CCA细胞周期的影响,本研究流式细胞术结果显示,黄芩苷处理后QBC939细胞的S期细胞比例增多。上述结果表明Cyclin D1 及p27 蛋白的改变可能与S 期的阻滞有关,这与 Zhu 等[11]报道的黄芩苷下调 Cyclin D1 导致人胶质母细胞瘤细胞U87 和U251 的细胞周期S期停滞的结果相似。此外,流式细胞术结果显示,黄芩苷不影响CCA 细胞S 期向G2 期过渡,而是促进QBC939细胞由G1期进入S期,对RBE细胞周期进程无影响,这可能与2种细胞的遗传背景不同有关[12]。然而,黄芩苷处理后2种细胞的增殖活性下降,推测黄芩苷可能通过调控如S期激酶相关蛋白2等使处理的细胞过早地由G1期进入S期,从而导致细胞内的功能紊乱,最终抑制细胞增殖[13]。以上结果说明黄芩苷可通过调控周期相关蛋白影响CCA细胞的周期进程。
3.3 黄芩苷通过下调c-Myc蛋白表达调控CCA细胞周期蛋白 细胞内如c-Myc 等一系列重要的癌基因在细胞生长的调控中起重要作用。本研究显示,敲低c-Myc后影响了周期蛋白Cyclin D1与p27的表达,且显著抑制细胞增殖,这提示黄芩苷确实可以通过c-Myc 调控CCA 细胞周期。已有研究表明c-Myc 的下调可降低QBC939 细胞的体外侵袭性[14]。近期研究也显示,用c-Myc辅助转录激活因子抑制剂JQ1 抑制c-Myc 的功能后可有效地阻止CCA 异种移植瘤的生长[15]。本课题组前期实验也发现 CCA 的发生与 c-Myc 蛋白失调密切相关[16]。这些证据提示c-Myc 可能是黄芩苷抑制CCA 细胞增殖的靶基因,但黄芩苷如何下调c-Myc,以及体外针对CCA 治疗的效果如何等方面仍不明确,有待进一步研究。
综上所述,黄芩苷可通过下调c-Myc调控CCA细胞周期蛋白,进而降低细胞增殖活性,这将为寻找CCA治疗的新方法提供理论依据。
