下调TMEM97对卵巢癌细胞SKOV3增殖、凋亡的影响及其相关机制探讨
2020-08-17刘晋芳徐小燕周儒奎徐慧超高艳苗宇船
刘晋芳,徐小燕,周儒奎,徐慧超,高艳,苗宇船△
卵巢癌是常见的妇科恶性肿瘤,发病率较高[1]。全球每年约40 万女性因卵巢癌死亡,因其发病隐匿,早期症状不明显,多数患者就诊时已属晚期且难以治愈,5年生存率仅50%[2]。随着分子生物学技术的不断进步,针对卵巢癌细胞增殖、凋亡、细胞周期、浸润、迁徙、血管生长等分子生物靶点提出的靶向治疗成为卵巢癌诊断治疗的重点和热点[3]。跨膜蛋白97(transmembrane protein 97,TMEM97)又名脑膜瘤相关蛋白或MAC30,由Murphy等1993年在分析脑膜瘤相关蛋白表达差异时发现并提出[4]。研究表明TMEM97 mRNA及蛋白在人类多种肿瘤中表达水平不同,在胰腺癌和肾癌中表达量较低,在卵巢癌、食管癌、胃癌和结肠癌中表达较高[5]。但目前关于TMEM97在卵巢癌发生发展中的具体作用鲜有报道。本文检测了下调TMEM97后卵巢癌细胞SKOV3的增殖、凋亡能力及其相关因子表达的变化,以期为卵巢癌的早期诊断及治疗提供理论与实验依据。
1 材料与方法
1.1 实验材料 实验所用卵巢癌细胞株SKOV3购自中国科学院上海细胞培养中心。RPMI 1640 培养基购于Hyclone 公司,双抗、胎牛血清、CCK-8 试剂盒、Annexin V-FITC 凋亡检测试剂、细胞周期检测试剂盒、胰酶、BCA试剂盒购自中国南京凯基生物公司。TMEM97 siRNA、阴性对照siRNA 均由中国广州锐博生物科技有限公司合成。Opti-MEM 培养基、Lipo3000、Trizol、实时荧光定量PCR(qPCR)相关试剂、HRP标记的山羊抗兔IgG 均购自中国北京索莱宝科技公司;TMEM97、B淋巴细胞瘤-2基因(Bcl-2)、Bcl-2相关X蛋白质(Bax)、P38 丝裂原活化蛋白激酶(P38 mitogen-activated protein kinase,P38 MAPK)通路相关蛋白(P38/MAPK、p-P38/MAPK)抗体均购自美国Sigma 公司;β-actin 抗体购自美国Abcam公司。qPCR仪均购自德国Biometra公司;电泳仪和凝胶成像系统均购自美国Bio-Rad 公司;多功能酶标仪购自美国Thermo Scientific 公司;倒置显微镜购自日本Olympus 公司;流式细胞仪购自美国Beckman公司。
1.2 方法
1.2.1 细胞培养及转染 卵巢癌细胞系SKOV3 用含有10%胎牛血清、1%双抗的RPMI 1640,37 ℃、5%CO2、饱和湿度的环境下培养,当细胞融合度达到80%时传代。将卵巢癌细胞SKOV3分为转染组(si-TMEM97组)、阴性对照组(siNC组)和空白对照组(Control组),前两组均于细胞融合度达60%时进行转染,Control组不作处理。si-TMEM97组细胞转染浓度为100 nmol/L 的siRNA-TMEM97(si-TMEM97)。干扰序列:上游 5′-GAAGCUGCUGCUAAAGCAUUU-3′,下游 5′-AUGCUUUAGCAGCAGCUUCUU-3′。siNC 组细胞转染相应浓度的阴性空白无意义的siRNA(siNC),干扰序列:上游5′-UUCUCCGAACGUGUCACGUTT-3′ ,下 游 5′-ACGUGACACGUUCGGAGAATT-3′。按照试剂说明书要求,将Opti-MEM培养基、si-RNA、Lipo3000混合物加入不含血清的RPMI1640培养基中,6 h后更换10%的胎牛血清培养基。
1.2.2 qPCR检测TMEM97的mRNA表达变化 SKOV3细胞转染siRNA-TMEM97 48 h后,用Trizol提取SKOV3细胞中的总RNA,将1 μg总RNA加入20 μL混合反应体系中进行反转录。PCR 扩增的寡核苷酸引物:TMEM97 上游5′-ACTGCTCAGAACCCACGTCT-3′,下 游 5′-ATCATGCCACTGCCCTTTAC-3′;β-actin 上游 5′-GGAAATCGTGCGTGACATTA-3′,下游 5′-GGAGCAATGATCTTGATCTTC-3′。PCR 反应体系的扩增条件:94 ℃变性45 s,55 ℃退火45 s,72 ℃延伸45 s,循环40 次。按照qPCR 检测试剂盒说明书进行实验,整个操作注意避光,并在冰上进行。PCR 扩增反应结束后得到扩增曲线和 Ct 值,结果用 2-ΔΔCt值表示。ΔΔCt=(Ct目的基因-Ct管家基因)实验组-(Ct目的基因-Ct管家基因)对照组。以上实验均重复3次。
1.2.3 Western blot 检测TMEM97、Bcl-2、Bax、P38/MAPK、p-P38/MAPK 的表达变化 SKOV3 细胞转染siRNA-TMEM97 72 h 后,BCA 试剂盒提取SKOV3 细胞总蛋白,并测定蛋白浓度。10%聚丙烯酰胺凝胶电泳跑胶并转膜。用5%脱脂奶粉室温封闭2 h,一抗4 ℃冰箱孵育过夜(TMEM97 一抗稀释比例为1∶2 500;Bcl-2、Bax、p-P38/MAPK、P38/MAPK 一抗稀释比例均为1∶2 000;β-actin 一抗稀释比例为1∶1 000),PBS洗膜,二抗(1∶1 000)进行室温孵育,用ECL发光试剂显影。使用Image J软件分析条带的灰度值。以上实验均重复3次。
1.2.4 细胞增殖能力检测 使用CCK-8 试剂盒观察下调基因TMEM97对细胞增殖的影响。将SKOV3细胞接种到96孔板中,24 h后换100 μL新鲜培养基。siRNA-TMEM97或阴性对照siRNA以100 nmol/L的浓度转染细胞。分别于转染后的0、24、48、72 和 96 h 向细胞培养液中加入 10 μL 的 CCK-8 溶液,再孵育2 h,在450 nm处检测光密度(OD)值,计算细胞活力。以上实验均重复3次。
1.2.5 细胞周期检测 收集处于对数生长期的卵巢癌细胞SKOV3 悬液,调整细胞密度为1.5×105个/mL,铺于6 孔板中,每孔2 mL。siRNA-TMEM97或阴性对照siRNA以100 nmol/L的浓度转染细胞。48 h后离心,收集细胞,弃上清,PBS 清洗3次,并用预冷的70%乙醇在4 ℃固定过夜,再离心并收集细胞,清洗重悬之后,加入50 mg/L RNA酶和100 mg/L PI染液,300 目滤网过滤后,流式细胞仪检测SKOV3 细胞周期的变化。以上实验均重复3次。
1.2.6 细胞凋亡检测 将SKOV3 细胞接种至12 孔板中,siRNA-TMEM97或阴性对照siRNA以100 nmol/L的浓度转染细胞。48 h后收集细胞,按照Annexin V-FITC细胞凋亡检测试剂盒说明书进行操作,使用流式细胞术检测细胞凋亡的变化。以上实验均重复3次。
1.3 统计学方法 采用SPSS 20.0 统计学软件进行数据分析。符合正态分布的计量资料用均数±标准差()表示,多组间比较采用单因素方差分析,组间多重比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 siRNA-TMEM97 转染后TMEM97 基因和蛋白的表达变化 qPCR 和Western blot 检测结果显示,si-TMEM97 组能够明显抑制TMEM97 mRNA 的表达,且TMEM97 的蛋白表达水平显著降低(P<0.01),而Control组和siNC组中TMEM97 mRNA和蛋白水平差异均无统计学意义,见图1、表1。
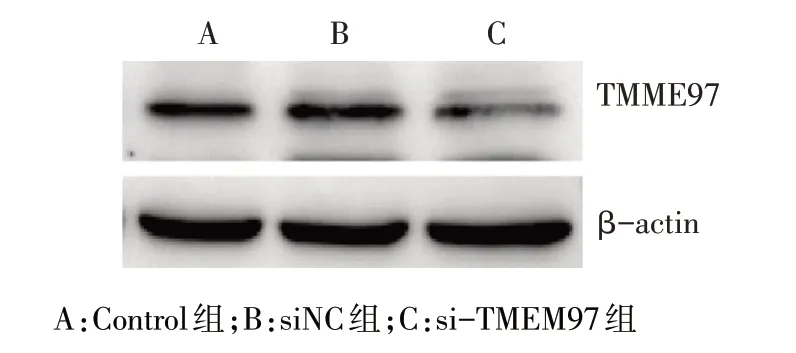
Fig.1 Expressions of TMEM97 after transfection in SKOV3 cells图1 转染后TMEM97在SKOV3细胞中的表达
Tab.1 Relative expression levels of TMEM97 after transfection in three groups表1 3组转染后TMEM97 mRNA和蛋白的相对表达量(n=3,)

Tab.1 Relative expression levels of TMEM97 after transfection in three groups表1 3组转染后TMEM97 mRNA和蛋白的相对表达量(n=3,)
**P<0.01;a 与 Control 组比较,b 与 siNC 组比较,P<0.01;表2、3同
组别Control组siNC组si-TMEM97组F TMEM97 mRNA 1.03±0.02 0.95±0.07 0.48±0.04ab 115.232**TMEM97蛋白0.98±0.03 0.88±0.02 0.35±0.05ab 294.160**
2.2 siRNA-TMEM97 转染后SKOV3 的增殖能力变化 CCK-8检测结果显示,相比于Control 组和siNC组,si-TMEM97组24、48、72和96 h细胞活力显著下降(P<0.01),而Control 组和siNC 组间细胞活力变化差异无统计学意义,下调TMEM97 的表达能明显抑制卵巢癌SKOV3细胞的增殖能力,见表2。
2.3 siRNA-TMEM97 转染后对SKOV3 细胞周期的影响 细胞周期分析结果显示,相比于Control 组和siNC 组,si-TMEM97 组G1 期的细胞比例减少(P<0.01),而G2/M期的细胞比例明显增加(P<0.01),细胞周期阻滞于G2/M 期,下调TMEM97 的表达对SKOV3细胞具有细胞周期的阻滞效应,见图2、表3。
Tab.2 Effects of siRNA-TMEM97 transfection on the proliferation of SKOV3 cells表2 转染siRNA-TMEM97对3组SKOV3细胞增殖能力的影响 (n=3,OD值,)
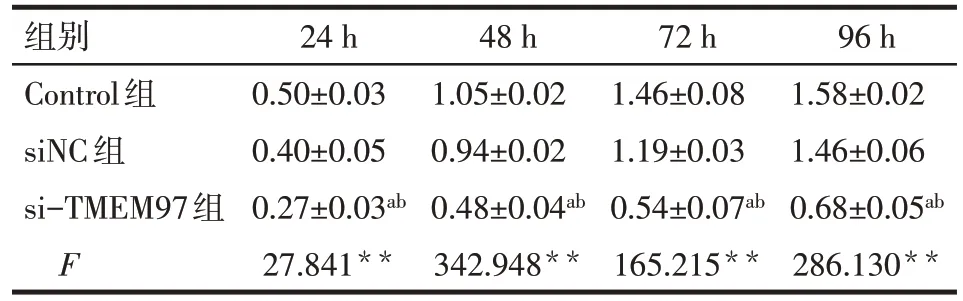
Tab.2 Effects of siRNA-TMEM97 transfection on the proliferation of SKOV3 cells表2 转染siRNA-TMEM97对3组SKOV3细胞增殖能力的影响 (n=3,OD值,)
组别Control组siNC组si-TMEM97组F 24 h 0.50±0.03 0.40±0.05 0.27±0.03ab 27.841**48 h 1.05±0.02 0.94±0.02 0.48±0.04ab 342.948**72 h 1.46±0.08 1.19±0.03 0.54±0.07ab 165.215**96 h 1.58±0.02 1.46±0.06 0.68±0.05ab 286.130**
Tab.3 Effects of siRNA-TMEM97 transfection on cell cycle distribution in SKOV3 cells表3 转染siRNA-TMEM97对3组SKOV3细胞周期的影响 (n=3,%,)
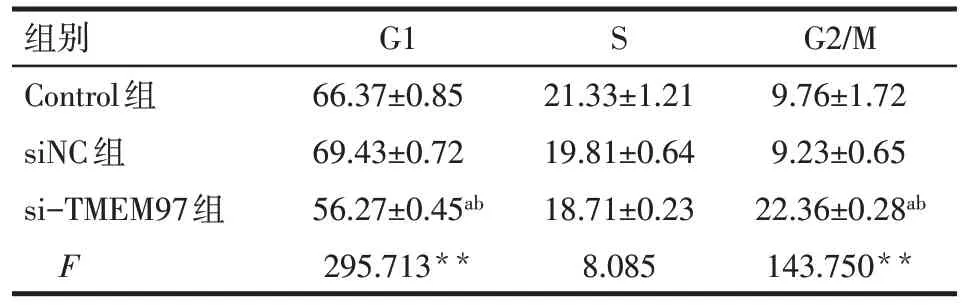
Tab.3 Effects of siRNA-TMEM97 transfection on cell cycle distribution in SKOV3 cells表3 转染siRNA-TMEM97对3组SKOV3细胞周期的影响 (n=3,%,)
组别Control组siNC组si-TMEM97组F G1 66.37±0.85 69.43±0.72 56.27±0.45ab 295.713**S 21.33±1.21 19.81±0.64 18.71±0.23 8.085 G2/M 9.76±1.72 9.23±0.65 22.36±0.28ab 143.750**
2.4 siRNA-TMEM97 转染后对SKOV3 细胞凋亡的影响 流式细胞术结果显示,si-TMEM97 组细胞的早期凋亡率相比Control 组和siNC 组显著增高(P<0.01),而Control组和siNC组细胞的早期凋亡率差异无统计学意义,下调TMEM97 的表达能够明显促进SKOV3细胞的凋亡,见图3、表4。
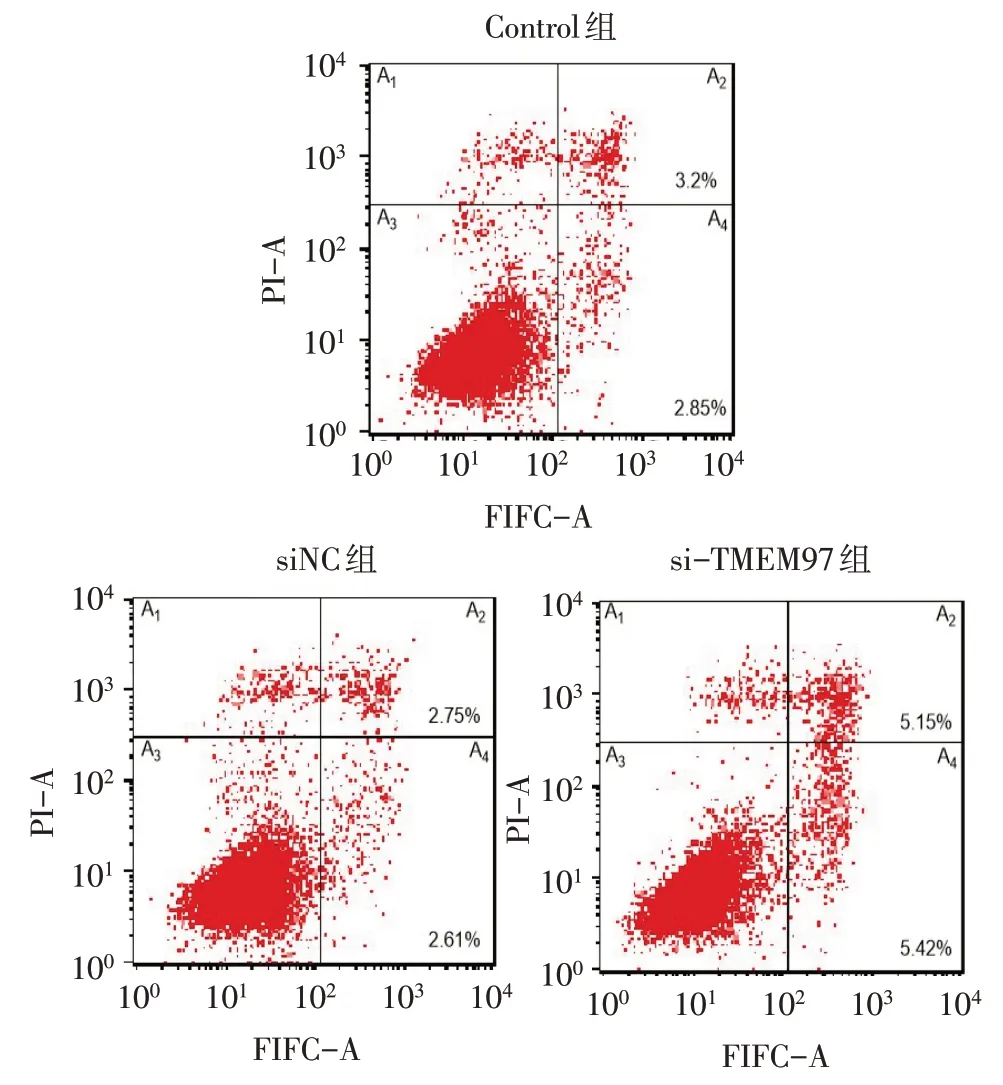
Fig.3 Effects of siRNA-TMEM97 transfection on the apoptosis of SKOV3 cells图3 转染siRNA-TMEM97对SKOV3细胞凋亡的影响
2.5 siRNA-TMEM97 转染对SKOV3 细胞中凋亡及P38/MAPK 通路相关蛋白表达的影响 Western blot结果显示,si-TMEM97 组细胞中Bcl-2 蛋白相对表达量较Control组和siNC组降低(P<0.01),Bax和p-P38/MAPK蛋白相对表达量高于Control组和siNC组(P<0.05),3 组细胞中P38/MAPK 蛋白相对表达量差异无统计学意义,见图4、表4。
3 讨论
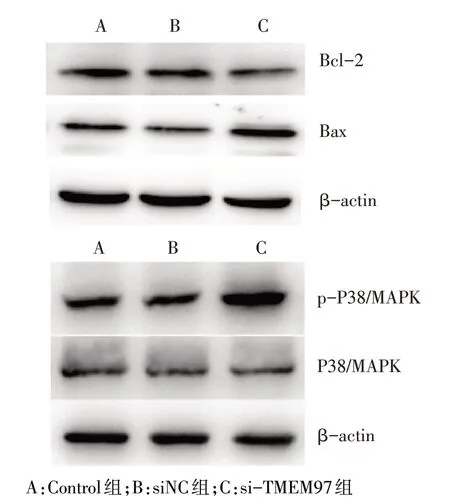
Fig.4 Effects of siRNA-TMEM97 transfection on the expressions of Bcl-2,Bax,p-P38/MAPK and P38/MAPK in SKOV3 cells图4 转染siRNA-TMEM97对SKOV3细胞中Bcl-2、Bax和p-P38/MAPK和P38/MAPK表达的影响
3.1 TMEM97 与卵巢癌 卵巢癌作为女性生殖系统致死率较高的恶性肿瘤,发病隐匿,通常局限于腹腔。目前常用的治疗方法是手术联合化疗,但仍有70%~80%的复发率[6],因此探寻有效实用的卵巢癌分子治疗的新靶点、新方向迫在眉睫。TMEM97 是一种跨膜蛋白成分,其在正常结肠、胃、食管的黏膜细胞以及胰腺的腺泡腺管等组织中均有表达,但TMEM97 mRNA及蛋白在人类多种肿瘤中表达量有所差异[7]。有研究报道TMEM97在恶性肿瘤中的表达量与肿瘤发生的部位及侵袭浸润转移程度有关,在癌细胞与肿瘤基质相互作用的过程中发挥着重要作用[8]。因此笔者推测TMEM97 可能在包括卵巢癌在内的多种肿瘤的发生和发展中发挥了重要作用。
本研究采用CCK-8 法检测转染后细胞的增殖能力,结果表明下调TMEM97 后卵巢癌细胞SKOV3在 24、48、72 和 96 h 的增殖活力显著低于 Control 组和siNC 组。为了进一步证实TMEM97 对卵巢癌细胞恶性生物学特性的影响,采用流式细胞术检测了下调TMEM97 的表达对SKOV3 细胞细胞周期及其凋亡的影响。结果显示,与Control 组和siNC 组相比,TMEM97 沉默后对SKOV3 细胞具有周期阻滞效应,SKOV3细胞的细胞凋亡率有所增加。以上结果均表明,TMEM97 作为有效分子靶点之一参与了卵巢癌细胞SKOV3的增殖和凋亡过程。
Tab.4 Effects of siRNA-TMEM97 transfection on the apoptosis and signal pathway of SKOV3 cells表4 转染siRNA-TMEM97对3组SKOV3细胞凋亡及相关信号通路的影响 (n=3,)
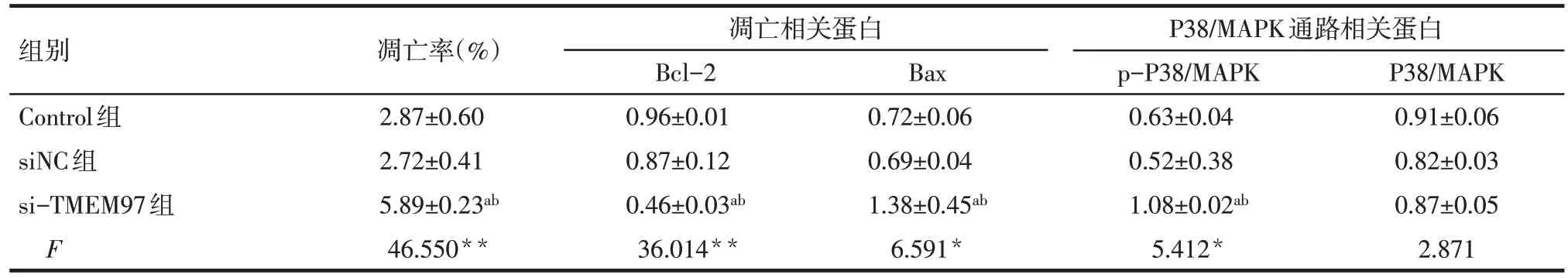
Tab.4 Effects of siRNA-TMEM97 transfection on the apoptosis and signal pathway of SKOV3 cells表4 转染siRNA-TMEM97对3组SKOV3细胞凋亡及相关信号通路的影响 (n=3,)
*P<0.05,**P<0.01;a与Control组比较,b与siNC组比较,P<0.05
组别Control组siNC组si-TMEM97组F凋亡率(%)2.87±0.60 2.72±0.41 5.89±0.23ab 46.550**凋亡相关蛋白Bcl-2 0.96±0.01 0.87±0.12 0.46±0.03ab 36.014**Bax 0.72±0.06 0.69±0.04 1.38±0.45ab 6.591*P38/MAPK通路相关蛋白p-P38/MAPK 0.63±0.04 0.52±0.38 1.08±0.02ab 5.412*P38/MAPK 0.91±0.06 0.82±0.03 0.87±0.05 2.871
3.2 TMEM97 与凋亡相关蛋白 本研究结果表明,TMEM97与卵巢癌细胞SKOV3的凋亡存在明显调控关系,因此通过Western blot检测了Bcl-2和Bax的蛋白表达水平。Bcl-2、Bax是Bcl-2家族中最多见的类凋亡相关蛋白[9]。有研究报道,Bcl-2家族蛋白可通过与线粒体及凋亡家族其他蛋白相互作用等途径影响细胞凋亡[10]。位于细胞基质中的Bax蛋白在内源性细胞凋亡途径可加速细胞色素C的释放,从而导致内源性凋亡的瀑布式启动[11]。也有研究表明,p53肿瘤抑制因子的突变可以造成BH3结构域中蛋白信号传导受损,从而导致Bcl-2过表达,抑制细胞凋亡[12]。本研究中,抑制TMEM97表达后SKOV3凋亡明显增加,Bcl-2表达水平下降,而Bax表达水平增高,提示在卵巢癌中下调TMEM97基因可能通过抑制Bcl-2、升高Bax蛋白表达来诱导细胞凋亡。这与Song等[13]在乳腺癌中的研究结果一致,该研究表明下调TMEM97能诱导乳腺癌细胞发生凋亡。
3.3 TMEM97 与 P38/MAPK 信号传导通路 MAPK家族是一组重要的丝/苏氨酸蛋白激酶,参与了多种肿瘤细胞的增殖、分化、凋亡、炎症反应等[14]。本研究结果提示,si-TMEM97组卵巢癌SKOV3细胞中p-P38/MAPK 相对表达量高于 Control 组和 siNC 组,表明TMEM97对卵巢癌细胞增殖和凋亡的作用可能是通过调节P38/MAPK信号通路的活性实现的。也有研究表明,P38/MAPK 通路与卵巢癌的关联较多,如WASP 家族富含脯氨酸同源蛋白3(WAVE3)、野生型p53 诱导的磷酸酶1(WIP1)等癌基因,均可通过作用于P38/MAPK信号传导通路调节卵巢癌细胞的增殖、凋亡、迁移等恶性生物学表型[15]。为进一步验证TMEM97对卵巢癌细胞增殖和凋亡的影响是否通过调节P38/MAPK 信号通路的活性实现,今后实验中将在信号通路中加入抑制剂来进行反证。
综上所述,下调TMEM97 表达后卵巢癌细胞增殖能力降低、凋亡增加,其机制可能与调节Bcl-2/Bax表达及P38/MAPK信号通路的激活有关,这有望为卵巢癌的临床治疗提供新靶点和新思路。但本研究没有涉及动物实验,并不确定在体内下调TMEM97 表达后对卵巢癌的调节作用,因此有待今后进行更深入的机制研究。
