肉牛支原体病原分离鉴定及药物敏感性试验
2020-08-15姜玲玲吴位珩徐景峨杨茂生孙启跃冯明祥邹茂华
杨 莉, 姜玲玲, 张 涛, 吴位珩*, 徐景峨, 余 波, 刘 镜, 杨茂生, 孙启跃, 冯明祥, 刘 和, 邹茂华
(1.贵州省农科院畜牧兽医研究所,贵州 贵阳 550005;2.贵州省关岭自治县畜牧服务中心,贵州 关岭 561300;3.思南畜牧技术推广站,贵州 铜仁 565100;4.黔西县农业农村局,贵州 黔西 551500)
牛支原体是危害养牛业的一种重要的致病性病原,无细胞壁,介于细胞和病毒之间。致病性支原体除能导致牛肺炎、乳腺炎、关节炎外,还导致眼结膜炎、耳炎、生殖道炎症与不孕等多种疾病[1]。1961年,美国人Hale[2]首次从患乳腺炎的牛乳中分离得到牛支原体,该病原在世界范围内普遍存在。自2008年以来,我国大部分省(地区)从外地引入肉牛爆发了以坏死性肺炎为主要特征的“传染性牛支原体肺炎”疫情,多数牛在运输到目的地后1~2周发病,发病率为20%~100%,病死率高达10%~50%,给我国肉牛养殖业造成了巨大的经济损失[3]。随着贵州扶贫攻坚的开展,肉牛引进量不断增大,带来了一系列流行病的感染、发生,肉牛运输综合征最为突出,而牛支原体病是引起牛运输综合征的主要病因,给贵州省养牛业造成巨大经济的损失,为此项目组对牛支原体病在贵州省的流行情况进行调查,并对牛支原体病原进行分离鉴定、生物学特性、分子诊断及药物敏感性研究。
1 材料与方法
1.1 材 料
1.1.1 试验样本 无菌采集疑似感染牛支原体病牛的鼻拭子和病死牛肺。
1.1.2 参考菌株 牛支原体菌株由华中农业大学动物医学院惠赠。
1.1.3 引 物 引物序列为:上引物,5′-ACGTGACTACTTCACCCTGAT-3′;下引物,5′-TAGACCGACTATTTCACCTTC-3′,由宝生物工程(大连)有限公司合成。
1.1.4 生化试剂 PPLO肉汤培养基、PPLO固体培养基(青岛高科技工业园,海博生物技术有限公司);特级马血清、酵母粉、精氨酸(北京索莱宝科技有限公司);Lab-Aid 820核酸提取Mini试剂盒(厦门致善生物科技股份有限公司);Goldview核酸染料、蛋白酶K、十二烷基硫酸钠、EDTA、Tris-HCL、琼脂糖、DL2000Marker、2×TaqPCRMasterMix(10 mmol/L Tris-HCl、50 mmol/L KCl、1.5 mmol/L MgCl2、0.05 U Poymerase/μL)、去离子水(天根生化科技[北京]有限公司);细菌微量生化鉴定管(青岛高科技工业园,海博生物技术有限公司);药敏试纸(杭州滨和微生物试剂有限公司)。
1.1.5 主要仪器 石蜡切片机(Leica RM2125,德国);高通量快速研磨仪(海净信实业发展有限公司);Lab-Aid 820核酸提取仪(厦门百维信生物科技有限公司);电子天平(美国奥豪斯AR2140);高速冷冻离心机(美国赛麦飞SORVALL:LEGEND MICRO 21R);梯度PCR扩增仪、电泳仪、紫外透射仪、凝胶成像仪(德国BIOMETRA);紫外分光光度计:北京普析(TU-1810SPC)。
1.2 方 法
1.2.1 样本采集 2018年采自黔西县牛场患病牛的鼻拭子和死亡牛肺。无菌采集疑似牛支原体肺炎病死牛肺,或采用棉签采集疑似牛支原体肺炎鼻涕(鼻拭子),用冷藏箱带到实验室,冷藏备用。
1.2.2 组织样本固定 将病死牛肺用生理盐水清洗后,置10%的甲醛溶液中固定,待进行组织病理切片的制备。
1.2.3 病原分离培养 鼻拭子分离培养:取1 mL生理盐水将鼻拭子浸润,尽量将药棉棒上的鼻涕清洗在试管里,弃去药棉棒,采用孔径为0.45 μm滤膜过滤上述溶液后接种于PPLO肉汤培养基中,5% CO2、37 ℃恒温分别培养24,48,72 h,观察培养基的颜色及培养液絮状物的变化情况,如果由红变黄,有絮状物出现,转接于PPLO固体培养基中,5% CO2、37 ℃恒温培养48 h以上,同时取1 mL培养液置于1.5 mL的离心管中,以备提取病原菌DNA。
病死牛肺分离培养:采用生理盐水将采集到的牛肺冲洗,将肺置于平皿中,用手术剪刀取中间没有污染部分,进行组织研磨,采用孔径为0.45 μm滤膜过滤后接种于PPLO肉汤培养基中,5% CO2、37 ℃恒温培养24,48,72 h,观察培养基的颜色及培养液絮状物的变化情况,如果由红变黄,有絮状物出现,可转接于PPLO固体培养基中,5%CO2、37 ℃恒温培养48 h以上,同时取1 mL培养液置于1.5 mL离心管中,以备提取病原菌DNA。
1.2.4 组织病理切片制备 将置10%的甲醛溶液中固定1周的肺、组织,进行酒精脱水和二甲苯透明,脱水时间从低浓度到高浓度(见表1),接着让石蜡充分渗入到肺组织中,使组织结实,有利于连续切片。然后进行常规切片,染色,并在显微镜下观察,记录组织结构变化。

表1 肺组织脱水步骤
1.2.5 生化反应试验 按常规操作将分离的16株菌株(HZ株、25025株、J89310、J7、J9、J23、J31、J39、J40、J41、W25、W28、W44、W69、W77、W88),接种于细菌微量生化鉴定管中(购自青岛海博生物技术有限公司),5%CO2、37 ℃恒温培养48~72 h,观察结果并记录。
1.2.6 PCR检测与鉴定 组织样本肺DNA提取:取样本肺少许,采用高通量快速研磨仪研磨,加入900 μL生理盐水,反复冻融3次,然后5 000 r/min离心5 min,取700~900 μL上清液,加入20 μL蛋白酶K,100 μL 10% SDS液,55 ℃水浴箱中加热30 min至组织消化完全,取出冷却。采用核酸提取Mini试剂盒提取所需DNA模板。
样本鼻拭子DNA提取:用1 mL ddH2O将鼻拭子完全浸润,尽量将药棉棒上的鼻涕清洗在试管里,弃去药棉棒,将试管里的溶液全部移入1.5 mL的离心管中,10 000 r/min离心2 min,弃上清,收集沉淀。采用核酸提取Mini试剂盒提取所需DNA模板。
分离培养菌株DNA提取:取培养菌液1 500 μL于2 mL的离心管中,10 000 r/min离心2 min,弃上清,收集沉淀。采用核酸提取Mini试剂盒提取所需DNA模板。
PCR扩增条件:采用提取的DNA摸板,利用合成的引物在PCR酶的作用下进行扩增。反应体系和条件:PCR酶为10 μL,支原体标准菌株DNA模板2 μL,样本DNA模板2 μL,上下引物各1 μL,加入ddH2O至25 μL,在Tgradient96扩增仪下进行如此循环:94 ℃变性5 min,94 ℃ 30 s,52℃ 30 s,72 ℃ 90 s,30个循环,最后72 ℃延伸5 min。反应结束后将扩增产物取5 μL进行2%琼脂糖凝胶电泳检测。
PCR产物鉴定:牛肺炎支原体的PCR扩增片段经胶回收,送上海生工宝生物工程有限公司测序,并将测序结果在NCBI中进行病原菌的鉴定和同源性的比对。
1.2.7 药物敏感性试验 分别将分离到的菌株采用消毒过的药棉棒,蘸取100 μL菌液,均匀地涂布于PPLO固体培养基上,再将药敏试纸置于均匀涂布有菌液的固体培养基上,每个培养基一般放置7~9张药敏试纸,然后5% CO2、37 ℃恒温培养1~2 d,观察并记录抑菌圈直径的大小,并判断药物的敏感性。
2 结果与分析
2.1 发病牛临床症状
发病牛临床症状主要表现为体温升高、精神沉郁、食欲减退、被毛粗乱、咳嗽、气喘、流黏性或脓性鼻液、拉稀、血便、关节炎、结膜炎、极度消瘦,甚至衰竭死亡。解剖后死亡牛肺部有干酪样坏死灶或化脓性坏死灶,胸腔内有大量纤维性渗出液或脓性液体,有些出现肺与胸腔粘连,以及消化道溃疡等。
2.2 病原菌的分离培养结果
2018年6月,项目组自黔西隔离场采集引进能繁母牛疑似病牛鼻拭子样本163份,死亡牛肺样本1份,检测出60份牛支原体阳性样本,分离培养出18株形态特征和生长特性与牛支原体相符的菌株。分离的菌在PPLO液体培养基中培养72 h后,液体PPLO培养液开始变色;分离传代培养时,液体变色时间缩短,只需要24 h就可由红变黄。在PPLO固体培养基上培养5%CO2、37℃恒温培养72 h后,可见针头大小不一的菌落(图1),在普通光学显微镜下可看到菌落呈圆形,边缘整齐,具有典型的“油煎蛋”状菌落(图2)。

图1 PPLO固体培养基上针头大小不一的菌落

图2 显微摄影下典型的“油煎蛋状”形态(40×)
2.3 组织病理切片结果
牛患支原体肺炎后,往往并发其他病原菌感染,使病牛病情加重,甚至造成死亡,因此不仅仅肺部发生病理变化,其他器官也随着病情的变化发生病变,具体的病理变化由图3(a-1和a-2)肺组织病理切片结果可见,肺间质动脉血管充血、肺间质水肿变宽,呈灰白色;肺间质纤维增生,有实质性病变;肺泡上皮细胞变性坏死;肺泡内有大量粘液。由图3(b-1和b-2)肝组织病理切片结果可见,肝小叶中央静脉瘀血,间质中央动脉充血,肝上皮细胞脂肪变性和颗粒变性;间质中炎症细胞增生。由图3(c-1和c-2)淋巴组织病理切片结果可见,牛淋巴结皮质和髓质结构不清,髓质间水肿,淋巴小结的生发中心淋巴细胞活化,淋巴细胞增生。由图3(d)的心组织病理切片结果可见,牛心肌颗粒变性,肌纤维之间水肿。由图3(e)脾组织病理切片可见,牛脾脏白髓内淋巴小结活化,淋巴细胞增生,红髓内淋巴细胞增生,脾索之间水肿。
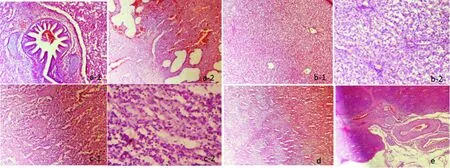
注:a-1和a-2为肺组织;b-1和b-2为肝组织;c-1和c-2为淋巴组织;d为心组织;e为脾组织。
2.4 生化试验结果
常规操作将分离的菌株接种于细菌微量生化鉴定管中,由结果(表2)可知:所有菌株对酚红葡萄糖肉汤、七叶苷呈阳性反应,对明胶、L-精氨酸双水解酶、尿素酶呈阴性反应;HZ、J23和W44葡萄糖发酵管为阳性,其余菌株呈阴性反应;菌株25025、J41和W69甘露醇反应呈阳性,其余菌株为阴性反应。
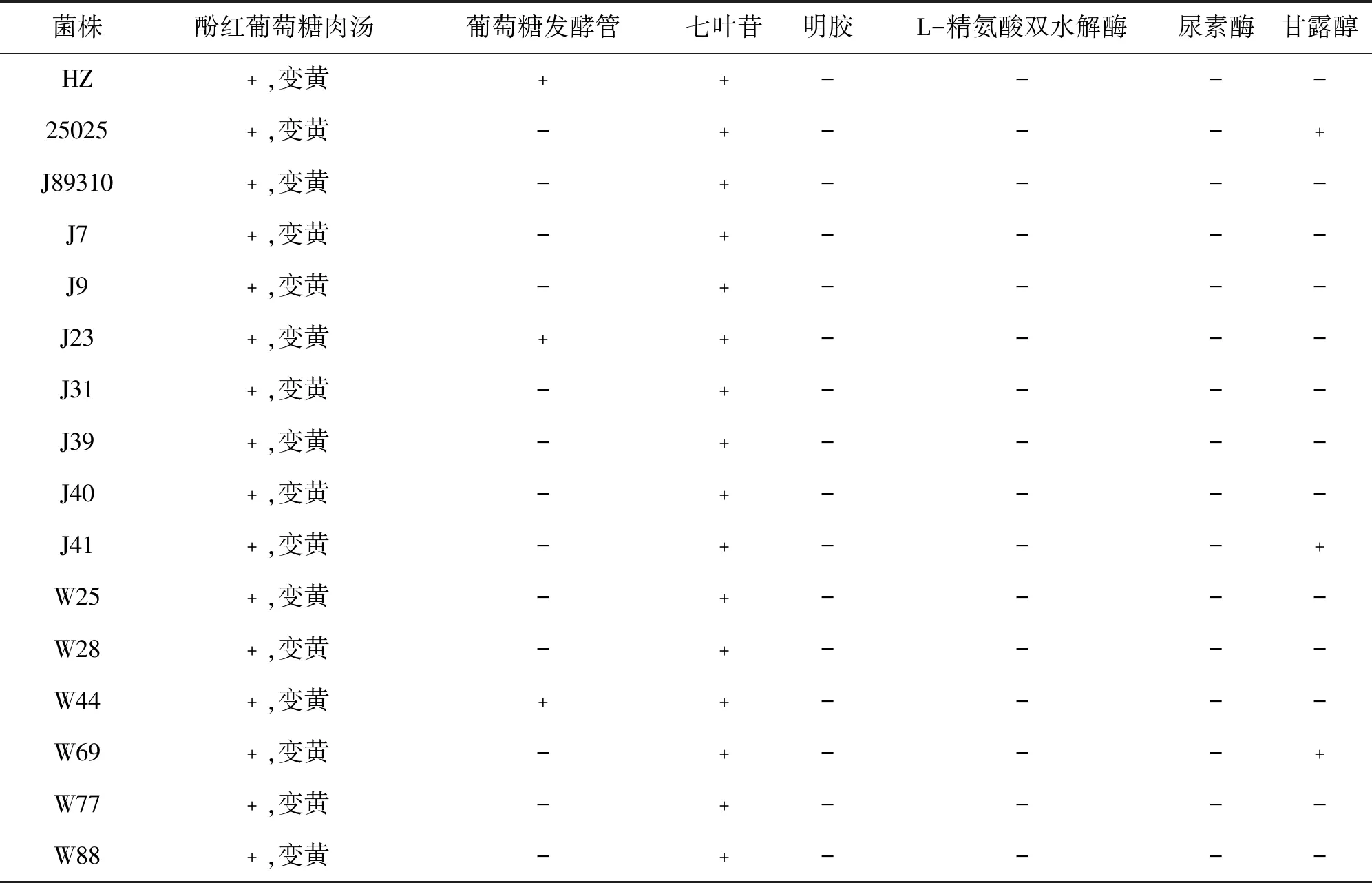
表2 牛支原体生化反应试验
2.5 样本及分离菌株的PCR检测结果
对2018年采自牛场样本163份牛鼻拭子和肺进行PCR检测,同时进行细菌学分离培养。结果共检测出阳性样本60份,且与细菌学检验结果一致如图4所示。同时将PCR扩增片段经胶回收,送上海生工宝生物工程有限公司测序,并将测序结果在NCBI中进行病原菌的鉴定和同源性的比对。结果表明,扩增片段为牛支原体的特异性条带,同源性的比对结果为93.02%~100%。
2.6 药物敏感性试验结果
通过将药敏试纸置于均匀涂布有菌液的固体培养基上,经5% CO2、37 ℃恒温培养1~2 d,观察并记录抑菌圈直径的大小,结果如表3所示。
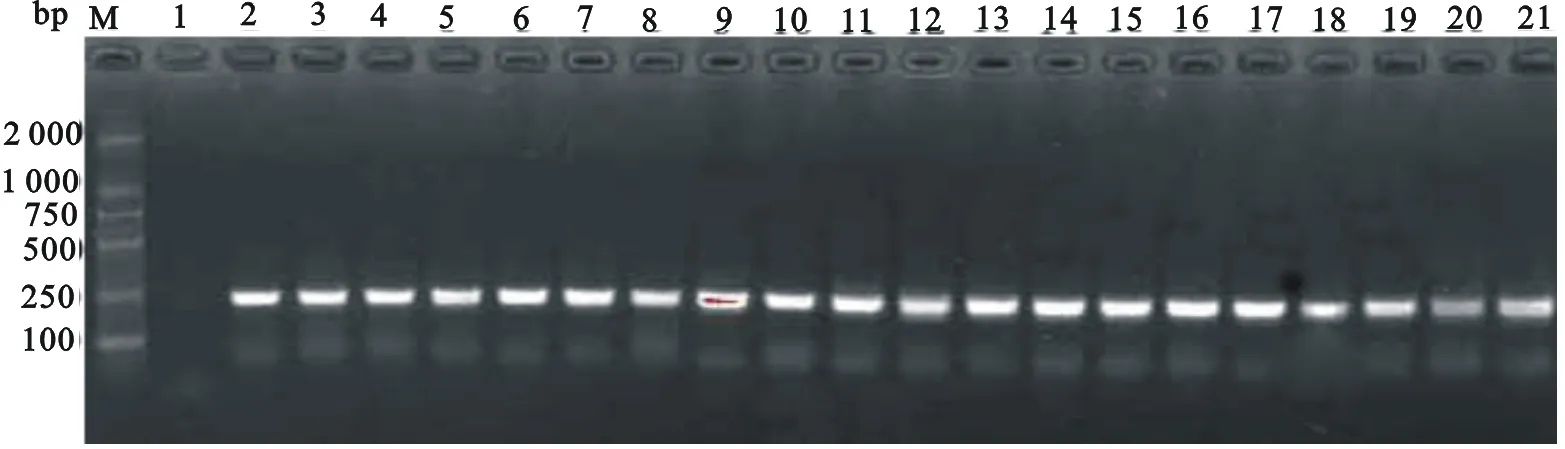
注:M为Marker DL2000;1为阴性对照;2为标准阳性;3~21为被检出的阳性样本。

表3 药物抑菌圈直径大小的记录 mm
3 结论与讨论
牛支原体病在国外是一个常见病,但是在我国一直没有引起足够重视。国内牛群发病基本上按照牛胸膜肺炎疫情进行防治,误判病情而忽略了基本的防护常识,按照牛胸膜肺炎进行药物治疗,无法有效地保护发病牛群,不仅仅造成药物浪费,同时造成发病牛死亡,带来巨大经济损失。据报道[4],临床健康犊牛购入24 h后,鼻腔中可检出牛支原体,但大部分牛7 d后经鼻腔可检牛支原体。金云云等[5]研究认为,多数牛在运达目的地后2周左右发病,不良环境下如途中遭雨淋等,牛可在运达目的地后第2天即发病。感染牛支原体的牛可携带病原体数月甚至数年而成为一个传染源,主要传播途径是通过飞沫呼吸道传播,近距离接触、吮吸乳汁或生殖道接触等也可传播牛支原体。
随着扶贫工作的深入开展,养牛产业成为了贵州省多地脱贫攻坚的主导产业及重要抓手。肉牛引进量不断增大,带来了一系列流行病发生和感染问题,肉牛支原体病就是主要疾病。因而笔者对牛支原体病在贵州省的发生、流行情况进行了调查,并对牛支原体病原进行了分离鉴定、生物学特性、分子诊断和药物敏感性等方面的研究工作。研究表明:牛支原体在分类上属于支原体属,该病原具有体型微小、基因组成分微量等显著特点[6]。支原体的培养基除基础营养物质外,尚需要丰富的血清蛋白、胆固醇和酵母浸液,血清主要提供胆固醇、脂肪酸和蛋白质,酵母浸液提供核苷前体、维生素及刺激生长的某些成分,牛支原体在pH 7.0~8.0范围内生长良好,在一定的CO2(5%~10%)环境、湿度(60%~80%)、温度(36~37 ℃)条件下生长较好,培养2~3 d,在低倍镜下观察琼脂培养基上长出“煎蛋样”菌落。牛患支原体肺炎后,往往并发或继发其他病原菌感染,而使病牛病情加重,因此不仅仅肺部发生病理变化,其他器官也随着病情的变化发生病变,甚至造成死亡。牛支原体既不分解葡萄糖、甘露醇、尿素酶、明胶,也不水解精氨酸,酚红葡萄糖肉汤呈阳性反应,接种菌株后,放置37 ℃厌氧培养24 h,培养基由红色变为黄色,七叶苷生化反应为阳性,符合牛支原体的生化特征。分离菌株的PCR检测及测序结果表明:扩增片段为牛支原体的特异性条带,在NCBI同源性的比对结果为93.02%~100%,这说明牛支原体是牛场重要的病原菌之一。由于引起呼吸道疾病的病因复杂,有必要进一步对其他病原菌(如病毒、细菌等)进行调查,以便更加全面地了解牛场的混合感染情况。抗生素治疗是控制和治疗牛支原体病的主要手段。由于支原体结构和功能的特点使其对β-内酰胺类抗菌药和磺胺类药物具有内在的抗性,但是对影响蛋白质或核酸合成的抗生素敏感[7]。近年来,牛支原体耐药的报道逐渐增多,从比利时、德国和意大利3个国家分离的牛支原体对替米考星、泰乐菌素等常用药具有严重的耐药性[8]。张利等[9]研究表明,牛支原体对恩诺沙星、环丙沙星、诺氟沙星等药物的抵抗性增强。马艳君等[10]研究表明,牛支原体对恩诺沙星和头孢噻呋有耐药。本试验对分离的支原体进行了药物敏感性试验,结果表明对氟苯尼考、诺氟沙星、新霉素、头孢派酮、氧氟沙星高度敏感;对卡拉霉素、呋喃妥英、呋喃唑酮、连霉素中度敏感;对头孢曲松、强力霉素、头孢噻肟、四环素、甲氧嘧啶低度敏感;对利福平、头孢西丁、氨苄西林、青霉素G、林可霉素、头孢呋辛、阿莫西林、头孢唑林不敏感。这一结果对牛场支原体疾病的发生、流行及防治起到了积极的指导作用。
