去甲氧基姜黄素对毒胡萝卜素诱导乳鼠心肌细胞内质网应激的影响
2020-08-13崔健昆耿乃志孟凡吉施丽春田耕韩玉生
崔健昆,耿乃志,孟凡吉,施丽春,田耕,韩玉生*
(1.黑龙江中医药大学,黑龙江 哈尔滨 150040;2.哈尔滨医科大学,黑龙江 哈尔滨 150001)
中药姜黄,性味辛、苦,温,可以内行气血、外散风寒,功能活血散瘀、行气通经、止痛消肿,长于治疗胸痹、痛经、风湿痹痛、跌打肿瘀等。姜黄素和去甲氧基姜黄素(Demethoxycurcumin,DMC)是姜黄的主要活性成份,二者具有相近的化学结构和相似的药理作用。研究发现,姜黄素对心血管损伤具有良好保护作用,临床主要用于心力衰竭、动脉粥样硬化、心律失常等疾病的治疗[1-3]。作为姜黄素的天然衍生物, DMC对心血管的保护作用及机制的研究尚不十分明确。本研究采用(Thapsigargin,TG)诱导乳鼠心肌细胞建立(Endoplasmic Reticulum Stress,ERS)模型,旨在探讨DMC调节GRP78和CHOP蛋白表达水平的影响及意义,为 DMC防治心血管疾病提供客观依据。
1 材料与方法
1.1 实验动物
出生24~48 h的清洁级SD新生鼠由黑龙江中医药大学实验动物中心提供,许可证号:SCXK(黑)2016004。
1.2 药品与试剂
去甲氧基姜黄素(DMC)、毒胡萝卜素(TG)购自美国 Sigma 公司;DMEM 培养基、胰蛋白酶、青链霉素双抗购自Gibco;胎牛血清购自杭州四季青公司;LDH、MDA和SOD检测试剂盒购自南京建成生物工程公司; CCK-8、细胞凋亡检测试剂盒,购自Dojindo; GADPH单抗、GRP78和CHOP多克隆抗体购自CST;蛋白质相对分子质量标准,美国 MBI公司;SDS-PAGE电泳凝胶,ECL检测试剂盒,美国 Amresco公司;PVDF 膜,美国Millipore 公司;其余试剂为国产分析纯试剂。
1.3 仪器
酶标仪(Multiscan MK3型),美国Thermo公司;CO培养箱(BC-J80S型),上海博迅公司;超净化工作台(SW-CJ-2FD型),苏州净化; 荧光倒置显微镜 (IX51型),日本Olympus;电泳仪及转膜仪(164-5051型)、凝胶成像系统(Gel Doc XR型)、流式细胞仪,美国Bio-Rad公司。
1.4 乳鼠心肌细胞培养及分组处理
按参考文献[4]方法,在无菌条件下将出生24~48 h的新生鼠心尖部位的心肌组织,用无菌剪刀剪成1 mm3大小,加入一定比例的0.15%胰蛋白酶在37 ℃水浴下消化,制备成心肌细胞悬液,然后差速离心贴壁。用DMEM培养液(含15%胎牛血清)将细胞浓度调整为3×106个,接种于培养瓶中进行原代培养。
取原代培养心肌细胞,常规培养24 h后更换无胎牛血清的DMEM培养液继续培养24 h。随机分为4组:①对照组:细胞不做任何药物处理,常规培养24 h至实验结束;②模型组:培养液中加入1 μmol/L TG,常规培养24 h,建立ERS模型;③DMC低浓度组:在培养液中同时加入1 μmol/L TG和10 μmol/L DMC,常规培养24 h; ④DMC高浓度组:在培养液中同时加入1 μmol/L TG和30 μmol/L DMC,常规培养24 h。
无菌避光环境下,将TG、DMC溶于二甲化亚砜(DMSO)中,配置成 1 mol/L的储存液,分装于EP 管中置于-20 ℃的冰箱中避光保存。
1.5 CCK-8 法检测细胞活力
将心肌细胞以2×103个/孔的密度接种于96孔板中,培养液体积100 μL,实验处理结束后加入10 μLCCK-8,并设立没有细胞的对照孔,放于培养箱培养3 h,酶标仪在450 nm下检测A值。每组设6个复孔并重复3次。
1.6 细胞LDH、MDA和SOD水平检测
调整细胞密度为1×106/mL接种于6孔板,每组设置6个复孔。收集细胞制备成匀浆,检测 LDH、MDA和SOD 水平,严格按试剂盒说明书进行操作。
1.7 Western blot检测GRP78和CHOP蛋白表达
收集细胞后加入 RIPA裂解液在冰上充分裂解,BCA试剂盒检测蛋白浓度。调整蛋白浓度后每孔上样量为30 μg,SDS-PAGE凝胶电泳、转膜、封闭后,加入一抗、二抗孵育。ECL显示,凝胶成像系统扫描并分析蛋白表达水平。
1.8 流式细胞仪检测细胞凋亡
采用Annexin V-FITC PI双染法检测细胞凋亡百分率。常规培养各组细胞并经干预处理后,0.2%胰酶消化处理,离心收集细胞。4 ℃的PBS洗涤后加入200 μL结合缓冲液重悬细胞,并加入 Annexin V 10 μL,流式细胞仪检测细胞凋亡。FITC检测:激发光波长488 nm,发射光波长515 nm;PI检测:发射光波长560 nm。数据用Flow Jo软件进行细胞凋亡的相对定量分析。
1.9 统计学方法
2 实验结果
2.1 DMC对TG诱导心肌细胞活力和细胞凋亡的影响
与对照组相比较,模型组的心肌细胞活力表现为明显下降,细胞凋亡率明显增加,P<0.05;与模型组相比,DMC给药组心肌细胞活力均明显增加,细胞凋亡率明显减少,P<0.05。结果见表1、图1。

表1 DMC对TG诱导心肌细胞活力和细胞凋亡的影响
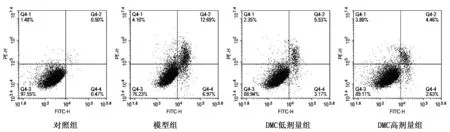
图1 DMC对TG诱导心肌细胞凋亡的影响
2.2 DMC对TG诱导心肌细胞LDH 、MDA和SOD 水平的影响
与对照组相比,模型组细胞LDH及MDA含量升高,而SOD活力则降低,P<0.05;与模型组比较,不同浓度DMC干预后,LDH及MDA含量显著降低,SOD活力则显著升高,P<0.05。结果见表2。

表2 DMC对TG诱导心肌细胞LDH、MDA和SOD水平的影响
2.3 DMC对 TG 诱导心肌细胞GRP78和CHOP蛋白表达的影响
与对照组相比较,模型组心肌细胞GRP78和CHOP蛋白表达升高显著,P<0.05;与模型组相比较,不同浓度DMC干预后,GRP78和CHOP蛋白表达降低,P<0.05。表明DMC对TG诱导心肌细胞GRP78和CHOP蛋白表有明显的抑制作用。结果见表3、图2。

表3 DMC对TG诱导心肌细胞GRP78和CHOP蛋白表达影响
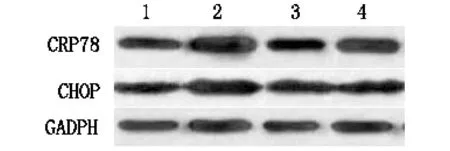
注:1.对照组;2.ERS模型组;3.DMC低剂量组;4.DMC高剂量组图2 DMC对TG诱导心肌细胞GRP78和CHOP蛋白表达影响
3 讨论
心肌细胞凋亡是缺血性心脏病重要的病理机制之一,通过抑制心肌细胞凋亡能够改心脏功能,与ERS相关的细胞凋亡途径是当前研究热点[5-7]。ERS主要由蛋白激酶R样内质网激酶(PERK)、活化转录因子6(ATF6) 和肌醇酶1(IRE1) 3种内质网跨膜蛋白介导。研究表明ERS发生与Ca2+代谢紊乱密切相关,Ca2+浓度的稳定是调控内质网分子伴侣GRP78非常重要因素[8]。在ERS发生状态下,GRP78的表达量呈现明显增加,可以促使细胞内质网中未折叠的蛋白发生折叠,以此减轻内质网应激的严重程度[9-10]。在细胞处于长时间或者严重的ERS的情况下,会进一步使内质网中促凋亡蛋白CHOP的表达呈现上调,由抑制凋亡转变为促进细胞凋亡,最终引起细胞死亡[11-12]。CHOP介导的ERS相关凋亡参与了多种心血管疾病的发生发展[13-14]。TG是多种细胞培养中常用的ERS模型诱导剂[9-10],通过抑制钙泵和Mg2+-ATPase,使Ca2+大量转运到细胞浆中,而内质网中的Ca2+浓度下降,引起内质网功能障碍,未折叠蛋白的含量增加并大量聚集,最终导致ERS的发生[15-16]。
我们前期研究发现,DMC能够减轻乳鼠心肌细胞缺氧/复氧所造成的细胞损害,对心肌缺血再灌注模型小鼠心肌具有明显的保护作用,其机制与抑制细胞凋亡和自噬相关蛋白有关。本研究以TG诱导乳鼠心肌细胞ERS为研究对象,探讨DMC是否能够直接抑制ERS的发生及机制。通过预试验确定1 μmol/L的TG直接刺激细胞24 h为ERS的最佳剂量和作用时间。研究结果表明,与对照组相比较,模型组细胞的活性明显下降,细胞凋亡明显增加,LDH及MDA含量升高,而SOD活力则降低,GRP78和CHOP蛋白表达显著升高;与模型组比较,DMC浓度为10 μmol/L和30 μmol/L分别作用心肌细胞ERS模型24 h时,细胞活性升高,细胞凋亡明显减少,LDH及MDA含量显著降低,SOD活力则显著升高,并且GRP78和CHOP蛋白表达降低。
综上所述,TG诱导了心肌细胞发生ERS,GRP78、CHOP蛋白表达增加,促进了心肌细胞凋亡, DMC能够剂量依赖性的抑制GRP78和CHOP蛋白的高表达,使PERK活化和磷酸化水平受到明显抑制,减弱ERS时内质网中蛋白质的积聚,同时降低LDH和MDA的释放、提升SOD酶活性,从而保护心肌细胞免于ERS损伤,可能为DMC治疗心血管疾病提供新靶点。
