胃饥饿素对HK-2 细胞缺氧/复氧损伤后的保护作用及机制*
2020-08-12王莉芳冯正平李晓春张金山
王莉芳,冯正平,李晓春,张金山
(1. 陕西省食品药品监督检验研究院,陕西 西安 710062; 2. 西北濒危药材资源开发国家工程实验室·药用资源与天然药物化学教育部重点实验室·陕西师范大学生命科学学院,陕西 西安 710062; 3. 空军军医大学解剖与组织胚胎学教研室,陕西 西安 710062)
胃饥饿素(ghrelin)是从胃中分离发现的,由28 个N 端第3 位丝氨酸残基N 辛酰化修饰的氨基酸组成的多肽[1],是内源性生长激素促分泌素受体(GHSR)[2],具有广泛的组织分布,通过GHSR 发挥多种生物学作用,在肾脏中也有分布。有研究表明,外源性注射胃饥饿素对急性肾损伤有预防作用[3-4]。急性肾损伤易出现在肾缺血再灌注,称为肾缺血再灌注损伤(IRI)。肾脏的损伤从缺血开始,恢复灌注后组织会进一步处理损伤,包括中性粒细胞的聚集,游离自由基的产生和细胞因子的激活等[5]。IRI 过程中缺氧会导致不正常的信号传导,引起一系列病理改变,导致肾功能严重受损[6-7]。本研究中采用HK-2 细胞建立缺氧/复氧损伤模型,在体外模拟肾缺血再灌注损伤过程,观察胃饥饿素对IRI 的影响及其作用机制,通过CCK-8、原位末端转移酶标记(TUNEL)法、蛋白质印迹(WB)法观察在胃饥饿素作用下HK-2 细胞的活力、凋亡情况及相关信号通路蛋白表达情况,为进一步在预防肾损伤领域应用胃饥饿素提供依据。现报道如下。
1 材料与方法
1.1 仪器、试药与细胞
仪器:3131 型三气培养箱(美国Thermo 公司);MCO-18AIC 型二氧化碳培养箱(日本SANYO 公司);1300 SERIES A2 型生物安全柜(美国Thermo 公司);Do X6 型全自动化学发光图像分析系统(上海天能公司)。
试药:胃饥饿素(美国Sigma-Aldrich 公司,批号为G3902);细胞外调节蛋白激酶(ERK)兔一抗(批号为4695T),细胞外调节蛋白激酶磷酸化(p-ERK)兔一抗(批号为4370T),P38 促分列素原活化蛋白激酶(P38)兔一抗(批号为8690T),磷酸化P38 促分列素原活化蛋白激酶p-P38 兔一抗(批号为4511T),均购自美国CST 公司;TUNEL 试剂盒(瑞士ROCH 公司,批号为11684817910);β-actin 兔一抗(批号为ab8227),HRP标记抗兔二抗(批号为ab6721),均购自Abcam 公司;其他试剂均为国产分析纯。
细胞:HK-2 细胞购自中科院细胞所。
1.2 细胞培养
将HK-2 细胞株加入DMEM/F12 培养液(含10%胎牛血清)中进行培养,再将其置孵育箱内(37 ℃,5%CO2),孵育箱需维持饱和湿度等适宜的培养条件,在无菌条件下开始进行传代培养。当细胞铺满玻片壁后,用0.25%浓度的胰酶传代,同步化24 h 后细胞进入指数生长期,细胞每3 ~5 d 可传代1 次。
1.3 建立细胞缺氧/复氧损伤模型
采用体外细胞培养,缺氧/复氧模型模拟缺血再灌注模型。将正常培养的HK-2 细胞置0.25%浓度的胰酶消化,计数后按2×104个/孔接种于96 孔板中。于第2 天将96 孔板置三气培养箱内(37 ℃,5%CO2,1%O2),分别培养0,1,2,3,4 h,移至正常培养箱内(37 ℃,5%CO2)12 h。
1.4 CCK-8 法检测细胞活力
将质量浓度为0,12.5,25,50,100,200,400,800,1 600 ng / mL 的胃饥饿素加入2 ×104个/ 孔的96 孔板中,每组平行4 个。于正常培养箱内(37 ℃,5%CO2)孵育2 h,置三气培养箱中(37 ℃,5%CO2,1%O2)培养4 h,于正常培养箱内(37 ℃,5% CO2)孵育12 h。每孔加入新鲜配制的含10 μL 的毒性检测液CCK-8,将培养板在培养箱孵育3 h,用酶标仪测定450 nm 波长处的吸光度(A)值。
1.5 试验分组
将正常培养的HK-2 细胞置0.25%浓度的胰酶消化,计数后按1 ×105个/ 孔接种于预先放置爬片的24 孔板中。第2 天将细胞分为3 组,正常组(N 组)细胞正常培养16 h;缺氧/复氧损伤组(H/R 组)不做处理的细胞于正常培养箱内(37 ℃,5%CO2)孵育2 h,将孔板置三气培养箱内(37 ℃,5%CO2,1%O2)培养4 h,然后移至正常培养箱内(37 ℃,5%CO2)12 h;胃饥饿素预处理组+缺氧/复氧损伤组(ghrelin+H/R 组)将质量浓度为400 ng/mL 的胃饥饿素加入24 孔板中,正常培养箱内(37 ℃,5%CO2)孵育2 h,置三气培养箱内(37 ℃,5%CO2,1%O2)培养4 h,移至正常培养箱内(37 ℃,5%CO2)12 h。
1.6 TUNEL 法检测细胞凋亡
各组细胞培养时加入细胞爬片,按1.5 项下方法培养。将各组爬片置4%多聚甲醛固定,以Streptavidin 工作液覆盖孵育样品,DAPI 复染封片。200倍显微镜下观察,细胞核呈黄色为阳性的凋亡细胞。
1.7 WB 法检测蛋白表达
用RIPA 裂解液提取各组细胞总蛋白,30 μg 的蛋白样品在10%SDS-PAGE 凝胶上分离,并转移到PVDF 膜上;PVDF 膜用5%脱脂牛奶封闭2 h;PVDF 膜在4 ℃温度下与一抗孵育过夜,再用1 ∶2 000 辣根过氧化物酶结合的二级抗体室温下孵育1 h;蛋白条带以化学发光法显色获得。
1.8 统计学处理
采用Graphpad Prism 5 统计学软件分析。试验数据经单因素方差分析(One-way ANOVA),组间比较采用Tukey′s Multiple Comparisons Test。P<0.05 为差异有统计学意义。
2 结果
2.1 细胞缺氧/复氧损伤模型的建立
HK-2 细胞置三气培养箱(37 ℃,5%CO2,1%O2)缺氧1,2,3 h 后,正常培养箱(37 ℃,5%CO2)复氧12 h均不能有效影响细胞活力,缺氧4 h 正常培养箱(37 ℃,5%CO2)复氧12 h,细胞活力显著降低(P<0.01)。表明HK-2 细胞置三气培养箱中(37 ℃,5%CO2,1%O2)缺氧4 h,置正常培养箱(37 ℃,5%CO2)复氧12 h,能有效诱导其缺氧/复氧损伤模型。详见图1。

图1 细胞缺氧/复氧损伤模型的建立
2.2 不同质量浓度对细胞活力的影响
CCK -8 试验结果表明,采用质量浓度为12.5,25,50 ng/mL 的胃饥饿素预处理2 h 后,对缺氧/复氧损伤的HK-2 细胞无明显影响。但胃饥饿素质量浓度为100,200,400,800 ng / mL 预处理能有效提高细胞活 力(P<0.01),且当质量浓度为1 600 ng/mL 时,HK-2 细胞的活力开始降低,表明胃饥饿素质量浓度为1 600 ng/mL 时不利于HK-2 细胞的生存。详见图2。

图2 不同质量浓度胃饥饿素对缺氧/复氧损伤HK-2 细胞的影响
为进一步验证胃饥饿素对正常HK-2 细胞的影响,将不同质量浓度的胃饥饿素加入正常HK-2 细胞中,且置正常培养箱(37 ℃,5%CO2)孵育16 h。每孔加入新鲜配制的含10 μL 的毒性检测液CCK-8,将培养板在培养箱孵育3 h,用酶标仪测定450 nm 波长处的吸光度,结果见图3。可见,质量浓度为12.5,25,50,100,200,400 ng/mL 的胃饥饿素均不影响HK-2 细胞的生长,但胃饥饿素质量浓度为800,1 600 ng/mL 时,HK-2细胞的活力显著降低(P<0.05)。表明胃饥饿素质量浓度大于800 ng/mL 不利于HK-2 细胞的生存。
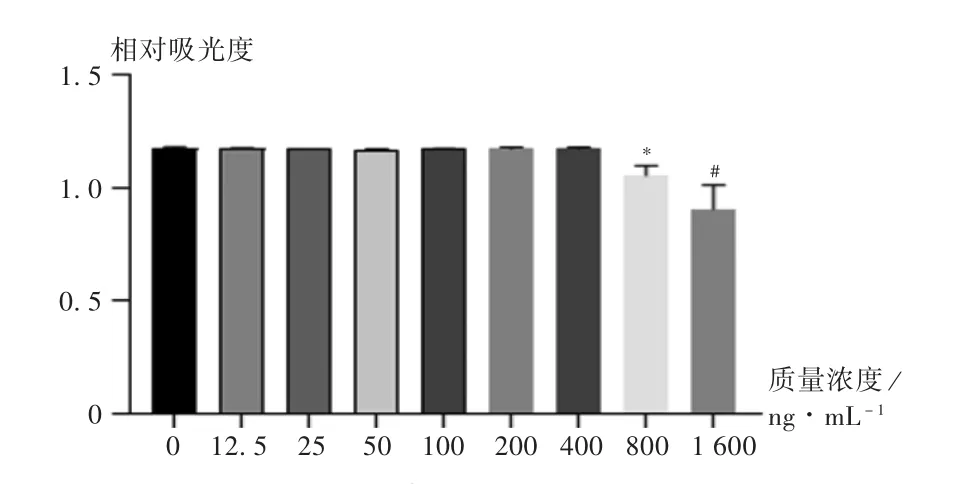
图3 不同质量浓度胃饥饿素对正常HK-2 细胞的影响
2.3 对缺氧/复氧损伤的HK-2 细胞凋亡的影响
TUNEL 试验结果显示,N 组HK-2 细胞未明显凋亡,但H/R 组中HK-2 细胞出现大量凋亡,但胃饥饿素(400 ng/mL)预处理后,HK-2 细胞凋亡明显减少。表明胃饥饿素能有效抑制由缺氧/复氧损伤诱导的HK-2 细胞的凋亡,详见图4。
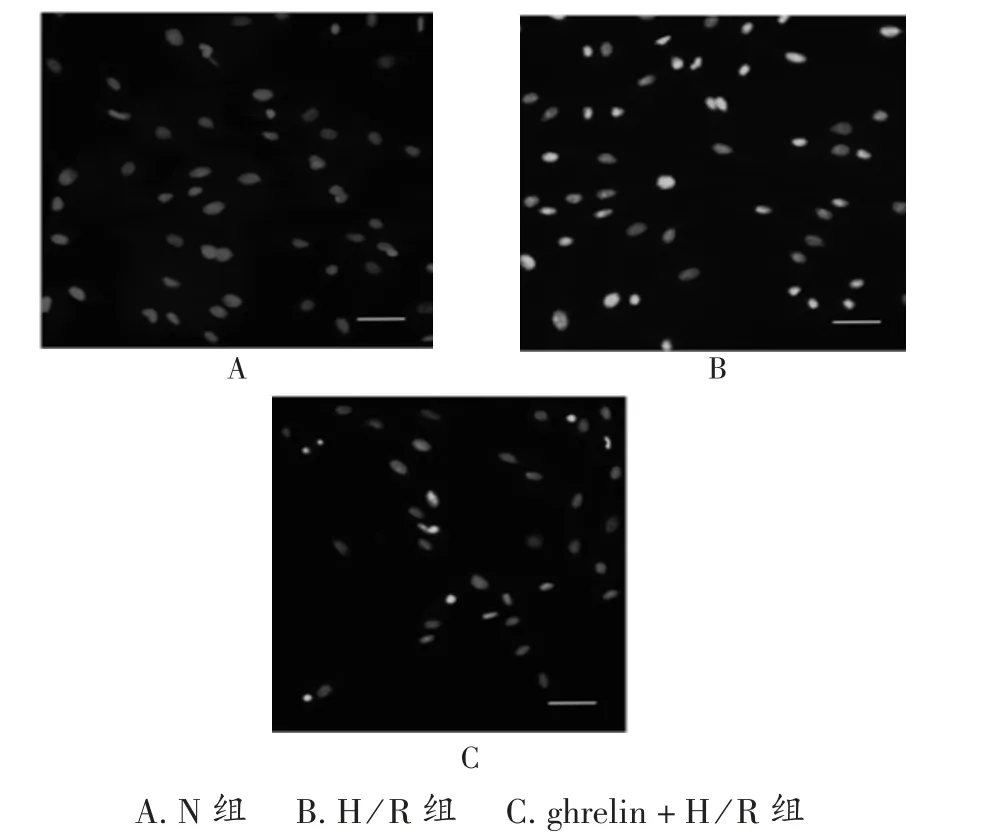
图4 胃饥饿素对缺氧/复氧损伤的HK-2 细胞凋亡的影响
2.4 对细胞中ERK 表达的影响
WB 试验结果表明,胃饥饿素对缺氧/复氧损伤的HK-2 细胞中总ERK 蛋白及磷酸化p-ERK 蛋白表达无影响,β-actin 为内参蛋白。详见图5。

图5 胃饥饿素对缺氧/复氧损伤的HK-2 细胞中ERK 表达的影响
2.5 对细胞中P38 表达的影响
WB 试验结果表明,胃饥饿素预处理后能显著增加缺氧/复氧损伤的HK-2 细胞中磷酸化P38 蛋白的表达。表明胃饥饿素可能是通过激活P38 信号通路保护HK-2 细胞缺氧/复氧的损伤。详见图6。
3 讨论
肾缺血再灌注的发病机制包括氧自由基的毒性、细胞凋亡、炎性反应、细胞内钙超载等,针对这些致病机制采取对应的治疗措施[8]。

图6 胃饥饿素对缺氧/复氧损伤的HK-2 细胞中P38 表达的影响
ANDREWS 等[9]研究发现,胃饥饿素可通过减少线粒体中活性氧来发挥抗氧化作用[9];胃饥饿素被证明可增加神经元细胞中UCP2 蛋白的表达[10];外源性注射胃饥饿素能刺激催乳素、促肾上腺皮质激素(ACTH)、皮质醇的分泌;胃饥饿素能通过引起啮齿动物和人类高血糖,降低胰岛素水平发挥厌食效应;胃饥饿素在心力衰竭和心肌缺血再灌注损伤中可起保护作用,在其他疾病如脓毒症和肠道缺血再灌注损伤中有有益作用[11]。
KEIKO 等[12]的研究发现,胃饥饿素在小鼠中能通过抗氧化应激机制保护其免受促血管生成素Ⅱ引起的肾脏损害。胃饥饿素通过迷走神经对动物肾缺血再灌注起保护作用[13]。提示胃饥饿素能在肾缺血再灌注损伤中起到一定作用,但其如何在这个过程发挥作用的机制尚不明确。
本研究中以人肾皮质近曲小管上皮细胞HK-2 细胞为模型,成功建立了体外缺氧/复氧损伤模型,并模拟肾缺血再灌注损伤模型。研究结果显示,胃饥饿素能提高缺氧/复氧细胞的活力,高质量浓度的胃饥饿素对细胞活力有一定损伤,提示在使用胃饥饿素预防肾缺血再灌注损伤时应当注意选择适当的浓度进行预处理,能在缺氧/复氧细胞模型中起到保护作用。WB 检测结果显示,ERK 蛋白表达无变化,胃饥饿素预处理后,p-P38 蛋白含量有显著提升。P38 有丝分裂素激活蛋白激酶(MAPK)是与细胞增殖、分化、凋亡密切相关的细胞转导的重要通道[14]。代谢综合征大鼠血管周围脂肪组织来源的瘦素可通过P38 通路促进血管平滑肌细胞由收缩型转换为增殖型[15]。故推测胃饥饿素能通过激活P38 信号通路保护HK-2 细胞缺氧/复氧的损伤,为进一步探讨胃饥饿素如何在肾缺血再灌注损伤中发挥作用提供了新思路。
