低氧诱导因子1α 调控蛋白酶激活受体1 在低氧诱导心肌细胞凋亡中的作用及机制*
2020-08-12孟庆雯王晓茜朱厚玲张园园
孟庆雯,王晓茜,朱厚玲,张园园△
(1. 海南医学院第一附属医院心血管内科,海南 海口 570100; 2. 海南医学院第一附属医院老年病科,海南 海口 570100)
低氧或缺氧在许多生物学或病理学过程中有至关重要的作用,特别是与缺氧与心肌缺血疾病相关,初期会引起细胞保护性反应,但最终会导致心肌细胞凋亡,严重影响其心脏功能[1]。细胞暴露于低氧浓度下会引发低氧反应,其生长和生存能力降低,主要由低氧诱导因子1 (HIF-1)协调[2]。低氧诱 导因子由3 种α 亚基(HIF-1α,HIF-2α,HIF-3α)和1 个β 亚基[(HIF-1β,又称芳基碳氢化合物核转运蛋白(ARNT)]构成的异质二聚体[3]。缺氧条件下,HIF-1α 与靶基因结构上的低氧反应元件(HRE 5′-RCGTG-3′)结合,被活化的HIF-1α 在靶基因转录起始部位形成一个转录起始复合物,从而调节靶基因的转录[4]。近年来,有研究表明,HIF-1α 在低氧条件下有诱导细胞凋亡的功能[5]。如何减少心肌细胞凋亡已成为保护心肌细胞的一大研究热点,尽管已被证实HIF-1α 在低氧条件下心肌细胞中表达被上调[5-6],但尚未报道HIF-1α 与PAR1 在低氧条件下心肌细胞中的相互作用。
蛋白酶激活受体(PARs)是单个7 跨膜G 蛋白偶联受体的一个亚家族,包括PAR1,PAR2,PAR3,PAR4[7]。其中PAR1 已被报道在多种细胞中有改变细胞形态和抑制细胞凋亡的作用,如胃癌细胞[8]、乳腺癌细胞[9]、结肠癌细胞[10]、食道癌细胞[11]、脐静脉内皮细胞[12]、肺动脉内皮细胞[13]等。有文献报道,PAR1 和HIF-1α 的表达强度在化学治疗(简称化疗)前后的乳腺癌组织中呈正相关[14]。本研究中探讨了低氧条件下HIF-1α 和PAR1 在H9c2 细胞中的表达,HIF-1α 和PAR1 的潜在关系,以及在低氧诱导心肌细胞凋亡中的作用和机制,为心肌缺血的预防及治疗提供了可能的靶点。现报道如下。
1 材料与方法
1.1 仪器、试剂与细胞
仪器:细胞培养箱;低温冰箱,均购自美国Thermo Fisher 公司;垂直电泳系统,蛋白转移系统,ChemiDocTMXRS+型凝胶成像分析系统,均购自美国BIO-RAD 公司;普通PCR 仪96 well,荧光实时定量PCR 仪,均购自美国Applied Biosystems 公司;倒置荧光显微镜,普通光学显微镜,均购自日本Olympus;M200 PRO 型酶标仪购自奥地利Tecan Infinite 公司。
试剂:DMEM 培养基(批号为12800017),胎牛血清(批号为16000-044),均购自美国Gibco 公司;引物由上海生物工程有限责任公司合成;质粒小抽试剂盒(批号为D0003),BCA 试剂盒(批号为P0011),均购自Beyotime 公司;LipofectamineTM3000(美国Invitrogen 公司,批 号 为L3000-015);Trizol 试 剂,RIPA 裂 解 液,IP Buffer 裂解液,均购自Themo Fisher Scientific 公司;SYBR Premix EX TaqTMⅡ试剂盒(日本TaKaRa 公司,批号为RR420A);四氮唑(MTT,Solarbao,批号为M8180);原位末端转移酶标记(TUNEL)试剂盒(上海Roche 公司,批号为11684817910);兔抗HIF-1α 抗体(批号为36169),兔抗Bcl-2 抗体(批号为3498),兔抗Bax 抗体(批号为5023),兔抗β-actin 抗体(批号为8457),均购自美国Cell Signaling Technology 公司;兔抗PAR1 抗体(美国Abcam 公司,批号为ab32611)。
细胞:大鼠心肌细胞系H9c2(中国科学院上海细胞生物学研究所)。
1.2 方法
1.2.1 细胞培养
用含10%胎牛血清的高糖DMEM 培养H9c2 细胞,置37 ℃、95%O2、5%CO2细胞培养箱中培养,48 h 全换液1 次,保证细胞正常生长所需营养,待细胞密度长至90%,使用0.25%胰酶消化进行传代。选取对数生长期的细胞进行试验,将细胞分为常氧组和低氧组。常氧组将细胞置37 ℃、95%O2、5%CO2培养箱中培养,低氧组将细胞置37 ℃、1%O2、94%N2、5% CO2培养箱中培养。
1.2.2 质粒构建
选择PSUPER 作为载体,对公司合成的引物进行1 000 r/min、4 ℃离心5 ~10 min,按管壁上标注的体积加入Milli-Q 水,混匀,4 ℃保存待用,或直接进行PCR,扩增出目的片段,制备1%琼脂糖凝胶,将目的片段点样并跑胶,跑胶结束后在紫外灯下进行切胶,采用DNA 纯化回收试剂盒进行胶回收,对胶回收产物进行跑胶验证,再进行酶切、酶联、转化、质粒抽提,初步得到HIF-1α siRNA 和PAR1 siRNA 质粒,再对质粒进行酶切验证,对PCR 产物进行琼脂糖凝胶,验证质粒是否构建成功。
1.2.3 细胞转染
转染前,对细胞进行全换液,待细胞密度长至60%时进行转染。转染时取3 个灭菌的EP 管,分别加入500μL无血清的DMEM,再加入质粒和LipofectamineTM3000,混匀,室温静置5 min,将含有LipofectamineTM3000 的无血清DMEM 均分于已加质粒的EP 管中,混匀,室温静置20 min,将EP 管中的混合液加入H9c2 心肌细胞培养皿,在37 ℃、95%O2、5%CO2培养箱中培养6 h,更换新的培养液继续培养,24 h 后再对细胞进行低氧(37 ℃、1%O2、94%N2、5%CO2)处理。
1.2.4 蛋白质印迹(WB)法检测HIF-1α 和PAR1 的蛋白表达
待各处理组细胞长至对数生长期,用IP Buffer 裂解液(含0.5%NP40 并加入蛋白酶抑制剂)在4 ℃摇床裂解细胞30 min,14 000 r/min,(4 ℃)离心15 min,取上清液,按Bradford 法进行蛋白质定量,加入4sample Buffer 混合,沸水浴10 min,制备8%的SDS-PAGE 胶进行点样电泳(分离胶80 V、20 min,浓缩胶100 V,1 h),转膜(100 V、150 min),用5% 脱脂奶粉室温封闭1 h,用1 TBST 洗3 次,每次10 min,一抗包括兔抗β-actin抗体(1 ∶2 000),兔抗HIF-1α 抗体(1 ∶2 000),兔抗PAR1 抗体(1 ∶2 000),兔抗Bcl-2 抗体(1 ∶2 000),兔抗Bax 抗体(1 ∶2 000),于4 ℃摇床孵育过夜,次日用1 TBST 洗3 次,每次10 min,室温孵育二抗山羊抗兔IgG 抗体(1 ∶1 000)1 h,再用1 TBST 洗3 次,每次10 min,显影曝光。用Image-Pro Plus 图像分析系统对蛋白条带进行分析。
1.2.5 RNA 提取和实时荧光定量PCR(qRT-PCR)法检测HIF-1α 和PAR1 的mRNA 表达
采用TRIzol 提取细胞总RNA。用Nanodrop 2000 型超微量分光光度计测量样品总RNA 浓度,并将每个配对的样品调节至相同浓度。采用cDNA 逆转录试剂盒将总RNA 反转录成cDNA。使用SYBR Premix EX TaqTM试剂盒进行RT-PCR。GAPDH 作为HIF-1α,PAR1,Bcl-2,Bax 的内部参考。使用FTC-3000p 型实时PCR 系统完成实验后,采用2-△△Ct法分析数据。引物见表1。

表1 引物序列
1.2.6 RNA 印迹(NB)法检测HIF-1α 和PAR1 的RNA 水平
制备1%的琼脂糖凝胶,将提取的总RNA 进行点样并电泳(120 V、20 min),分离得到的RNA 胶进行转膜,转移到硝酸纤维素膜上,进行15 h 转膜,结束后,将膜放在6×SSC 中浸泡5 min,以去除膜上残留凝胶。将凝胶置紫外灯下,观察胶块上有无残留的RNA,膜置80 ℃,真空干烤1 ~2 h。烤干后的膜用塑料袋密封,4 ℃保存备用,进行探针标记和杂交,42 ℃杂交16 h 后,洗膜,显影。
1.2.7 TUNEL 法检测心肌细胞凋亡
分别取出常氧组、低氧组、NC 组和PAR1 组的H9c2 心肌细胞爬片,用预冷的4%多聚甲醛(PFA)在4 ℃冰箱中固定30 min,用1×PBS(pH=7.4)洗10 min,加入含有0.2% Triton-X-100 的磷酸缓冲液(PBS),冰上孵育2 min,增加细胞通透性,再加入荧光素FITC 标记的核苷酸和脱氧核苷酸末端转移酶(TDT)混合液,37 ℃避光孵育60 min,1×PBS(pH=7.4)洗3 次,每次10 min,用抗荧光淬灭封片剂封片,待封片剂干透后将载玻片置4 ℃冰箱保存,次日在荧光显微镜下观察。
细胞凋亡指数=凋亡细胞核百分比/细胞核总数
1.2.8 MTT 法检测细胞活力
待H9c2 心肌细胞长至对数生长期,用0.25%胰酶消化细胞,收集于离心管,以1 000 r/min 离心5 min,用新的培养液重悬细胞,接种至96 孔板,接种密度为1×105,每孔100 μL,待细胞贴壁培养6 h 后进行后续实验处理,每组做6 个复孔,待处理结束后,每孔加入10 μL MTT 溶液(5 mg / mL),培养4 h,吸走培养液,每孔再加入150 μL 二甲基亚砜(DMSO),放置摇床振荡10 min,使结晶充分溶解,采用酶联免疫检测仪上光密度(OD)于490 nm 波长处检测每孔的吸光度,吸光度最好在0 ~0.7 范围内。
细胞存活率(%)=(OD试验组/OD对照组)×100%
1.3 统计学处理
采用SPSS 19.0 统计学软件分析。至少取3 次独立实验结果,以均数±标准差()表示,两组间比较采用LSD 法,多组间比较采用单向方差分析。P<0.05 为差异有统计学意义。
2 结果
2.1 低氧条件下对H9c2 细胞活力及凋亡的影响
对H9c2 细胞进行常氧和低氧时间梯度(2,6,12,24 h)处理,通过形态观察发现,与常氧组相比,低氧各组细胞形态缩小、变形,详见图1 A;TUNEL 染色结果显示,与常氧组相比,低氧各组H9c2 细胞凋亡随时间梯度逐渐增加,详见图1 B 和图1 C;MTT 分析结果显示,与常氧组相比,低氧各组H9c2 细胞的活力更差,详见图1 D。可见,低氧降低了H9c2 细胞的活力,并诱导了H9c2 细胞的凋亡。
2.2 HIF-1α 和PAR1 在低氧条件下H9c2 细胞中的表达情况
qRT-PCR 结果显示,低氧条件下H9c2 细胞中HIF-1α 和PAR1 的表达上调,随着低氧时间梯度处理有上升趋势,详见图2 A。WB 结果与qRT-PCR 检测结果一致,详见图2 B 及图2 C。可见,低氧诱导HIF-1α和PAR1 的表达。
2.3 敲除PAR1 对低氧条件下H9c2 细胞活力及细胞凋亡的影响
构建PAR1 siRNA 质粒,将PCR 产物进行琼脂糖凝胶电泳,初步验证质粒构建成功,详见图3 A。将构建好的质粒进行细胞转染,将H9c2 细胞分为4 组,分别为常氧组(A 组)、常氧+siNC 组(B 组)、低氧+siNC 组(C 组)和低氧+PAR1 siRNA 组(D 组)。WB 结果显示,与C 组比较,D 组的PRA1 显著降低,表明细胞转染成功,详见图3 B 和图3 C。通过形态观察发现,在H9c2 细胞中敲除PAR1 后再低氧处理H9c2 细胞,相比于直接低氧处理H9c2 细胞,H9c2 细胞体积明显增大,详见图3 D。TUNEL 染色结果显示,在H9c2 细胞中敲除PAR1 后再低氧处理H9c2 细胞比直接低氧处理H9c2 细胞可明显缓解由低氧引起的H9c2 细胞凋亡,详见图3 E 和图3 F。MTT 结果显示,在H9c2 细胞中敲除PAR1 后再低氧处理H9c2 细胞,比直接低氧处理H9c2 细胞可明显提高H9c2 细胞的活力,详见图3 G。可见,在H9c2 细胞中敲除PAR1 可改善由低氧引起的H9c2 细胞体积的缩小,增强H9c2 细胞活力,并抑制H9c2 细胞的凋亡。
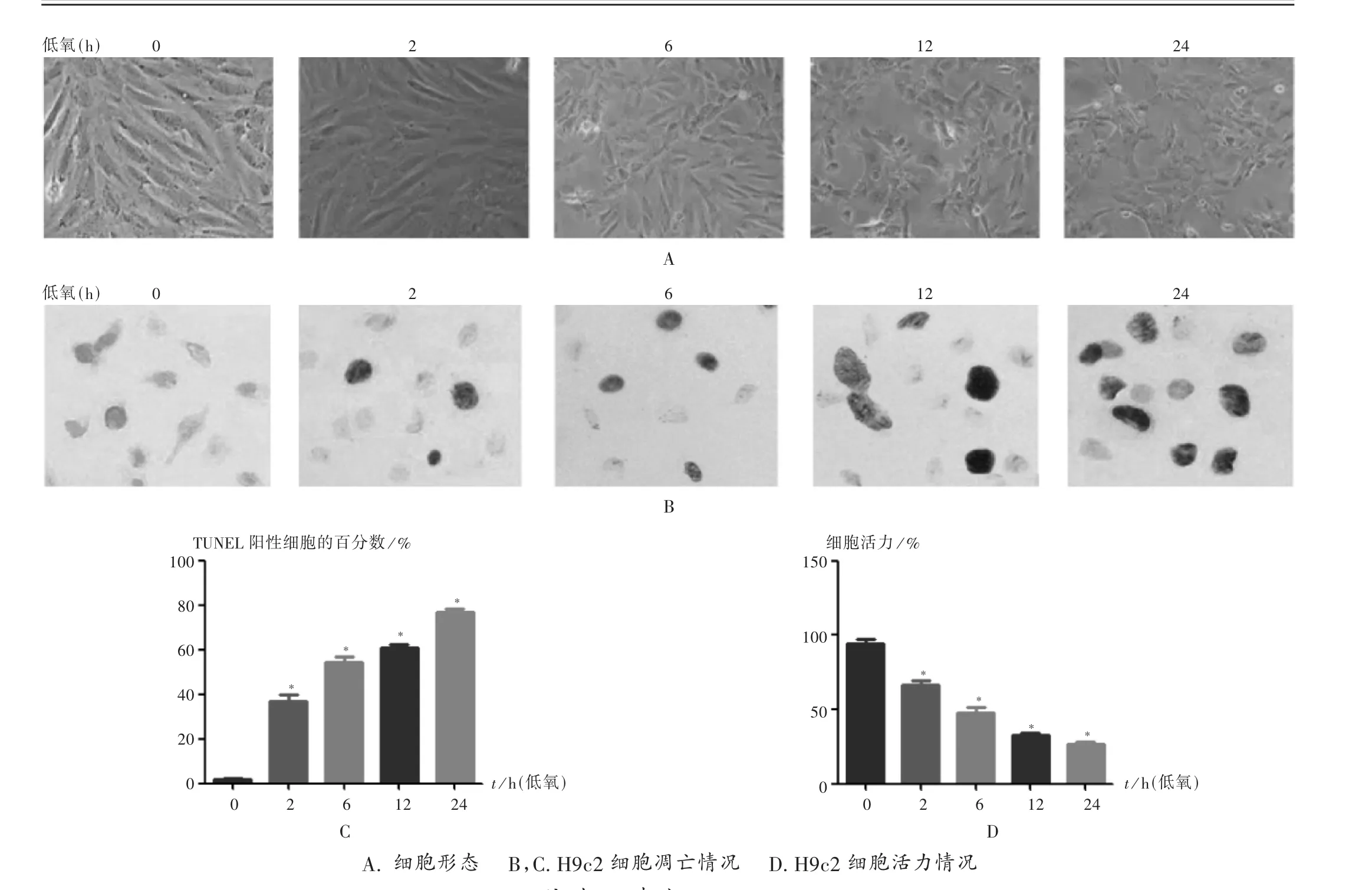
图1 低氧条件下H9c2 细胞活力及生存变化情况

图2 低氧条件下H9c2 细胞中HIF-1α 和PAR1 的表达情况
2.4 敲除PAR1 对低氧条件下H9c2 细胞中HIF-1α及Bcl-2/Bax 表达的影响
低氧条件下会诱导H9c2 细胞凋亡,而Bcl-2/Bax信号通道已被报道可抑制细胞凋亡。为探讨低氧条件下PAR1 表达对H9c2 细胞的作用机制,将siNC 和PAR1 siRNA 质粒转染至H9c2 细胞24 h 后,对细胞进行低氧处理6 h。通过WB 法和qRT-PCR 法检测Bcl-2 和Bax 的表达。WB 结果显示,Bcl-2 在低氧时表达下降,敲除PAR1 后再低氧处理H9c2 细胞,相比于低氧时增加了Bcl-2 的表达。而Bax 在低氧时表达增加,敲除PAR1 后再低氧处理H9c2 细胞,相比于低氧时又降低了Bax 的表达,详见图4 A。qRT-PCR 结果与WB 结果一致,与常氧组相比,低氧组Bcl-2 表达下降,Bax 表达下降上升;与C 组相比,D 组Bcl-2 表达被上调,详见图4 B。Bax 表达下降被下调,详见图4 C。结果表明,在低氧条件下,H9c2 细胞中敲除PAR1 可通过调控Bcl-2/Bax 的表达比例来抑制细胞的凋亡。

图3 敲除PAR1 对低氧条件下H9c2 细胞形态、细胞凋亡及活力的影响
2.5 抑制HIF-1α 的表达对低氧条件下引起的PAR1 上调的影响
将siNC 和HIF-1α siRNA 转染至H9c2 细胞中24 h后再低氧处理细胞6h,通过NB 法和WB 法检测HIF-1α和PAR1 在H9c2 心肌细胞中的表达。结果见图5 A 和图5 B,与C 组相比,低氧+HIF-1α siRNA 组(E 组)明显限制了由缺氧引起的PAR1 的上调,表明低氧条件下PAR1 的表达受HIF-1α 的正调控。

图4 敲除PAR1 对HIF-1α,Bcl-2 /Bax 表达的影响

图5 敲除HIF-1α 限制缺氧引起的PAR1 的上调
3 讨论
缺氧常被用来解释心脏功能的改变,特别是在心肌缺血的患者中,缺氧是一种常见现象[15]。多数研究表明,缺氧导致心肌缺血的致病机制非常复杂,如在轻度或中度缺氧时,大脑的能量供应几乎未受到损害,严重缺氧时会产生细胞毒性,引起细胞凋亡或死亡[16]。细胞凋亡主要是由于外源性死亡受体途径或线粒体途径介导发生[17]。因此,深入了解细胞凋亡在缺氧条件下的调控机制,可为心肌缺血的治疗提供更具体的方法。
HIF-1α 是缺氧条件下参与血管生成、糖酵解代谢和细胞增殖/存活过程中调控多个基因转录的关键蛋白[18],是一种氧依赖性被细胞内泛素蛋白酶降解的蛋白质[19]。其只在缺氧条件下稳定表达,HIF-1α 积累和HIF-1β形成二聚体,二聚体激活启动子区中含有缺氧反应元件(HREs)的下游基因[20]。HIF-1α 在常氧时不表达,在低氧条件下高表达,且HIF-1α 表达的上调可促进细胞的凋亡[21-22]。本研究结果显示,HIF-1α 在低氧条件下H9c2 细胞中高表达,且可诱导H9c2 细胞的凋亡,与文献[23]报道一致。进一步在低氧条件下H9c2 细胞中转染HIF-1α siRNA,WB 和NB 检测结果显示,HIF-1α可正调控PAR1 的表达,表明PAR1 可能是HIF-1α 的下游。
PAR1 是一种G 蛋白偶联的跨膜受体,为高亲和力凝血酶受体[7,24],几乎在所有类型的血管壁细胞中表达,包括内皮细胞、平滑肌细胞、血小板和巨噬细胞,并参与了内皮细胞的凋亡[25]。本研究中通过WB 和RT -PCR 法检测了PAR1 在低氧条件下H9c2 细胞中的蛋白和mRNA 表达水平,结果显示,PAR1 在低氧条件下高表达。同时,当在H9c2 细胞中敲除PAR1后再低氧处理细胞,发现敲除PAR1 可促进H9c2 细胞活力和抑制细胞凋亡,并上调Bcl -2 的表达和下调Bax 的表达。Bcl -2 基因家族是通过调节细胞的生存或死亡来维持组织的发育及稳态的,是一种新的原癌基因,即细胞凋亡的调节因子[26],其他主要通过抑制各种凋亡小体来延长细胞的存活[27]。Bax 是一种加速细胞死亡的同源蛋白,与Bcl -2 活性相反[28]。但Bcl -2 与Bax 可相互作用,在体内形成异二聚体,Bax过表达会抑制Bcl -2 的活性,引起细胞凋亡,两者表达的比例发生变化会直接影响细胞的生存与凋亡[29],故Bcl -2 / Bax 信号通路是调节抗氧途径细胞凋亡的变阻器[30]。本研究结果显示,H9c2 细胞中敲除PAR1可影响Bcl -2 与Bax 表达的比例,进而诱导H9c2 细胞的凋亡。
综上所述,低氧条件下,HIF-1α 通过正调控PAR1的表达,进而改变Bcl-2/Bax 的表达比例,诱导H9c2细胞凋亡。本研究结果为低氧条件下细胞凋亡引起的心肌缺血提供了可能的治疗靶点。
