萝卜硫素对宫颈癌HeLa 细胞凋亡及放射敏感性的影响
2020-08-12张亚芳赵晓红王德珠张华凤王小花
张亚芳,赵晓红,王德珠,张华凤,王小花
(海南省妇女儿童医学中心妇产科,海南 海口 570206)
放射治疗(简称放疗)是治疗中晚期宫颈癌的主要手段,可实现宫颈癌的局部控制。但在宫颈癌的治疗中,耐放射治疗越来越受到重视,因其是放疗临床失败的原因之一[1]。但这种肿瘤耐辐射的分子机制尚不完全清楚。肿瘤细胞在细胞周期的G2/M 期对放射最敏感,在S 期对放射最耐受[2]。放疗可激活丝裂原活化蛋白激酶(MAPK)和磷脂酰肌醇3 激酶(PI3K)/蛋白激酶 B(AKT),这些通路调节细胞的增殖和凋亡,抑制这些途径可增强细胞的放射敏感性[3]。流行病学研究表明,经常食用水果和蔬菜对癌症的发展具有抑制作用[4]。萝卜硫素广泛存在于西兰花、卷心菜、花椰菜、甘蓝、萝卜、芥菜等十字花科植物中,在体外可抑制包括人结肠癌、白血病和前列腺癌细胞在内的几种癌细胞系的增殖,并增加其凋亡[5]。萝卜硫素还可诱导G2/M 期细胞周期停滞,降低S 期细胞的百分比,抑制体外癌细胞的组蛋白去乙酰化酶(HDAC)活性,并在体内延迟前列腺癌(PC-3)异种移植瘤的生长[6]。此外,萝卜硫素和其他药物联用可进一步抑制细胞生长,从而使药物和放疗剂量降低到比单用时更安全的水平,以确保更低的癌症发生率和不良反应等级[7]。本研究中观察了萝卜硫素对HeLa 细胞凋亡及体外放射的增敏作用,为宫颈癌的临床治疗提供参考。
1 材料与方法
1.1 仪器、试药与细胞
仪器:MK3 型酶标仪(南京德铁实验设备有限公司);Clinae 23EX 型直线加速器(美国Varian 公司);Ti-s 型倒置显微镜(日本Olympus 公司);BD 垂直电泳仪,BD/FACSC anto Ⅱ流式细胞仪,均购自美国BD 公司;E-Gel Imager 型凝胶成像仪(美国UVP 公司)。
试药:萝卜硫素(纯度大于99%,上海研生生化试剂有限公司);RPMI-1640 培养基和胎牛血清(美国HyClone 公司);胰酶和青链霉素溶液(美国Corning 公司);四氮唑(MTT,美国Amresco 公司);细胞凋亡检测试剂盒和细胞周期检测试剂盒(美国BD 公司);细胞蛋白抽提试剂盒(碧云天生物技术研究所);细胞外信号调节激酶(ERK1/2),磷酸化ERK1/2(p-ERK1/2),Akt、磷酸化Akt(p-Akt),半胱氨酸蛋白酶-3(Caspase-3),β-actin 抗体,均购自美国Santa Cruz 公司;辣根过氧化物酶HRP 标记亲和纯化山羊抗小鼠IgG 二抗(武汉艾美捷科技有限公司)。
细胞:宫颈癌HeLa 细胞(中国科学院典型培养物保藏委员会细胞库)。
1.2 细胞培养
用含胎牛血清(10%)的RPMI-1640 培养液在37℃、5%CO2条件下培养HeLa 细胞,隔日换液,选择对数生长期细胞进行试验。
1.3 MTT 法检测萝卜硫素和放射线的生长抑制作用
将HeLa 细胞以5×103个/孔接种于96 孔板中(每孔200 μL),用不同浓度萝卜硫素(0,10,20,40,80,160,320 μmol/L)或不同剂量放射线(0,1,2,4,6,8 Gy)干预24 h 后加入MTT(每孔50 μL),继续培养4 h,离心,弃上清液,加入二甲基亚砜(DMSO),每孔200 μL,振荡,用酶标仪在450 nm 波长处检定吸光度值(OD值),计算细胞抑制率。细胞抑制率=OD对照组-OD处理组/OD对照组×100%。
1.4 克隆形成试验观察萝卜硫素的放射增敏作用
将HeLa 细胞分为放射组和联合组。取对数生长期的HeLa 细胞以103个/孔接种于6 孔板中(每孔3 mL),待细胞贴壁后,联合组加入含有半数抑制浓度(IC50)的萝卜硫素,放射组不加萝卜硫素,同时用不同剂量放射线(0,1,2,4,6,8 Gy)照射24 h 后更换培养液,正常培养14 d,隔天换液。将细胞用磷酸盐缓冲液(PBS)洗涤,用甲醇固定,并用Giemsa 溶液染色。由2 名研究人员独立在显微镜下手动计数至少包含50 个细胞的菌落数。计算细胞克隆形成率(PE)和存活分数(SF),PE=菌落形成数/接种数×100% ,SF=PE测试组/ PE对照组×100% 。应用GraphPad Prism 软件5.01,按照SF=1-(1-eD/D0)N 公式生成剂量-生存曲线,并计算放射生物学参数,包括平均致死剂量(D0)、准致死剂量阈值剂量(Dq),临床实践中每日剂量2 Gy(SF2),外推数(N),D0时放射增敏比(SERD0)=D0对照组/D0实验组;Dq时放射增敏比(SERDq) =Dq对照组/D0实验组[8]。
1.5 流式细胞术检测细胞凋亡和细胞周期
将HeLa 细胞分为对照组、联合组、萝卜硫素组和放射组。对照组不进行处理,联合组用含有IC50的萝卜硫素和半数抑制剂量的放射线进行处理,萝卜硫素组用含有IC50的萝卜硫素处理,放射组用半数抑制剂量的放射线进行处理。将HeLa 细胞以5×104个/孔接种于6 孔板内(每孔3 mL),待细胞贴壁后,按上述分组分别处理HeLa 细胞24 h,弃培养基,消化后转移至离心管内,离心,弃上清液,根据试剂盒说明书,用流失细胞仪检测细胞凋亡和细胞周期。
1.6 蛋白质印迹(WB)法检测蛋白表达
以5×104/孔接种于6 孔板内(每孔3 mL),待细胞融合加入,按1.5 项下方法分组,分别处理HeLa 细胞24 h,收获细胞,根据细胞量加入细胞蛋白抽提液,进行电泳,每孔上样量为20 μg,将印迹转移到聚偏氟乙烯膜上,然后用5%脱脂牛奶在室温下封膜1 h,将膜与相应抗体进行孵育,4 ℃过夜,用TBST 缓冲液对膜进行2次冲洗,将二抗(1 ∶5 000)在室温下孵育30 min。用ECL法显色,采集图像进行分析。
1.7 统计学处理
采用SPSS 19.0 统计学软件分析。试验结果采用均数±标准差()表示,分析前进行正态检验,用单因素方差分析进行判断,组间两两比较用SNK-q检验。P<0.05 为差异有统计学意义。
2 结果
2.1 萝卜硫素对HeLa 细胞抑制作用的影响
随着萝卜硫素浓度的增加,HeLa 细胞抑制率增加,与0 μmol/L 比较,差异有统计学意义(P<0.05)。萝卜硫素对HeLa 细胞的IC50为(76.28±9.27)μmol/L,故选80 μmol/L 作为干预浓度。详见图1。
2.2 放射线对HeLa 细胞抑制作用的影响
随着放射线剂量的增加,HeLa 细胞抑制率增加,与0 Gy 比较,差异有统计学意义(P<0.05)。放射线对HeLa 细胞的半数抑菌剂量为(2.13±0.27)Gy,故选2 Gy作为半干预剂量(P<0.05)。详见图2。
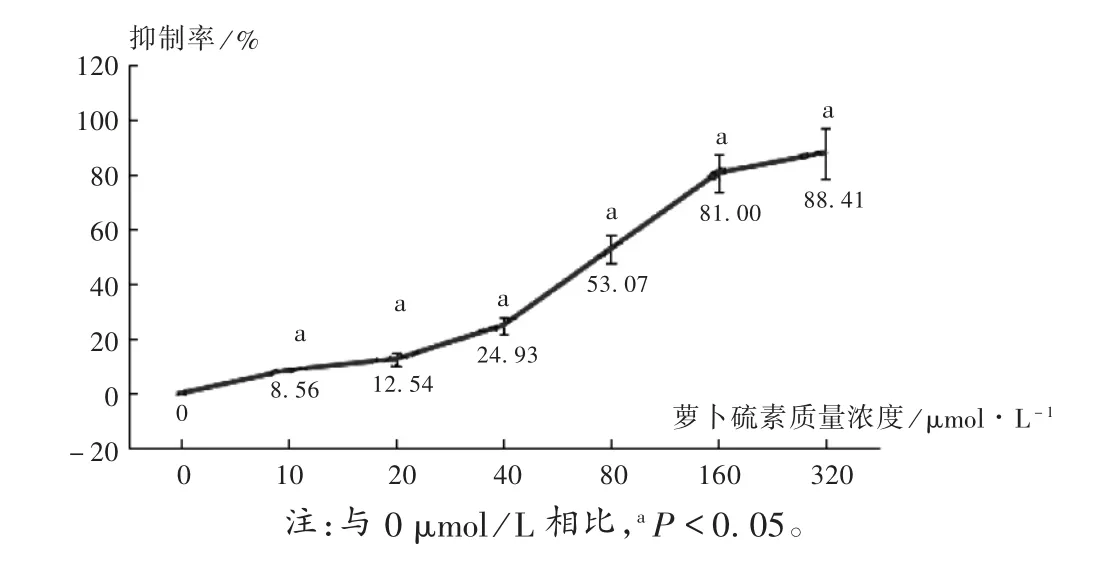
图1 萝卜硫素对HeLa 细胞抑制作用的影响
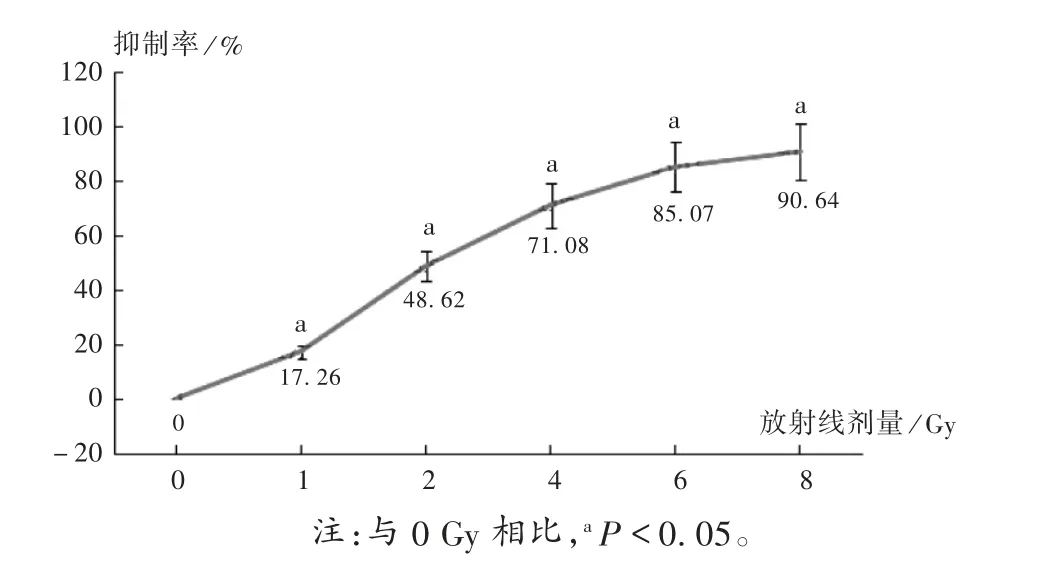
图2 放射线对HeLa 细胞抑制作用的影响
2.3 萝卜硫素对HeLa 细胞放射敏感性的影响
随着放射剂量的增加,放射组和联合组细胞存活率均降低,且联合组各放射剂量的细胞存活率均低于放射组,差异有统计学意义(P<0.05)。萝卜硫素能提高HeLa 细胞的放射敏感性,SERD0和SERDq分别为1.517 和2.024。详见表1 和图3。

表1 剂量-生存曲线的放射生物学参数
2.4 萝卜硫素对HeLa 细胞凋亡和细胞周期的影响
各组HeLa 细胞G0/G1期细胞比例变化不显著,差异无统计学意义(P >0.05);与对照组比较,其余各组HeLa 细胞凋亡和G2/M 期细胞比例增加,S 期细胞比例降低,差异有统计学意义(P<0.05);与萝卜硫素组和放射组比较,联合组HeLa 细胞凋亡和G2/M 期细胞比例增加,S 期细胞比例降低,差异有统计学意义(P<0.05),详见表2 和图4、图5。
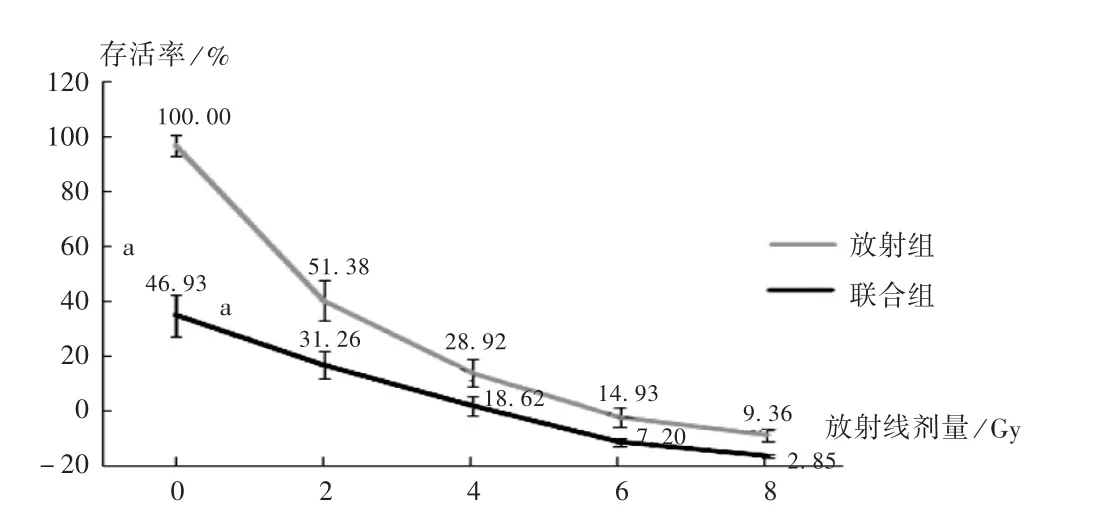
图3 萝卜硫素对HeLa 细胞放射敏感性的影响
表2 萝卜硫素对HeLa 细胞凋亡和细胞周期的影响(±s,%)

表2 萝卜硫素对HeLa 细胞凋亡和细胞周期的影响(±s,%)
注:与对照组比较,a P<0.05;与萝卜硫素组比较,b P<0.05;与放射组比较,c P<0.05。
组别对照组萝卜硫素组放射组联合组细胞凋亡率1.95±0.13 3.12±0.18a 4.35±0.46ab 6.35±0.37abc G0/G1 62.51±4.28 60.07±4.58 60.38±7.59 62.48±6.73 S 25.95±2.06 22.29±3.17a 20.14±5.36ab 14.50±4.83abc G2/M 11.54±2.17 18.64±0.25a 19.48±3.54ab 23.02±4.92abc
2.5 萝卜硫素对HeLa 细胞中ERK1/2,p-ERK1/2,Akt,p-Akt,Caspase-3 蛋白表达的影响
与对照组比较,其余各组HeLa 细胞中ERK1/2,p-ERK1/2,Akt,p-Akt,Caspase-3 蛋白表达增加,差异有统计学意义(P<0.05);与萝卜硫素组和放射组比较,联合组HeLa 细胞中ERK1/2,p-ERK1/2,Akt,p-Akt,Caspase-3 蛋白表达增加,差异有统计学意义(P<0.05)。详见表3。
3 讨论

图4 萝卜硫素对HeLa 细胞凋亡的影响
萝卜硫素最早于1992年在花椰菜芽中被发现,是一种著名的抗癌化学预防剂,可抑制骨肉瘤细胞和其他恶性肿瘤的生长,其肿瘤抑制作用已在临床试验中被评估,包括前列腺癌患者的Ⅱ期试验[9]。虽然萝卜硫素的抗癌作用已在众多研究中被报道,但其增强癌细胞放射敏感性的作用至今未被研究。同时,相比于其他化学治疗(简称化疗)药物的高毒性和多种不良反应,大鼠口服有效剂量的萝卜硫素后,其最大血药浓度为20 μmol/L,但人类口服富含萝卜硫素的西兰花芽后,最大血药浓度仅为2 μmol/L[10]。本研究结果显示,萝卜硫素对体外培养的HeLa 细胞增殖有抑制作用,且呈浓度依赖性。在克隆形成试验中,与未加萝卜硫素处理的细胞相比,萝卜硫素处理细胞的放射敏感性呈剂量依赖性增加,表明萝卜硫素可增强HeLa 细胞的放射敏感性。
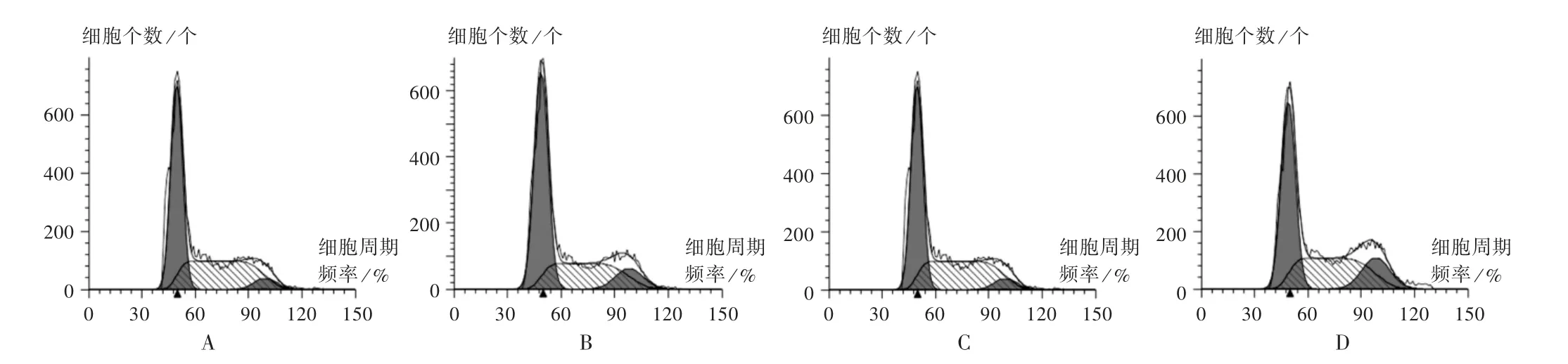
图5 萝卜硫素对HeLa 细胞周期的影响
表3 萝卜硫素对HeLa 细胞中ERK1 /2,p-ERK1/2,Akt,p-Akt,Caspase-3 蛋白表达的影响(±s)
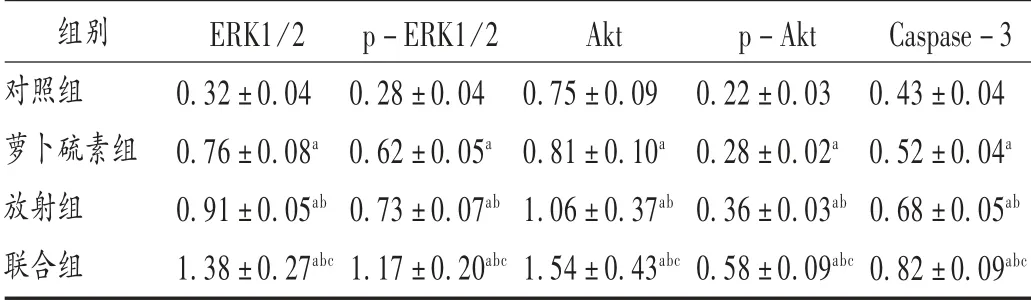
表3 萝卜硫素对HeLa 细胞中ERK1 /2,p-ERK1/2,Akt,p-Akt,Caspase-3 蛋白表达的影响(±s)
注:与对照组比较,a P<0.05;与萝卜硫素组比较,b P<0.05;与放射组比较,c P<0.05。
组别对照组萝卜硫素组放射组联合组ERK1/2 0.32±0.04 0.76±0.08a 0.91±0.05ab 1.38±0.27abc p-ERK1/2 0.28±0.04 0.62±0.05a 0.73±0.07ab 1.17±0.20abc Akt 0.75±0.09 0.81±0.10a 1.06±0.37ab 1.54±0.43abc p-Akt 0.22±0.03 0.28±0.02a 0.36±0.03ab 0.58±0.09abc Caspase-3 0.43±0.04 0.52±0.04a 0.68±0.05ab 0.82±0.09abc
细胞周期阻滞和凋亡被认为是萝卜硫素最重要的作用机制[11]。研究表明,在细胞周期中,G2/M 期对放射最敏感[12]。因此,诱导细胞周期阻滞在G2/M 期的药物在体内外都表现出了很强的放射敏感性。萝卜硫素在人骨肉瘤U2OS 细胞中诱导G2/M 阻滞和凋亡[13],在人骨肉瘤MG63 细胞中诱导生长阻滞,并以p53 独立的方式上调p21WAF1/CIP1 蛋白的表达[14]。本研究中流式细胞术结果显示,萝卜硫素或(和)萝卜硫素联合放射可抑制G2/M 期细胞周期进展,诱导HeLa 细胞凋亡。但萝卜硫素和放射的确切协同作用机制目前尚不清楚。据报道,激活ERK1/2 和Akt 激酶可使G2/M 期停止,增加细胞对放射诱导的细胞死亡敏感。但辐射抵抗可能是由于放射抑制ERK1/2 和Akt,导致肿瘤细胞动态快速适应,以维持生长和生存能力[15-16]。因此,ERK1/2 和Akt的激活可能增强肿瘤的放射敏感性。萝卜硫素通过引起G2/M 期阻滞来抑制LM8 细胞的生长,表现为促进细胞Akt 和ERK1/2 的磷酸化,通过Caspase-3 的裂解和激活,调节细胞凋亡和细胞增殖[17]。在胰腺癌细胞中,萝卜硫素通过抑制PI3K/Akt 和MEK/ERK 通路诱导细胞凋亡[18]。本研究结果显示,萝卜硫素增强了放射诱导的ERK1/2 和Akt 磷酸化,表明萝卜硫素可增强HeLa细胞的放射敏感性。
综上所述,萝卜硫素通过G2/M 期阻滞诱导HeLa细胞凋亡,并通过ERK 和Akt 的激活,增强了HeLa 细胞的放射敏感性。萝卜硫素联合放射可能有助于增强萝卜硫素的抗肿瘤作用,提示萝卜硫素可能是一种有效的放射增敏剂。
