外源性信号通路JAK/STAT在ALA-光动力诱导人SCC细胞凋亡中的作用
2020-08-12杨志勇梅竹松
乔 丽 李 强 蔡 宏 田 蓉 杨志勇 梅竹松 李 菲
1空军特色医学中心皮肤科,北京,100142;2空军特色医学中心临床医学实验室,北京,100142
皮肤鳞状细胞癌(squamous cell carcinoma,SCC)在老年人中较为常见,对于难以手术的患者,可采用光动力疗法激活机体的免疫系统对肿瘤细胞进行杀伤治疗[1,2]。相对于常规的手术、放疗、化疗、免疫治疗等方法,光动力疗法具有创伤小,无明显痛苦,可选择性的作用于肿瘤区域,不受皮损数目和部位的限制等优势,因此逐渐广泛用于皮肤的浅表肿瘤,如基底细胞癌、Bowen病、SCC等[3]。5-氨基戊酮酸光动力学疗法(5-aminolaevulinic acid-based photodynamic therapy,5-ALA-PDT)采用基于5-氨基乙酰丙酸(ALA)进行的一种光动力疗法,临床实践发现其具有安全,简单和有效的特点,已逐渐成为一种具有应用前景的治疗非色素性皮肤癌的新选择[4]。尽管光动力治疗肿瘤的方法越来越多的用于临床实践,但其导致肿瘤细胞死亡的机制尚未完全阐明。
以往研究认为光动力诱导肿瘤细胞以外源性凋亡为主,本研究着重于研究外源性凋亡通路如JAK/STAT信号通路在ALA-PDT对人SCC细胞增殖、凋亡中所发挥的作用。
1 材料与方法
1.1 材料
1.1.1 细胞来源 A431和COLO-16细胞获赠于中国医学科学院皮肤病研究所张源主任。细胞培养于DMEM高糖培养基(Dulbecco’s modified Eagle’s medium):4 mM L-谷胺酰胺,100 U/mL青霉素,0.1 mg/mL streptomycin,1 mM sodium pyruvate,100 mM HEPES),置于含有5%的CO2,37℃的孵育箱中培养。由于细胞系可以在没有血清的情况下短暂生长,为了避免PpIX快速释放到培养基中,血清不会被添加到DMEM中[4]。
1.1.2 PDT处理参数 采用波长为630 nm的半导体激光进行照射[5],调整功率密度为10 mW/cm2照射时间分别为125 s、250 s、500 s,即能量密度分别为1.25、2.5、5 J/cm2[能量密度(J/cm2)=功率密度(W/cm2)×照射时间(s)]。
1.2 方法
1.2.1 A431和COLO-16细胞的传代培养 用胰酶消化1~2 min后,置于显微镜下观察A431和COLO-16细胞是否变圆并且逐渐从培养皿中脱落,当细胞变圆且完全脱落呈游离状态时终止消化。收集消化液,用1500 rpm离心3 min后收集细胞沉淀。用适当体积、配置好的培养基悬浮细胞,并分别用装到枪头转移到新的培养皿中。最后将培养皿置于细胞培养箱中,每天在显微镜下观察细胞的生长情况,隔日换液。
1.2.2 pCDNA3.1-STAT3过表达质粒转染实验 (1)实验分为空白对照组(不采取任何干预)、pCDNA3.1+-DYK5453bp阴性对照组(仅转染pCDNA3.1+-DYK5453bp对照质粒)、pCDNA3.1-STAT3组(转染pCDNA3.1-STAT3质粒)。消化A431和COLO-16(2×105个/孔)细胞均匀接种于培养皿中,加入无抗生素培养基2 mL,待A431细胞融合至70%~80%进行实验。
(2)在EP管中分别加入50 μL的 opti-MEM、5 μL的lipofectamine2000,再加入2 μg的pCDNA3.1+-DYK5453bp或pCDNA3.1-STAT3的50 μL opti-MEM;2管混合均匀,室温下10 min,将混合液再用枪头吸入培养皿中。
(3)培养5 h后换成无抗生素的DMEM培养基继续培养。收集转染成功的细胞,用QRT-PCR后的方法检测STAT3 mRNA的表达水平变化(24 h);用Western Blot的方法检测STAT3蛋白的表达水平变化(48 h后)。每组实验重复5次。
1.2.3 STAT3-siRNA转染实验 (1)将合成好的STAT3-siRNA吸入EP管中,4000 rpm,离心3 min,使STAT3-siRNA沉淀在管底部,按平均每OD用DEPC 130 μL的水稀释,用枪头吸入 PCR管中,用于后续实验或-80℃冰冻保存。
(2)实验分为siRNA组(转染STAT3-siRNA)、Vehicle空白对照组(不采取任何干预)、NC阴性对照组(仅转染阴性对照siRNA)。消化A431均匀接种于25 mm细胞培养皿中,每皿中加入完全DMEM培养基,待A431细胞融合至70%~80%进行实验。
(3)将5 μL lipofectamine2000的95 μL opti-MEM用枪头吸入EP管;再用枪头将含有5 μL STAT3siRNA的95 μL opti-MEM吸入另一EP管。两个EP管混合均匀,置于室温10 min,再用枪头吸入培养皿中。
(4)培养5 h后换成无抗生素的DMEM培养基继续培养。收集转染成功的细胞,用QRT-PCR后的方法检测STAT3mRNA的表达水平变化(24 h);用Western Blot的方法检测STAT3蛋白的表达水平变化(48 h后)。每组实验重复5次。
1.2.4 细胞增殖实验(MMT) A431和COLO-16细胞在96孔板中培养 (约10000个细胞/孔)。细胞转染pCDNA3-STAT3或STAT3-siRNA或阴性对照,之后采用不同浓度的ALA(0.3,0.6,1.2,2.4,4.8 mM)在无血清条件下培养4 h,而对照组仅在无血清培养基中培养。换液,给予细胞5 J/cm2的光照,并孵育24 h;采用MTT法检测细胞活力,该实验设置三次独立平行试验(具体的实验操作步骤同实验第二部分)。
1.2.5 流式细胞仪检测(FCM) A431和COLO-16细胞转染pCDNA3-STAT3或 STAT3-siRNA或阴性对照,之后采用在含4.8 mM ALA无血清培养4 h,然后用2.5 J/cm2(10 mW/cm2,250 s)的光照处理,并继续培育20 h,对照组不给予光敏剂和照射治疗,收集细胞。采用Annexin V-FITC Apoptosis Detection Kit(美国BD公司)检测细胞凋亡(具体的实验操作步骤同实验第二部分)。
1.2.6 qRT-PCR 采用Trizol(美国Invitrogen公司)提取A431和COLO-16细胞的总RNA,用紫外分光光度计(美国基因有限公司)用来检测RNA的浓度。取1 μg提取的RNA采用SuperScript first-strand synthesis system(美国Invitrogen公司)进行逆转录生成cDNA。分别设计不同的引物采用QuantiTect SYBR Green kits(美国Invitrogen公司)进行实时定量PCR测定STAT3、bcl-2、Bax和β-actin的表达水平。
1.2.7 Western Blot 蛋白质样本通过SDS-PAGE分离,并通过电泳转移到PVDF膜上,分别采用相应的抗体进行蛋白质印迹分析[STAT3(1∶500); Bax (1∶500); Bcl-2(1∶500);β-actin (1∶5000)]。选用β-actin作为内参。
2 结果
2.1 STAT3对ALA-PDT细胞抑制作用的影响 高表达STAT3可以显著缓解5-ALA-PDT诱导的A431和COLO-16细胞存活率的下降,而敲低STAT3促进了A431和COLO-16细胞存活率的下降(图1)。
2.2 STAT3参与了ALA-PDT诱导的细胞凋亡 高表达STAT3可以显著缓解5-ALA-PDT诱导A431和COLO-16细胞的凋亡,而敲低STAT3促进了5-ALA-PDT诱导的A431和COLO-16细胞的凋亡(图2、3)。
2.3 5-ALA-PDT处理可以导致STAT3和Bcl-2 mRNA水平和蛋白水平显著降低,Bax mRNA和蛋白的水平显著增加,高表达STAT3可以削弱这一变化,而敲低STAT3促进了这一变化(图4)。这表明STAT3可以通过调控凋亡相关因子Bcl-2以及Bax介导5-ALA-PDT诱导的细胞凋亡。
3 讨论
JAK-STAT信号通路是一条由EGFR及Src等受体启动的信号转导通路,研究发现其参与了细胞的增殖、分化、凋亡等许多生物过程[6-8]。以往研究表明,活化的STAT3对肿瘤细胞的形成和生长及凋亡抑制等过程起着重要的调控作用。由于在人类多种恶性肿瘤中(如脑瘤、前列腺癌、淋巴瘤、乳腺癌、各种白血病、鳞状细胞癌、基底细胞癌、黑素瘤等[9,10])STAT3活化呈现高表达,因此STAT3也被认为是癌基因。进一步研究发现STAT3的过度表达及活化与癌细胞的恶性转化有关[11,12]。大量研究结果显示多种细胞周期调控因子(c-fos、MEKs、cMyc和cyclinD1等)以及凋亡抑制因子(Survivin、Bcl-xl等)均是STAT3的下游靶基因[13,15],STAT3通过调控这些靶基因进而参与了肿瘤细胞的发生和演进[16]。在对细胞凋亡的研究中,Bcl-2家族受到广泛关注。Bcl-2家族蛋白是在细胞凋亡过程中起重要作用的一类蛋白质,根据它们在细胞凋亡中的作用可分为两类:一类是抵抗凋亡的蛋白,包括Bcl-2、Bcl.xL、BcI.w等十几个成员;另一类是促进凋亡的蛋白,包括Bax、Bak等几个成员。BCL-2家族的蛋白主要通过比例的变化发挥抵抗凋亡或促进凋亡的作用。研究发现,在使用5-氨基戊酮酸光动力学疗法对一些肿瘤的治疗过程中,肿瘤细胞主要以凋亡和坏死为主。且进一步研究发现内源性凋亡在光动力导致肿瘤细胞的凋亡中发挥重要作用,而外源性凋亡途径是否参与到光动力治疗肿瘤中尚未证实。
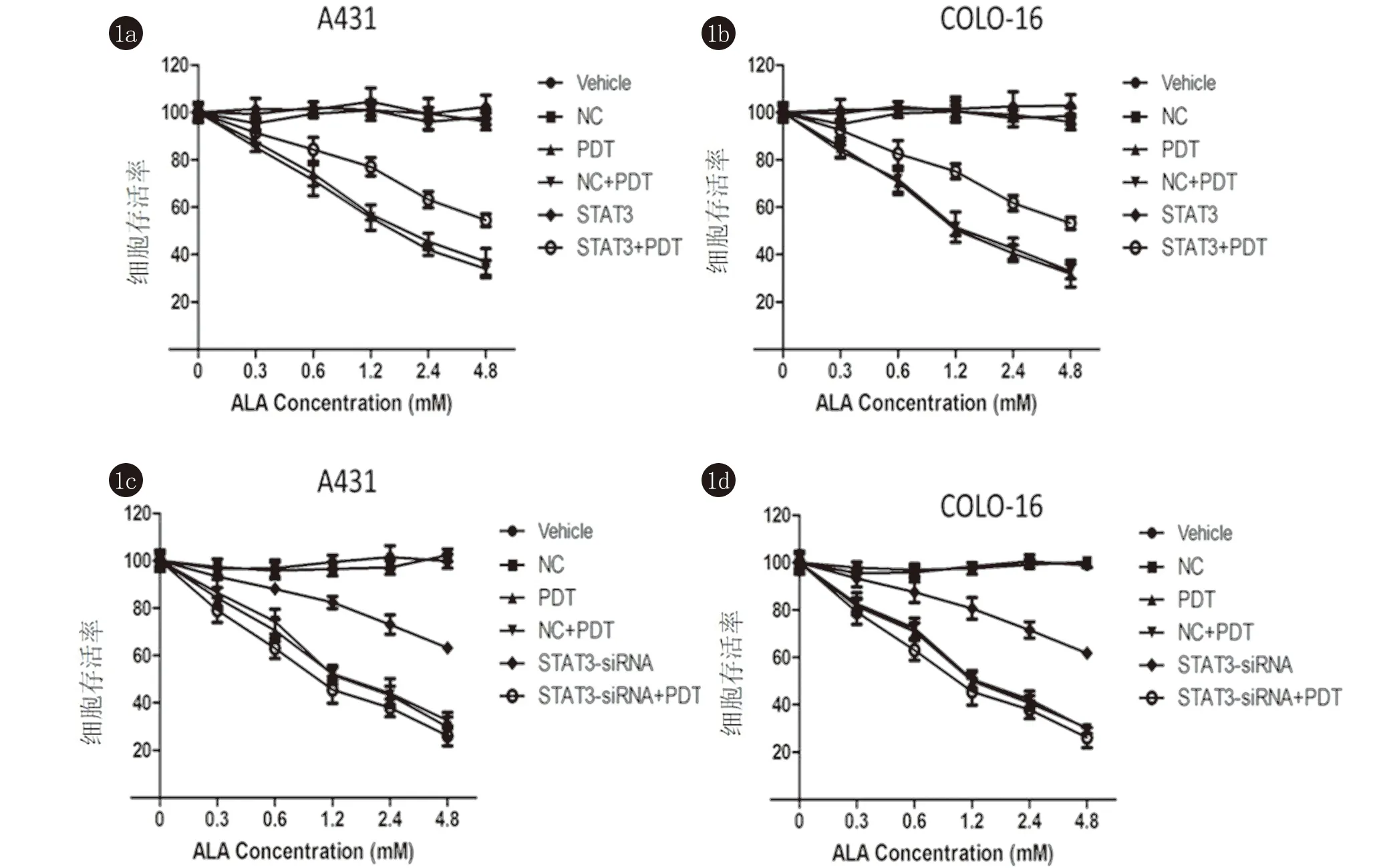
图1 各组A431和COLO-16细胞存活率比较
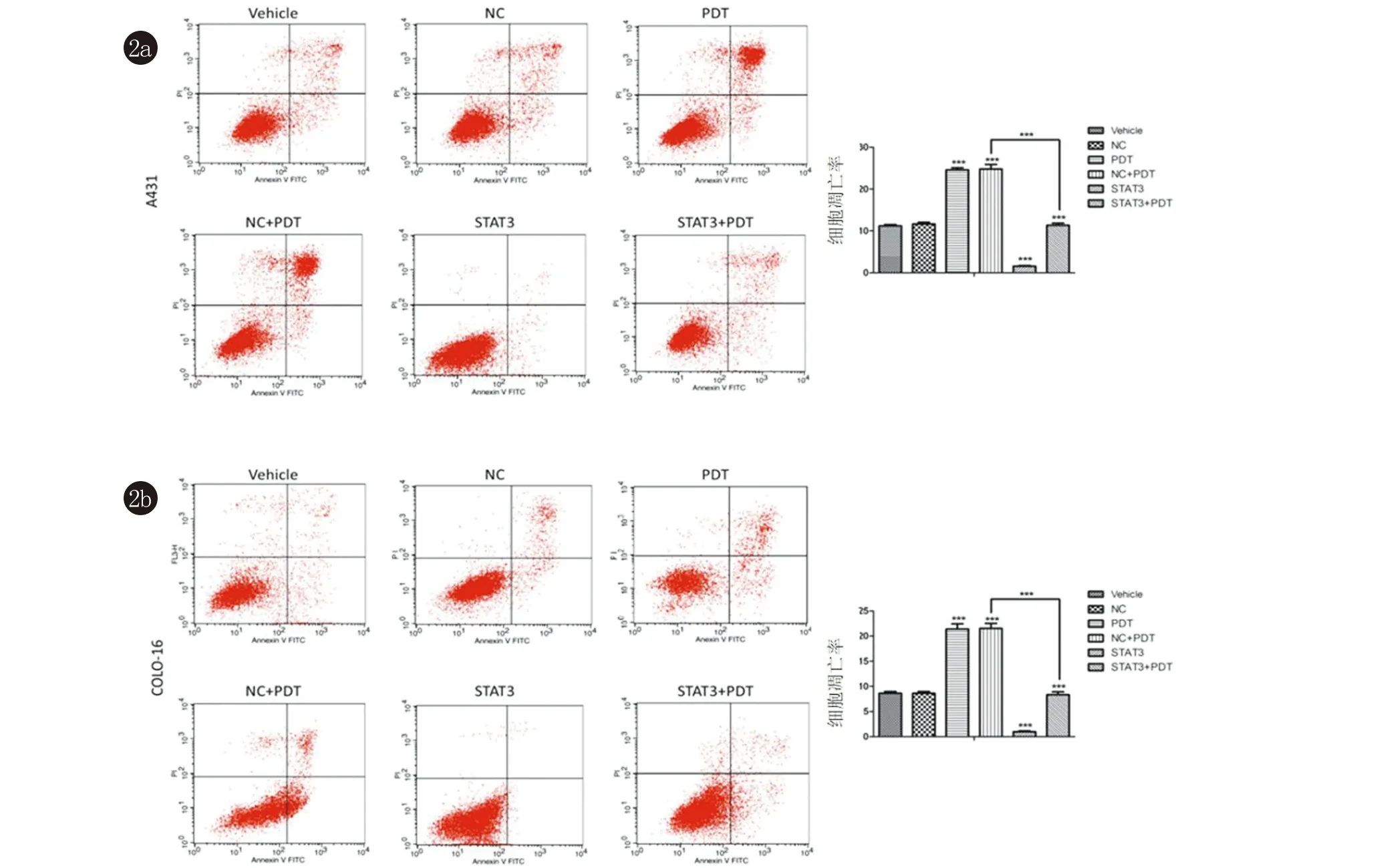
图2 各组A431和COLO-16细胞凋亡率比较,高表达STAT3显著缓解5-ALA-PDT诱导的细胞凋亡率增加
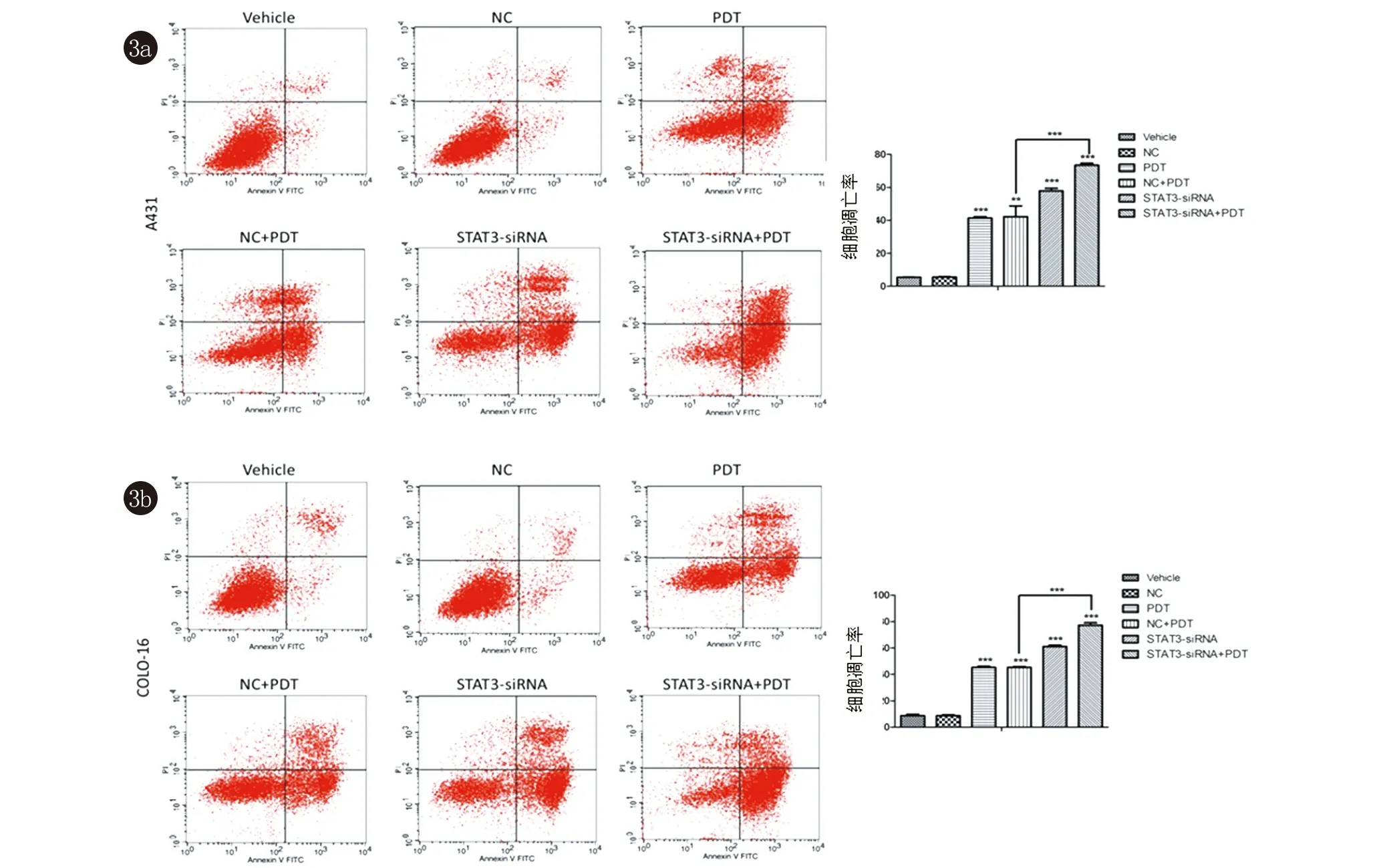
图3 各组A431和COLO-16细胞凋亡率比较,敲低STAT3促进了5-ALA-PDT诱导的细胞凋亡
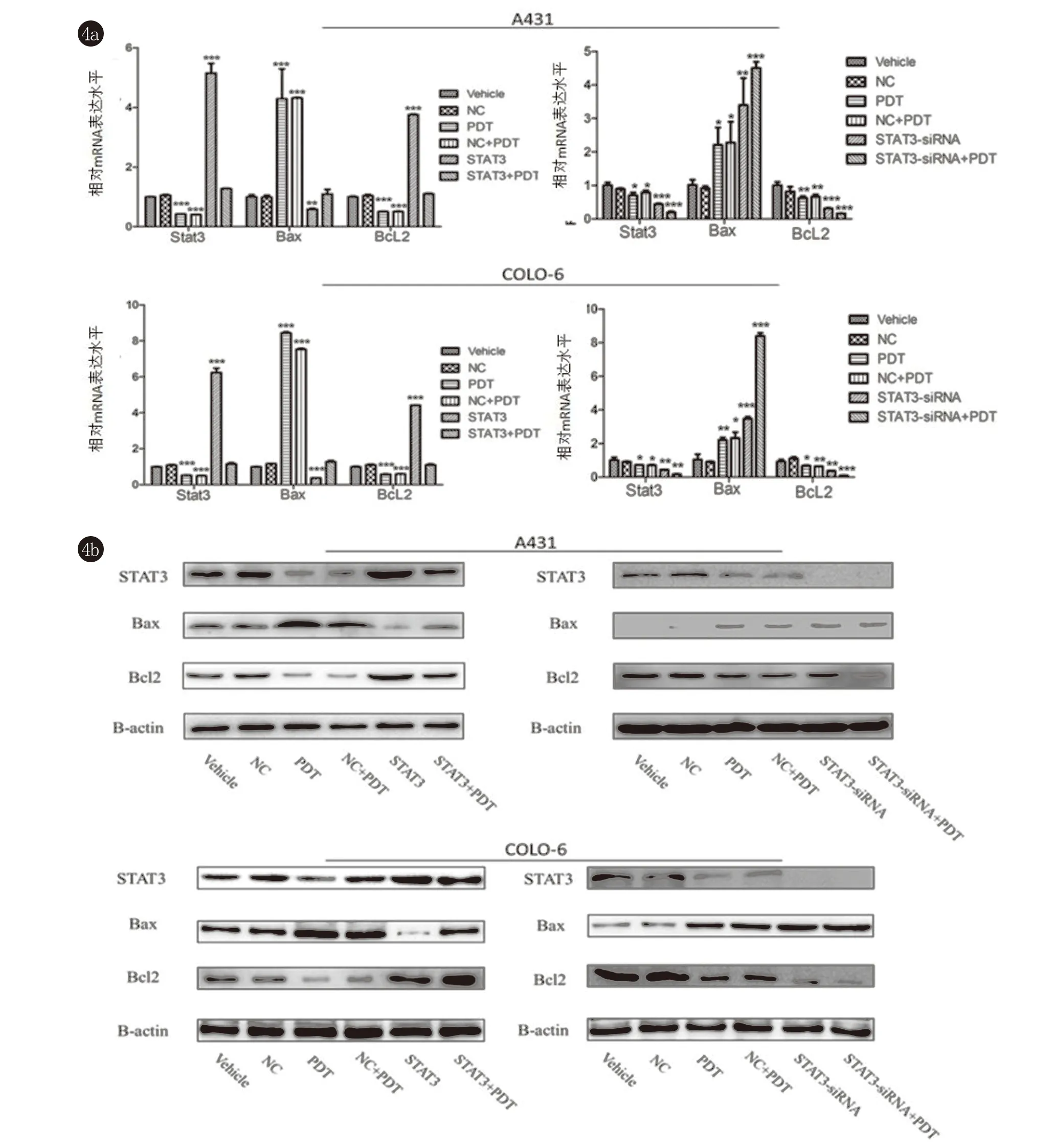
图4 各组STAT3、Bcl2、Bax的mRNA及蛋白质水平,β-actin为内参
STAT3是一种双功能蛋白,存在于细胞质中,并与酪氨酸磷酸化的信号通路相偶联,在信号转导和转录过程中具有关键性作用。STATs家族主要包含以下7种成员:STATl、STAT2、STAT3、STAT4、STAT5A、STAT5B和STAT6,参与调节细胞生长,存活和分化的许多重要方面。STATs是JAK-STAT途径中一种重要的底物,STATs家族的蛋白质可以被JAK磷酸化,磷酸化后的STATs形成二聚并转运到细胞核中,进而激活目的基因的转录,从而在信号转导和转录过程中起有着关键性的作用。研究发现,STAT3在人类许多恶性肿瘤中持续激活,并与肿瘤的发生、发展及愈后密切相关,例如鳞状细胞癌、基底细胞癌、黑素瘤、前列腺癌和乳腺癌等,并已经被证实是一种致癌基因。STAT3可以通过EGFR,Src,IL6等生长因子、细胞因子的激活,使其DNA的结合活性上调,调控相应靶基因的转录。并且不断将生存信号向肿瘤细胞转导,发挥促进肿瘤细胞生存、抑制细胞凋亡的作用。STAT3作为EGFR,Src等受体下游的信号通路交汇点可以直接参与调节VEGF的表达,调控血管的生成。STAT3信号通路与细胞的分化、增殖、血管生成、凋亡、免疫逃逸和侵袭转移密切相关。STAT3通路持续的激活可引起细胞异常增殖及恶性转化。
细胞增殖研究发现:MTT结果显示ALA-PDT能显著抑制A431及COLO-6细胞的增殖,过表达STAT3后明显减弱了5-ALA-PDT的抑制效应,相反,敲降STAT3后明显增强了5-ALA-PDT的抑制效应。细胞凋亡研究发现:5-ALA-PDT能显著诱导A431及COLO-6细胞凋亡,过表达STAT3后明显减弱了5-ALA-PDT的诱导效应,相反,敲降STAT3后明显增强了5-ALA-PDT的诱导效应。分子生物学实验表明STAT3及其靶基因BCL-2和Bax参与了5-ALA-PDT对A431及COLO-6细胞增殖及凋亡的影响。
综上所述,光动力可以抑制A431细胞的增殖,并促进其凋亡;JAK-STAT3信号传导通路参与了光动力治疗皮肤鳞状细胞癌;光动力可以抑制JAK-STAT 信号传导通路的激活并且改变可以 Bcl2/Bax蛋白的比率;除内源性凋亡外,JAK-STAT3参与介导的外源性凋亡在光动力治疗皮肤鳞状细胞癌中也是非常关键的。
