三苯氧胺与来曲唑治疗ER 阳性乳腺癌的临床疗效及对血清雌二醇水平和远期预后的影响△
2020-08-12高建朝王思思张淑宇王文静张志生
高建朝,王思思,张淑宇,王文静,张志生#
河北北方学院附属第一医院1乳腺外科,2妇产科,河北 张家口 075000
乳腺癌是威胁女性健康的常见肿瘤,具有远处转移、局部复发及预后差等特点,严重危及患者的生命安全[1]。近年来,随着临床治疗理念的转变,乳腺癌的治疗发展为手术、放化疗及内分泌治疗等综合治疗方式。其中内分泌治疗可作为雌激素受体(estrogen receptor,ER)阳性乳腺癌的重要治疗手段,能够通过调节机体的内分泌功能,减少雌激素的分泌,从而发挥治疗乳腺癌的作用[2]。三苯氧胺是乳腺癌内分泌治疗的最常用药物之一,其作为一种选择性雌激素受体调节剂,能够与雌激素竞争性结合ER,抑制相关雌激素信号通路,阻止肿瘤细胞生长,诱导肿瘤细胞凋亡[3]。但有研究认为,长期应用三苯氧胺可能增加子宫内膜癌的发生风险[4-5]。近年来,临床中来曲唑治疗乳腺癌的应用较多。杨梅[4]的研究发现,来曲唑不仅能够降低早期乳腺癌患者的复发及死亡风险,还可以在中晚期乳腺癌的治疗中使患者获益。但目前有关三苯氧胺和来曲唑应用效果对比的报道较少,且缺乏其对相关激素影响的研究。本研究通过分析三苯氧胺与来曲唑治疗ER阳性乳腺癌的临床疗效及对血清雌二醇(estradiol,E2)水平和远期预后的影响,旨在为ER阳性乳腺癌患者的内分泌治疗提供参考依据,现报道如下。
1 对象与方法
1.1 研究对象
选择2014年3月至2015年6月于河北北方学院附属第一医院接受治疗的110例ER阳性乳腺癌患者。纳入标准[6]:①经病史、临床症状、体格检查、影像学检查和病理组织活检确诊为乳腺癌;②ER阳性,停经时间>12个月;③子宫内膜厚度<15 mm,子宫肌层无异常;④具有可测量病灶;⑤女性且无远处转移;⑥无手术治疗指征。排除标准:①预计生存期<3个月;②复发性乳腺癌;③糖尿病、高血压等基础疾病未良好控制;④近期接受过其他雌激素类药物治疗;⑤具有本研究所用药物禁忌证。采用简单随机抽样法将110例患者分为对照组(n=53)和研究组(n=57)。两组患者的年龄、ER及孕激素受体(progesterone receptor,PR)双阳性率、TNM分期、子宫内膜厚度、肿瘤类型及总胆固醇(total cholesterol,TC)、甘油三酯(triglycerides,TG)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)、卵泡刺激素(follicle-stimulating hormone,FSH)水平比较,差异均无统计学意义(P>0.05)(表1),具有可比性。本研究经医院伦理委员会审批通过,所有患者及家属均对本研究知情并签署知情同意书。

表1 两组患者的基线特征
1.2 治疗方法
所有患者均接受长春瑞滨联合顺铂(NP)方案化疗:长春瑞滨25 mg/m2,静脉滴注,第1、8天,顺铂30 mg/m2,静脉滴注,第2~4天,3周为1个周期,持续治疗6个周期后评价疗效。对照组在NP化疗方案的基础上接受三苯氧胺治疗:口服10 mg三苯氧胺,早晚各1次,持续治疗1年。研究组在NP化疗方案的基础上接受来曲唑治疗,口服2.5 mg来曲唑,每天1次,持续治疗1年。
1.3 观察指标
1.3.1 临床疗效 采用世界卫生组织(World Health Organization,WHO)实体瘤疗效评价标准评估患者的临床疗效:病灶全部消失,持续1个月以上为完全缓解;肿瘤体积缩小>50%,无新病灶出现,且持续1个月以上为部分缓解;肿瘤体积增大≤25%或缩小<50%,无新病灶出现,且持续1个月以上为疾病稳定;肿瘤体积增大>25%或者出现新病灶为疾病进展。疾病控制率=(完全缓解+部分缓解+疾病稳定)例数/总例数×100%[6]。
1.3.2 血液学指标 于治疗前及治疗后3、6、12个月采集患者空腹外周静脉血4 ml,3500 r/min离心10 min,将上清液置于-20℃冰箱中待检。采用酶联免疫吸附试验检测治疗前和治疗后3个月患者的血清糖类抗原153(carbohydrate antigen 153,CA153)、癌胚抗原(carcinoembryonic antigen,CEA)水平,以及治疗前和治疗后3、6、12个月患者的血清E2水平,试剂盒均购自上海慧颖生物科技有限公司。
1.3.3 子宫内膜 每3个月对所有患者进行阴道彩超检查,测定子宫内膜厚度,对子宫内膜厚度<15 mm者继续观察,不进行特殊处理;子宫内膜厚度≥15 mm者,建议停止用药半个月后复查,停药后子宫内膜厚度未恢复至15 mm以下者进行诊刮活检术[7]。
1.3.4 不良反应 用药期间定期检查患者的血尿常规、肝肾功能等指标,并依据WHO抗癌药物常见不良反应评价标准评价两组患者的不良反应[8]。
1.3.5 随访情况 采用电话及门诊随访的方式对所有患者进行3年随访,以失访、死亡或随访截止期为截尾数据。
1.4 统计学分析
采用SPSS 18.0软件对数据进行统计分析,计量资料以均数±标准差(±s)表示,组间比较采用独立样本t检验;计数资料以例数和率(%)表示,组间比较采用χ2检验;采用Kaplan-Meier法绘制生存曲线,组间比较采用Log-rank检验。以P<0.05为差异有统计学意义。
2 结果
2.1 临床疗效的比较
研究组患者的疾病控制率为92.98%(53/57),高于对照组的79.25%(42/53),差异有统计学意义(χ2=4.401,P<0.05)。(表2)

表2 两组患者的临床疗效[n(%)]*
2.2 血清水平的比较
治疗前,两组患者的血清E2水平比较,差异无统计学意义(P>0.05)。治疗后3、6、12个月,研究组患者的血清E2水平均低于治疗前,对照组患者的血清E2水平均高于治疗前,差异均有统计学意义(P<0.05);治疗后3、6、12个月,研究组患者的血清E2水平均低于对照组,差异均有统计学意义(P<0.05)。(表3)
表3 治疗前后两组患者血清E2水平的比较(pg/ml,±s)

表3 治疗前后两组患者血清E2水平的比较(pg/ml,±s)
注:a与本组治疗前比较,P<0.05;b与同时间点对照组比较,P<0.05
治疗后3个月1 2.1 9±1.3 8 a 8.0 6±1.0 1 a b 1 0.1 3±1.6 5 1 0.5 6±1.5 2 1 5.2 6±2.0 1 a 7.3 3±1.2 9 a b 1 7.5 2±2.1 6 a 6.8 2±0.8 1 a b对照组(n=5 3)研究组(n=5 7)治疗前治疗后6个月治疗后1 2个月组别
2.3 肿瘤标志物水平的比较
治疗前,两组患者的血清CEA和CA153水平比较,差异均无统计学意义(P>0.05)。治疗后3个月,两组患者的血清CEA和CA153水平均较本组治疗前降低,且研究组患者的血清CEA和CA153水平均低于对照组,差异均有统计学意义(P<0.05)。(表4)
2.4 子宫内膜变化情况
治疗后,研究组患者的子宫内膜厚度均无明显改变,对照组中9例患者的子宫内膜厚度超过15 mm,其中3例患者停药1个月后子宫内膜厚度无明显恢复,病理结果提示子宫内膜息肉2例,内膜不典型增生1例,无子宫内膜癌发生。
表4 治疗前后两组患者肿瘤标志物水平的比较(±s)
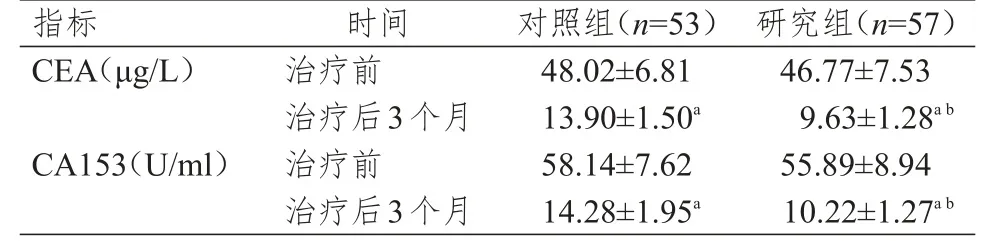
表4 治疗前后两组患者肿瘤标志物水平的比较(±s)
注:a与本组治疗前比较,P<0.05;b与对照组治疗后3个月比较,P<0.05
指标C E A(μ g/L)C A 1 5 3(U/m l)治疗前治疗后3个月治疗前治疗后3个月4 8.0 2±6.8 1 1 3.9 0±1.5 0 a 5 8.1 4±7.6 2 1 4.2 8±1.9 5 a 4 6.7 7±7.5 3 9.6 3±1.2 8 a b 5 5.8 9±8.9 4 1 0.2 2±1.2 7 a b时间对照组(n=5 3)研究组(n=5 7)
2.5 不良反应发生情况的比较
两组患者恶心呕吐、便秘、肝肾功能不全、血小板减少、粒细胞减少及白细胞降低的发生率比较,差异均无统计学意义(P>0.05)。(表5)

表5 两组患者的不良反应发生情况[n(%)]
2.6 生存情况的比较
随访3年,对照组中15例患者死亡,分别为第1年3例,第2年4例,第3年8例;研究组中7例患者死亡,分别为第1年1例,第2年3例,第3年3例。研究组患者的3年生存情况优于对照组,差异有统计学意义(χ2=4.272,P=0.039)(图1)。
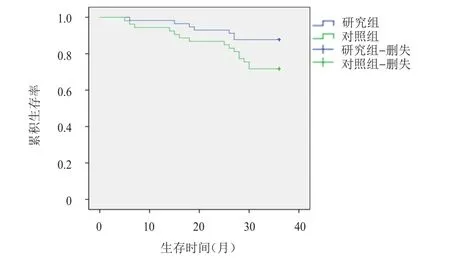
图1 研究组(n=57)和对照组(n=53)乳腺癌患者的生存曲线
3 讨论
近年来乳腺癌的发病率呈上升趋势,目前随着诊疗技术的提高,其病死率不断下降。ER是乳腺癌重要的分子标志物,雌激素和ER特异性结合后可刺激系列基因的表达,促进细胞生长和肿瘤转移。研究表明,大部分乳腺癌患者的ER呈阳性表达,ER是预测乳腺癌患者内分泌治疗效果的重要指标[9]。内分泌治疗是乳腺癌综合治疗的主要方式之一,在早期乳腺癌术后辅助治疗和晚期乳腺癌治疗中的效果已得到临床证实。但手术切除卵巢、肾上腺和脑垂体等内分泌腺体存在一定的复杂性及风险,目前已被疗效好、安全性高的药物所替代。
三苯氧胺是一种非甾体抗雌激素类抗癌药,是乳腺癌最常用的内分泌治疗药物,能够直接作用于靶器官,竞争性结合ER并阻断其与E2的相互作用,从而抑制雌激素依赖性乳腺癌细胞的生长。临床研究表明,内分泌治疗不仅可预防乳腺癌转移,还可降低同侧乳腺内或区域复发风险,降低对侧乳腺的癌变风险[10]。体外研究证实,三苯氧胺可增强部分化疗药物的细胞毒作用,从而提高临床疗效[11]。上述研究表明三苯氧胺在ER阳性乳腺癌的治疗中具有一定价值。本研究结果显示,尽管三苯氧胺对大部分乳腺癌患者具有一定的疗效,但对部分患者的效果仍不甚理想。
有研究证实,来曲唑在乳腺癌内分泌治疗中取得了满意的效果,其作为一种苄三唑类衍生物,可通过抑制芳香化酶,降低雌激素的表达,从而抑制雌激素对肿瘤生长的刺激作用[12]。相关研究报道,来曲唑的体内活性明显高于第一代芳香化酶抑制剂,且具有较高的选择性,对甲状腺功能、糖皮质激素无影响,大剂量应用几乎不抑制肾上腺皮质类固醇激素的分泌,因此其治疗指数较高[13]。近年来又有研究表明,来曲唑对靶器官及全身各系统无潜在毒性,具有药理作用强及耐受性好等特点[14]。本研究结果显示,接受来曲唑治疗的患者疾病控制率高于接受三苯氧胺治疗的患者,表明其在ER阳性乳腺癌治疗中具有一定的优势。
既往研究已证实,肿瘤标志物在恶性肿瘤发生发展中具有重要作用,CEA是一种特异性肿瘤标志物,可直观反映淋巴结转移情况及肿瘤浸润深度,CA153是乳腺癌的敏感标志物,可反映疾病预后[15]。本研究结果显示,治疗后,两组患者的血清CEA和CA153水平均较本组治疗前降低,且研究组患者的血清CEA和CA153水平均低于对照组(P<0.05)。说明来曲唑的抗肿瘤作用强于三苯氧胺,更能有效地降低肿瘤负荷,抑制肿瘤标志物的表达。内分泌治疗在ER阳性乳腺癌中的作用已有明确定论,但临床有关乳腺癌患者内分泌治疗后雌激素的表达情况尚存争议[16]。相关研究表明,雌激素是乳腺癌发生的独立危险因素,能够调控肿瘤细胞的增殖和分化[17]。E2能够促进乳腺癌生长,并经负反馈调节使小丘脑分泌的促性腺激素释放激素受到抑制,影响垂体分泌的性激素的表达。本研究结果显示,来曲唑治疗后3、6、12个月患者的血清E2水平均较治疗前下降,但三苯氧胺治疗后患者的血清E2水平均较治疗前升高,表明来曲唑能够抑制ER阳性乳腺癌患者的雌激素表达,从而抑制肿瘤进展。临床研究报道,三苯氧胺可能对卵巢功能具有一定的直接作用,因此临床需密切关注卵巢功能改变,既可以达到更好的内分泌治疗效果,又可减轻对卵巢功能的影响[18]。有关研究报道,雌激素水平上升能够引起子宫内膜上皮细胞增殖和肥大,导致子宫内膜出现异常增厚及息肉[19]。另有研究表明,长期接受三苯氧胺治疗可能增加子宫内膜癌的发生风险[20]。本研究结果显示,来曲唑治疗后子宫内膜厚度无明显改变,但三苯氧胺治疗后有少数患者在停药后2个月子宫内膜厚度无明显恢复,病理结果提示子宫内膜息肉、内膜不典型增生,但无子宫内膜癌发生,说明三苯氧胺会增加子宫内膜病变的发生风险。
尽管内分泌治疗在ER阳性乳腺癌治疗中的疗效肯定,但有临床研究报道,部分内分泌治疗有效的患者在治疗2年后仍可出现疾病进展[21]。因此有必要进行有效随访,以便及时了解患者在治疗中存在的问题,尽早发现肿瘤的复发及转移,改善乳腺癌患者的生存质量,延长远期生存时间。本研究结果显示,研究组患者的3年生存情况优于对照组,差异有统计学意义(P<0.05),证实了来曲唑在预后改善中的作用。
综上所述,来曲唑治疗ER阳性乳腺癌的临床疗效优于三苯氧胺,可降低血清肿瘤标志物和E2水平,改善远期预后。但本研究存在观察指标不够全面、样本量较小等不足,因此结论可能存在偏差,有待更多大样本、随机对照研究的进一步分析。
