IgG-Biotin-Avidin-HRP信号转导探针结合免疫比色法快速检测克罗诺阪崎肠杆菌
2020-08-03叶玲娴黄浩然吴遵义黄建锋赵广英窦文超
叶玲娴 黄浩然 柳 露 吴遵义 黄建锋 赵广英* 窦文超
(1 浙江工商大学食品与生物工程学院 浙江省食品安全重点实验室 杭州310018 2 浙江省方圆检测集团股份有限公司 杭州310018)
克罗诺阪崎肠杆菌(Cronobacter sakazakii,C.sakazakii)是一种常见的食源性条件致病菌[1-2],能导致严重的新生儿脑膜炎、小肠结肠炎、败血症等,并能引起成人局部感染和菌血症[3]。婴幼儿配方粉(Powdered infant formula,PIF)被认为是克罗诺阪崎肠杆菌主要的污染途径,是当前引起婴儿脑膜炎、菌血症和坏死性结肠炎疾病,进而导致死亡的主要原因[2]。
生物素-亲和素系统 (Biotin-avidin system,BAS)是一种以生物素-亲和素之间具有很高结合能力为基础的生物反应放大系统。由于亲和素(Avidin)具有与其它标记示踪物质(如酶、胶体金等)结合的能力[4-5],且与生物素之间的作用力比抗原抗体的亲和力 (Ka=105~1011mol-1) 高至少104倍,因此具有高度特异性和稳定性[6-8]。此外,通过生物素亲和素桥接抗体与HRP 可以产生放大效应,使该系统在免疫标记和有关示踪分析方面更加灵敏。
Fe3O4磁性纳米粒子具有较大的比表面积,良好的生物相容性,有助于简化试验步骤,因此被认为是制作信号转导探针的理想材料,而该材料具有一定的聚集倾向,限制了在实际研究中的应用[9]。由于二氧化硅包覆的核壳式磁性纳米粒子(Fe3O4-SiO2) 可以较好地抑制材料本身的团聚现象,且在水溶液中的分散性良好,经表面改性后具有较强的生物相容性和稳定性,因此被用作该研究的主要纳米材料。
本研究设计构建了一种以IgG-Biotin-Avidin-HRP 为信号转导探针,结合磁性纳米捕获探针的免疫夹心比色法用于检测克罗诺阪崎肠杆菌。形成的夹心复合物可以催化底物显色,由此将生物信号转化为光学信号并通过酶标仪读出,进而确定光学信号与被测样品中克罗诺阪崎肠杆菌的浓度对数关系,以此实现对克罗诺阪崎肠杆菌的免疫比色测定。
1 材料和方法
1.1 材料与试剂
克罗诺阪崎肠杆菌(Cronobacter sakazakii,C.sakazakii,ATCC 29544)、金黄色葡萄球菌(Staphylococcus aureus,S.aureus,ATCC 27217)、鸡白痢鸡伤寒沙门氏菌(Salmonella pullorum and Salmonella gallinarum,S.pullorum and S.gallinarum,79-1,79-7),国家兽医微生物菌种保藏中心;费式柠檬酸杆菌 (Citrobacter freundii,ATCC 43864),中国工业微生物菌种保藏中心;大肠杆菌O157∶H7 (Escherichia coli O157∶H7,E.coli O157∶H7,NTCC 12900),上海慧耘生物科技有限公司。
正硅酸四乙酯(Tetraethyl orthosilicate,TEOS)、3-氨丙基三乙氧基硅烷 (3-Aminopropyl triethoxysilane,APTES)、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(N-(3-Dimethylaminopropyl)-N’-ethylcarbodiimide hydrochloride,EDC)、N-羟基琥珀酰亚胺 (N-hydroxy-succinimide,NHS),阿拉丁试剂有限公司;乙醇、氨水(NH3·H2O,25.0%~28.0%),成都市科龙化工试剂厂;牛血清白蛋白(Bovine serum albumin,BSA),北京鼎国生物科技有限公司;聚(4-苯乙烯磺酸-共聚-马来酸)钠盐[Poly (4-styrenesulfonic acid -co -maleic acid)sodium salt,PSSMA,Mw≈20 000,S∶MA=1∶1],上海麦克林生化科技有限公司;抗克罗诺阪崎肠杆菌多克隆抗体(200 μg/mL),北京赛驰生物科技有限公司;生物素标记抗克罗诺阪崎肠杆菌多克隆抗体(Biotin-IgG)(2 mg/mL)、亲和素标记HRP(Avidin-HRP)(1 mg/mL),北京翰谱医药生物研究所。
1.2 仪器与设备
Tecnai F30 G2场发射透射电子显微镜,美国FEI 公司;Nano ZS 激光粒度仪,英国马尔文仪器有限公司;全波长酶标仪、Nicolet 380 傅里叶变换红外光谱仪,赛默飞世尔(上海)科技有限公司;PHS-3E pH 计,上海雷磁精密仪器有限公司。
1.3 MNPs 的合成
Fe3O4纳米粒子的制备方法在Gao 等[10]的相关方法上略作修改,用溶剂热法合成水溶性、单分散的Fe3O4纳米粒子。具体合成过程:将0.5 g PSSMA 溶于20 mL 乙二醇,再加入0.54 g 六水合三氯化铁和1.5 g 无水醋酸钠。将得到的红棕色均一液体倒入水热反应釜中,200 ℃反应10 h。待冷却到室温后,将所得黑色沉淀物在外磁场作用下洗涤并定容至6 mL 超纯水中,待用。
取1 mL 上述制备的Fe3O4溶液置于锥形瓶中,加入60 mL 乙醇,10 mL 去离子水和9 mL 氨水,混合搅拌10 min 后,再加入1 mL TEOS,在室温下搅拌反应18 h。在外磁场作用下依次用乙醇和蒸馏水洗涤多次,定容至1 mL 待用。
1.4 MNPs-IgG 的制备
根据Zhao 等[11]研究的EDC 活化法(图1a),首先取150 μL 制备好的MNPs 重悬于20 mL 乙醇中,加入200 μL APTES,室温下搅拌反应12 h后,磁分离后用乙醇和PBS(0.01 mol/L pH 7.4)分别洗涤多次,得到MNPs-NH2。然后将1.67 mg EDC 和2.08 mg NHS 加入到650 μL 用PBS 稀释的anti-C.sakazakii 多克隆抗体溶液 (10 μg/mL)中,4 ℃过夜孵育。再加入100 μL 20 mg/mL MNPs-NH2室温振荡反应4 h,磁分离后用PBS 洗涤多次,定容于200 μL PBS 中,得到表面修饰有anti-C.sakazakii 抗体的MNPs-IgG,4 ℃保存待用。
1.5 菌株制备
以克罗诺阪崎肠杆菌为目的菌,大肠杆菌O157∶H7、金黄色葡萄球菌、费式柠檬酸杆菌、鸡白痢鸡伤寒沙门氏菌为对照菌。所有菌株均用摇床培养至指数生长中期,进行平板计数后,用低温高速冷冻离心机7 000 r/min 离心10 min 收集菌泥,用0.4%甲醛于37 ℃灭活24 h,再用生理盐水洗涤3 次,菌泥沉淀用生理盐水重悬后4 ℃保存备用。
1.6 MNPs 的表征
1) Tecnai F 30 G2场发射透射电镜表征:将合成好的MNPs 用超纯水稀释到适宜浓度,取1~2 滴,滴加在铜网上烘干,然后在Tecnai F 30 G2场发射透射电镜下观察MNPs 的大小和形态;
2) 红外光谱分析:取少量干燥的样品与KBr 混合研磨、压片,用Thermo Nicolet 380 傅里叶变换红外光谱仪测定4 000~400 cm-1波长的红外光谱。分辨率0.4 cm-1,扫描次数32 次;
3) Zeta 电位分析:利用Nano ZS 激光粒度电位仪依次测定MNPs 和MNPs-NH2的电位,以此表征MNPs 表面成功修饰氨基基团;
4) 水合粒径分析:取一定量稀释过的Fe3O4纳米粒子和MNPs 样品,置于样品池中,利用Nano ZS 激光粒度仪测定水合粒径。
1.7 IgG-Biotin-Avidin-HRP 信号转导探针结合免疫比色方法的建立
IgG-Biotin-Avidin-HRP 信号转导探针结合免疫比色法快速检测克罗诺阪崎肠杆菌原理如图1b 所示。先将50 μL MNPs-IgG(10 mg/mL)加入到1 mL 克罗诺阪崎肠杆菌菌悬液中,37 ℃孵育45 min,将所得混合物进行磁性分离,并用PBS 洗涤3 次除去未结合的细菌。加入100 μL Biotin-IgG(用PBS 1∶100 稀释),37 ℃孵育45 min,再用PBS 轻轻洗3 次,除去多余的Biotin-IgG。随后向其中加入100 μL Avidin-HRP (用PBS 1∶1 500稀释),37 ℃反应30 min,用PBS 洗涤除去未结合的Avidin-HRP,得到MNPs-IgG/C.sakazakii/Biotin-IgG/Avidin-HRP 夹心结构复合物。最后,加入100 μL TMB 单组分显色液于37 ℃孵育2 min,磁分离后加入50 μL 2 mol/L H2SO4终止反应,将上清转移到酶标板中,并于5 min 内测定450 nm 波长处的吸光度值。
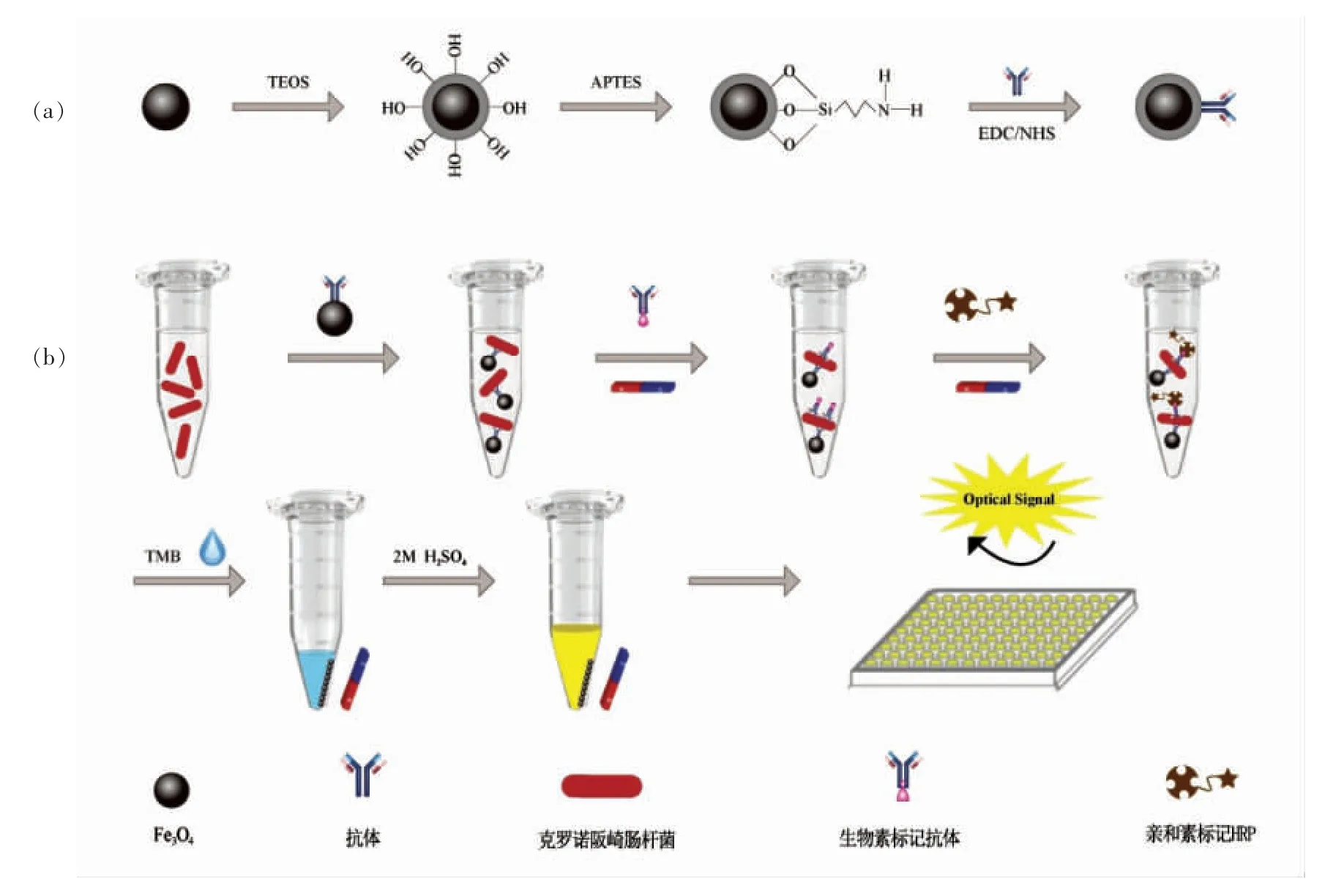
图1 IgG-Biotin-Avidin-HRP 信号转导探针结合免疫比色法快速检测克罗诺阪崎肠杆菌的原理Fig.1 The detection schematic of colorimetric immunoassay of detection for C.sakazakii using IgG-Biotin-Avidin-HRP
2 结果与分析
2.1 MNPs 的表征结果
本研究用TEM 对Fe3O4和MNPs 纳米粒子的大小和形态进行表征,如图2a 所示,Fe3O4纳米粒子粒径均一,单分散性良好,Nano ZS 激光粒度仪测得平均粒径约350 nm。对MNPs 的TEM 表征显示(图2b),利用Stöber 法修饰的Fe3O4纳米粒子呈明显的核壳结构,SiO2壳层厚度约为70 nm,说明SiO2成功地包覆到了Fe3O4纳米粒子表面。
Fe3O4和MNPs 的傅里叶红外光谱 (FTIR)如图2c 所示,两种材料在500~700 cm-1波数范围内均出现明显的振动峰,其对应为Fe-O 键的伸缩振动模式。在1 084 cm-1位置,MNPs 的FTIR 图谱出现了较强的Si-O-Si 伸缩振动峰,这也验证了SiO2被成功修饰到了Fe3O4表面。
MNPs 在进行基团修饰前、后,使用马尔文激光电位仪测定了MNPs、MNPs-NH2在pH 2~12 内的Zeta 电位。如图2d 所示,MNPs 在pH 2~12 范围内均为负电,分析认为这与合成时使用的分散剂PSSMA,使得Fe3O4表面带有一定量羧基有关。而MNPs-NH2的等电点出现在pH 5.2,等电点右移可以说明氨基成功地修饰到了MNPs 表面。

图2 (a) Fe3O4 纳米粒子的透射电镜图;(b)MNPs 的透射电镜图;(c)Fe3O4 纳米粒子和MNPs 傅里叶红外光谱图;(d)MNPs 和MNPs-NH2 的Zeta 电位Fig.2 (a)TEM image of Fe3O4 nanoparticles;(b) TEM image of MNPs;(c) FT-IR spectra of Fe3O4 nanoparticles and MNPs;(d) Zeta potential of MNPs and MNPs-NH2
2.2 试验条件优化
为提高检测的灵敏度,本研究优化了捕获探针MNPs-IgG 的用量,以及信号转导探针Biotin-IgG、Avidin-HRP 的浓度。如图3a 所示,在107CFU/mL 时,检测结果的吸光度值随MNPs-IgG 用量的增大呈先增大后减小的趋势,则40 μL 为捕获探针MNPs-IgG 的最佳使用量。
在对Biotin-IgG 和Avidin-HRP 的浓度进行优化时,分别使用100 μL 不同稀释倍数(1∶50,1∶100,1∶150,1∶200,1∶250) 的Biotin-IgG 以及100 μL 不同稀释倍数 (1∶1 000,1∶1 500,1∶3 000,1∶4 500,1∶6 000)的Avidin-HRP,做单因素优化试验。如图3b 所示,随着标记物稀释倍数的升高,A450先升高后降低,当稀释倍数为1∶100 时吸光度值最高。研究Avidin-HRP 稀释倍数对试验结果的影响,比较了阳性组(107CFU/mL)与空白对照组的吸光度值的差值。随着稀释倍数的升高,两组吸光度值均呈下降趋势,而两者的差值则在稀释倍数为1∶1 500 时达到最大,则Avidin-HRP 最佳稀释倍数为1∶1 500。
2.3 标准曲线的建立
在最优条件下,免疫比色克罗诺阪崎肠杆菌菌液浓度的对数值与450 nm 波长处的吸光度值具有良好的线性关系(图4)。线性方程为y=0.2353x-0.2307,相关系数为0.9629,检测限为8.68×102CFU/mL(S/N=3)。
2.4 特异性验证

图3 (a)MNPs-IgG 体积、(b)Biotin-IgG 稀释度、(c)Avidin-HRP 稀释度对夹心比色法的影响Fig.3 The effects of (a) the volumes of the MNPs-IgG,(b) the dilution of Biotin-IgG,(c) the dilution of Avidin-HRP on the colorimetric sandwich assay
为验证该方法的特异性,在最适培养条件下,对107CFU/mL 克罗诺阪崎肠杆菌、金黄色葡萄球菌、大肠杆菌O157∶H7、费式柠檬酸杆菌、鸡白痢鸡伤寒沙门氏菌以及0.01 mol/L PBS (pH 7.4)进行免疫比色实验。如图5所示,克罗诺阪崎肠杆菌与其它检测对象相比A450在统计学上具有极显著差异(P <0.001),由此可见建立的免疫比色法特异性良好,可用于实际样品中克罗诺阪崎肠杆菌的检测。
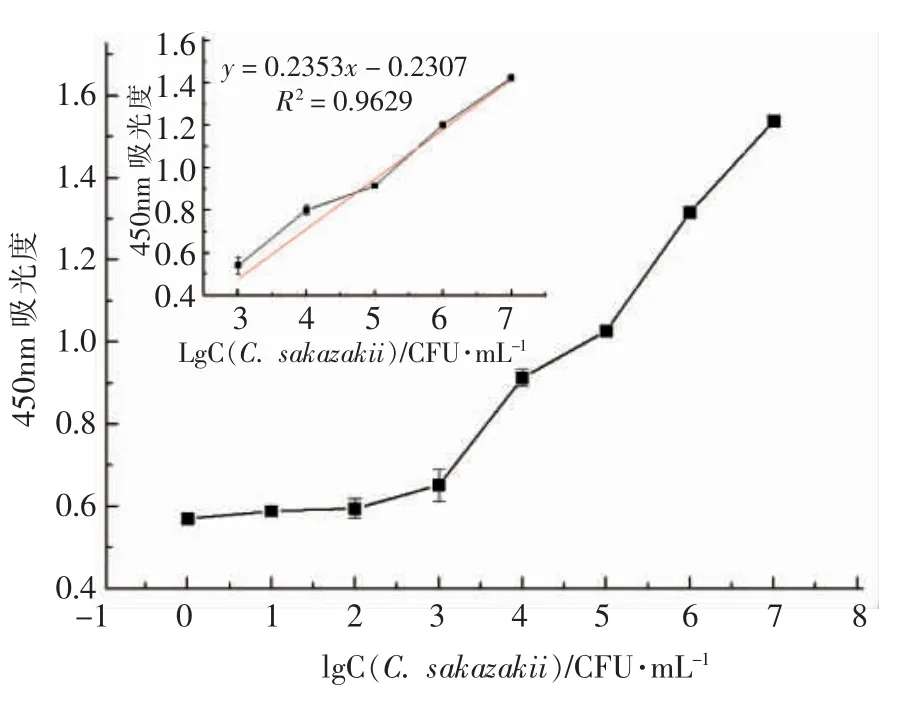
图4 夹心比色法检测克罗诺阪崎肠杆菌的灵敏度Fig.4 The sensitivity of the colorimetric sandwich assay for detection of C.sakazakii
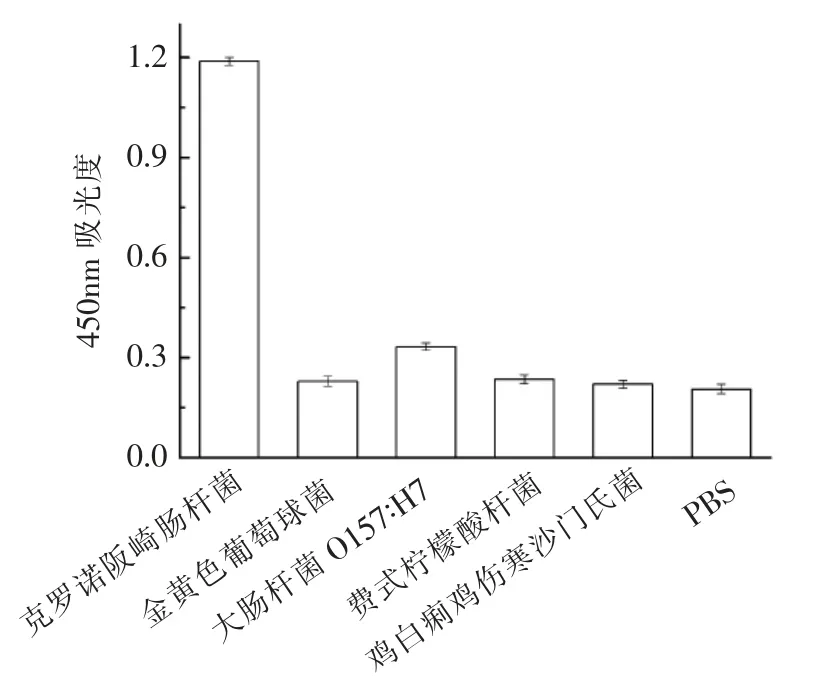
图5 免疫比色法检测克罗诺阪崎肠杆菌的特异性Fig.5 Specificity of the colorimetric sandwich assay for detection of C.sakazakii
2.5 稳定性验证
使用保存在4 ℃条件下1,7,30,60,90 d 的MNPs-IgG,Biotin-IgG 和Avidin-HRP 进行免疫比色法检测107CFU/mL 克罗诺阪崎肠杆菌。如图6所示,随着时间的延长,信号值略有降低,但仍保持较稳定的状态,因此认为该方法及相关材料的稳定性令人满意。
2.6 免疫比色法准确性验证
为验证该方法的准确性,采用加标法向市售某品牌奶粉中加入菌液,制备20 份人为污染样品和5 份无菌样品。在最佳检测条件下,使用免疫比色法检测各样品,并与国标法检测结果相比较。检测结果如表1所示,表明该比色法对奶粉中克罗诺阪崎肠杆菌的检测具有良好的准确度。

图6 3 种材料的稳定性Fig.6 Stability of three biomaterials

表1 国标法与比色法检测结果对照Table 1 Comparisons of the result between GB and colorimetric immunoassays
3 讨论
本研究利用MNPs-IgG,Biotin-IgG 和Avidin-HRP 作为检测探针建立了一种新型免疫比色法用于检测克罗诺阪崎肠杆菌。MNPs-IgG 作为捕获探针实现了对大体系样品中目的菌的快速分离,提高了检测灵敏度,同时简化了蛋白标记程序,缩短了制备时间;结合生物素-亲和素系统,利用信号转导探针IgG-Biotin-Avidin-HRP 进行信号放大,将目的菌的生物信号转化为光学信号进行判读。该方法对克罗诺阪崎肠杆菌的检测限为8.68×102CFU/mL,检测时间不超过2.5 h。此外,本方法特异性良好,对实际样品中复杂基质抗干扰能力强,且可以满足高通量分析的要求。该方法适用于企业内部筛查,同时为经济欠发达地区的致病菌诊疗提供了新的思路和方法。
