自然发酵豆酱的滋味特性与微生物多样性分析
2020-08-03安飞宇武俊瑞穆德伦乌日娜
安飞宇 姜 静 武俊瑞 赵 越 张 妍 穆德伦 乌日娜
(沈阳农业大学食品学院 沈阳110866)
豆酱是以大豆和面粉为主要原料,在霉菌、酵母菌和乳酸菌等微生物作用下,将碳水化合物和蛋白质等大分子物质分解为小分子物质,自然发酵而成的半固体粘稠状的调味品[1-2]。作为一种传统的发酵食品,豆酱浓厚的酱香味和适宜的口感深受广大消费者喜爱。有研究表明豆酱具有多种有益人体健康的生理活性物质,具有一定的保健功能,包括抗氧化,溶解纤维蛋白,抗突变和抗癌特性[3-6]等。
自然发酵的豆酱在微生物作用下产生特有的色、香、味、体,其中咸味和鲜味在豆酱的5 种滋味(酸、甜、苦、鲜、咸)中尤其突出,苦味虽不明显,但可以提升豆酱的口感度,其苦味主要来自于一些呈苦味的氨基酸,例如精氨酸[7];其鲜味主要来自于谷氨酸钠[8];其甜味主要来自于淀粉糖化产生麦芽糖、葡萄糖和一些醇类物质[9];豆酱的盐浓度在12%~14%左右,是咸味的来源,这种咸味与其它化学成分的相互作用,使豆酱的口感绵柔;豆酱中的有机酸赋予豆酱清爽的酸味,国标要求豆酱中的有机酸含量不应大于2%[10],若超标会导致豆酱品质下降。
目前高通量测序技术被广泛应用于豆酱发酵过程中微生物的检测。崔梦君等[11]采用高通量测序技术分析农家酱中的微生物群落,发现主要的细菌属有芽孢杆菌属(Bacillus)、棒状杆菌(Corynebacterium)、葡萄球菌属(Staphylococcus)和乳酸杆菌属(Lactobacillus)等。Li 等[12]利用高通量测序技术检测豆瓣酱酱醅发酵过程中群落演替,结果表明,在发酵35 d 后,除乳杆菌属和不性动细菌属(Acinetobacter)外,其余细菌群落直至发酵结束都维持相对稳定,优势细菌主要有四联球菌属(Tetragenococcus)、乳杆菌属、葡萄球菌属、不动细菌属、假单胞菌属(Pseudomonas)和链球菌属(Streptococcus)。
本研究以自然发酵豆酱为研究对象,采用电子舌分析豆酱滋味特性,利用高通量测序技术分析豆酱发酵过程中微生物多样性,为工业制得高品质豆酱及开发利用微生物资源提供依据。
1 材料与方法
1.1 材料
样品采自辽中地区(M 家)自然发酵的豆酱,样品总发酵时间为49 d,每隔7 d 取样,编号为M1~M8,并于-80 ℃储存备用。
1.2 仪器与设备
电子舌(SA402B),日本Insent 公司;MiSeq 测序仪,美国Illumina 公司;琼脂糖凝胶电泳仪(DYCP-31BN),中国深华生物技术有限公司;PCR仪(ABI GeneAmpR9700 型),北京卓悦联合生物科技有限公司;TransStart Fastpfu DNA 聚合酶,北京全式金生物技术有限公司;TruSeqTM试剂盒,上海美吉生物医药科技有限公司;AxyPrepDNA 凝胶回收试剂盒,美国AXYGEN 公司;QuantiFluorTM-ST 蓝色荧光定量系统,北京普洛麦格生物技术有限公司;NanoDrop 2000C 超微量分光光度计,北京凯慕生物技术有限公司。
1.3 试验方法
1.3.1 应用电子舌对豆酱滋味特性进行测定
1.3.1.1 豆酱样品的预处理 准确称取10.0 g 用研钵研磨均匀的样品,将其定容至100 mL,以10 000 r/min 离心10 min,过滤,取澄清液备用。
1.3.1.2 SA402B 电子舌分析 此电子舌设备有CT0、AEI、AAE、C00 和CA0 5 个测试传感器,分别测试咸味、涩味、鲜味、苦味和酸味;并配有2 个参比传感器。
1.3.1.3 传感器活化 活化测试传感器方法:将Ag/AgCl 电极从测试传感器中取出,加入内部溶液,将传感器重新组装,置于参比溶液中,活化1 d,备用。
活化参比传感器方法:将电极从参比传感器中取出,加入内部溶液,将传感器重新组装,置于3.33 mol/L KCl 溶液中,活化1 d,备用[13-14]。
1.3.1.4 样品测定 电子舌系统完成自检操作后,将澄清液等量倒入到2 个电子舌配备的烧杯中。首先将CT0 等6 个测试传感器在阳离子溶液或阴离子溶液中浸泡(目的是清洗传感器),之后用参比溶液1 和2 清洗传感器,后用参比溶液3清洗,得到参比溶液电势Vr,后将传感器置于样品杯中浸泡,得到样品电势Vs,用2 个电势的差值可以对5 种滋味进行评估;之后依次采用参比溶液4 和5 进行清洗,后放入溶液6 中浸泡,回味测出电势为Vr’,通过Vr’和Vr 的差值计算出涩味、鲜味以及苦味的回味。重复4 次,选取后3 次的数据作为原始数据[13-14]。
1.3.2 应用高通量测序对豆酱微生物进行检测
1.3.2.1 基因组DNA 提取 采用试剂盒提取DNA,再用1%琼脂糖凝胶电泳检测DNA。DNA 浓度和纯度利用NanoDrop2000 检测。
1.3.2.2 PCR 扩增 细菌的16S rDNA 的V4-V5区PCR 反应,以515F(5′-GTGCCAGCMGCCGC GG-3′)和907R(5′-CCGTCAATTCMTTTRAGTTT-3′) 为引物进行细菌16S rDNA 的V4-V5 区域扩增。
真菌的ITS 区的PCR 反应,以ITS1F (5′-CTTGGTCATTTAGAGGAAGTAA-3′)和ITS2R(5′-GCTGCGTTCTTCATCGATGC-3′) 为引物进行真菌ITS1 区域扩增[15]。
PCR 条件是95 ℃,3 min;95 ℃变性30 s,55℃退火30 s,72 ℃延伸30 s,27 个循环;最后72 ℃延伸10 min。
1.3.2.3 Miseq 测序 将PCR 产物用蓝色荧光定量系统检测定量,使用凝胶回收试剂盒切胶回收PCR 产物,Miseq 测序仪双端测序。
1.3.2.4 数据统计分析 Miseq 测序结果为双端测序得到的正反向reads,首先进行两两组装连接,过滤拼接结果中含有N 的序列,保留序列长度大于200 bp 的序列。经质量过滤,去除嵌合体序列,得到的序列用于OTU 分析,使用VSEARCH(1.9.6)进行序列聚类(序列相似性设为97%),比对的16S rRNA 参考数据库是Silva 119。用RDP classifier 贝叶斯算法对OTU 的代表性序列进行物种分类学分析,并在不同物种分类水平下统计每个样本的群落组成。基于OTU 分析结果,采用样本序列进行随机抽样的方法,分别计算Shannon、Chao 等α 多样性指数,并绘制稀释曲线[16]。
2 结果与分析
2.1 豆酱发酵过程中滋味特性分析
2.1.1 豆酱发酵过程中滋味品质相关性分析 如表1所示,传感器响应值之间的相关性结果。
表1为电子舌传感器所产生的各个响应值之间的皮尔森相关系数,由表中的数据可知,酸味的响应值和其它5 个响应值 (如后味-B 等的响应值)呈极显著负相关,其中与丰度的响应值呈极显著负相关,与涩味呈极显著正相关;苦味的响应值与后味-B 的响应值呈极显著正相关;而涩味与其它5 个响应值(后味-B、后味-A、鲜味、丰度、咸味)呈极显著负相关;后味-B、后味-A、鲜度以及咸度呈极显著正相关;后味A、鲜味、丰度和咸度呈极显著正相关;鲜味和咸味呈极显著正相关,与丰度呈显著正相关;丰度与咸味呈极显著正相关。分析数据可知,提取响应值的各信息间具有较高的相关性。
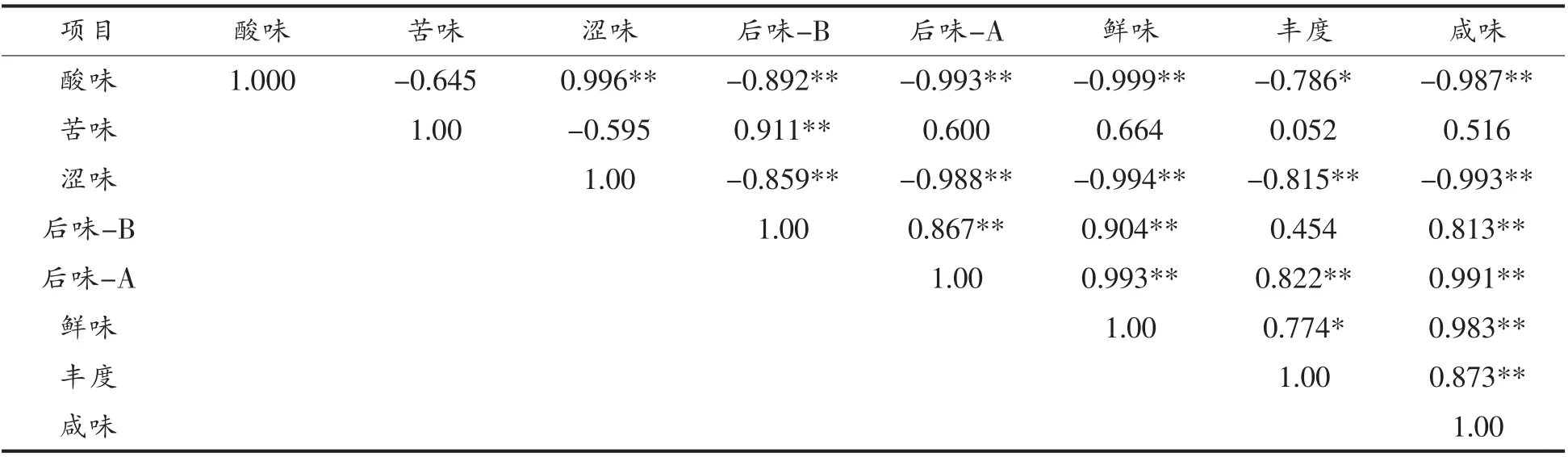
表1 传感器响应值相关性分析表Table 1 Correlation analysis table of sensor response value
2.1.2 豆酱发酵过程中雷达图分析 不同发酵时间豆酱在酸味、苦味、涩味、后味-B、后味-A、鲜味、丰度和咸味的分布雷达图见图1。
由图1可知,咸味、丰度和鲜味的响应信号值较高,而苦味、涩味、后味-B、后味-A 和酸味的响应信号值较低。这表明豆酱的发酵过程中主要形成鲜味、咸味以及复合滋味,而酸味、苦味和涩味的成分较少。
2.1.3 不同发酵时期豆酱滋味品质总体变化 如图2所示,主成分分析表明,豆酱在不同发酵阶段滋味品质的信息主要集中在前两个主成分,其中累计贡献率为99.54%。第一主成分的贡献率为84.99%,第二主成分的贡献率为14.55%,根据计算样本相关矩阵的特征向量得出主成分的函数式为:
Y1=-0.147X1+0.098X2-0.146X3+0.034X4+0.146X5+0.147X6+0.144X7+0.144X8
Y2=0.024X1+0.640X2+0.075X3+0.352X4-0.073X5-0.003X6-0.038X7-0.186X8
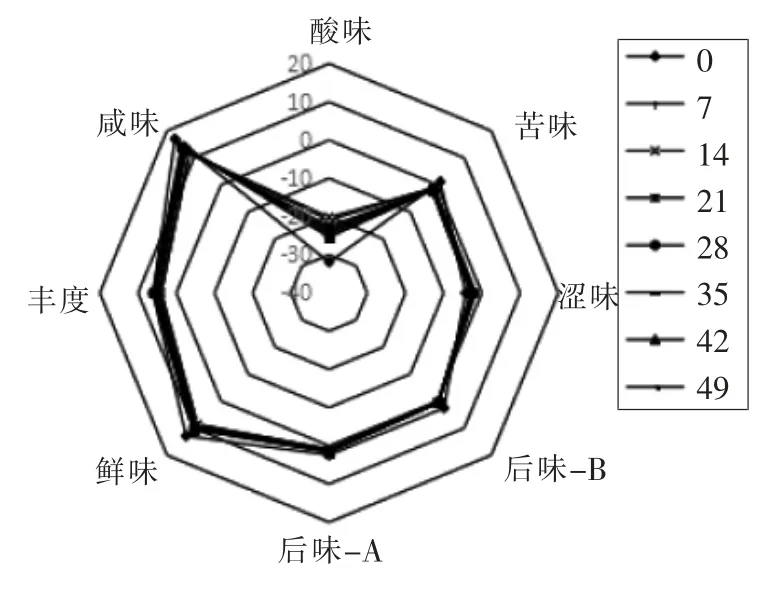
图1 不同发酵时间豆酱电子舌检测结果Fig.1 Determination results of soybean paste with different aging time by electronic tongue
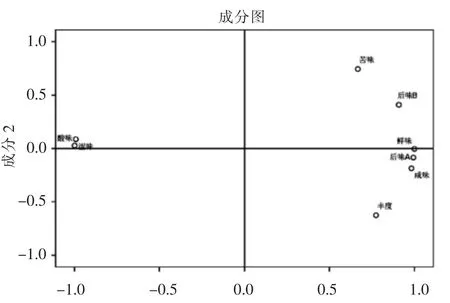
图2 主成分分析载荷图Fig.2 Principal component analysis load diagram
由函数式可以看出,在第一主成分中X1、X3、X5、X6、X7、X8的系数绝对值最大;在第二主成分中X2、X4的系数绝对值最大。结果表明,滋味品质的8 个指标可以分成两类,第一主成分由苦味、后味-A(涩味的回味)、后味-B(苦味的回味)、咸味、丰度和鲜味等6 个滋味品质指标构成;第二主成分由酸味和涩味两个滋味品质指标构成。由图2可知,第一主成分中的后味-A、丰度和咸味呈负相关,第二主成分各指标呈正相关,相关性还需采用person 相关性分析进行验证。
综上所述,在豆酱的发酵过程中主要形成鲜味、咸味以及复合滋味,而酸味、苦味和涩味的成分较少。曾有报道指出豆酱中各种味道相互协调,而鲜味和咸味尤为突出[17],而本研究也显示相似结果。
2.2 豆酱发酵过程中微生物多样性分析
2.2.1 Alpha 多样性分析 如表2所示,ACE 和Chao 指数均用来计算菌群丰度,数值越大表明群落的丰富度越高;Shannon 与Simpson 指数表示菌群多样性,Shannon 指数越高表示群落多样性越大,Simpson 指数越高表示群落多样性越小。
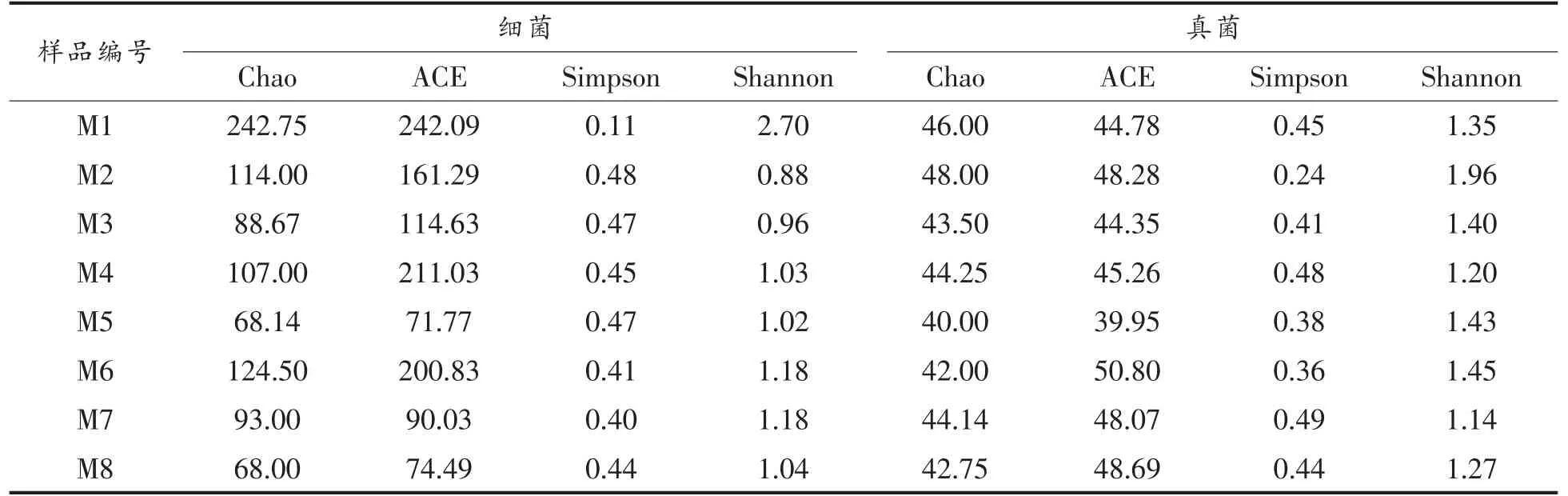
表2 样品Alpha 多样性指数表Table 2 The Alpha of samples
通过Chao 和ACE 指数对样品丰度的比较可知,真菌的Chao 和ACE 指数明显低于细菌的Chao 和ACE 指数,说明豆酱样品中细菌的丰富度比真菌高。在豆酱发酵过程中,菌群丰富度每阶段都在变化,从整体趋势来看,菌群丰度上下波动,说明菌群在豆酱发酵过程中变化明显;通过Simpson 和Shannon 指数对样品多样性的比较可知,在豆酱发酵过程中,样品中的菌群多样性均比下酱当天多样性减少。豆酱发酵过程中细菌的波动性远大于真菌,说明细菌在豆酱发酵过程中变化更大。
2.2.2 稀释曲线 稀释曲线主要利用各样本的测序量在不同测序深度时的微生物多样性指数构建曲线,来反应不同测序数量时的微生物多样性。
如图3、图4所示,在序列数比较少时,多样性指数随序列数的增加而迅速增加,当序列数达到一定值时,多样性指数随着序列数的增加而缓慢增加,渐渐趋于饱和状态,说明测序结果可靠,可以充分反映样品的多样性。具体变化如下:当序列数小于10 000 时,多样性指数随序列数的增加而迅速增加,当序列数在10 000~20 000 之间时,多样性指数随序列数的增加而缓慢增加,当序列数大于20 000 时,多样性指数不随序列数的增加而增长,说明多样性指数趋于饱和,测序结果可以充分反应样品的多样性。通过真菌和细菌稀释曲线纵坐标的对比可知,真菌丰富度明显低于细菌。
2.2.3 不同发酵时期豆酱菌群门水平结构分析图5为真菌和细菌在门水平的分布图,豆酱整个发酵阶段共鉴定出3 个已知真菌门,分别为子囊菌门(Ascomycota)、担子菌门(Basidiomycota)和接合菌门(Zygomycota)。优势真菌门均为子囊菌门,并且占有绝对优势,所占比例在90.36%~96.47%之间,担子菌门和接合菌门所占比例较小分别在1.59%~7.32%、1.09%~6.4%之间。
豆酱在整个发酵阶段共鉴定出3 个已知细菌门,分别为厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)和放线菌门(Actinobacteria)。优势细菌门为厚壁菌门,除M1 中厚壁菌门占比为85.79%,其余发酵阶段厚壁菌门占比均在99%以上,变形菌门在M1 中占13.03%,在之后的发酵过程中所占比例均在1%以下。
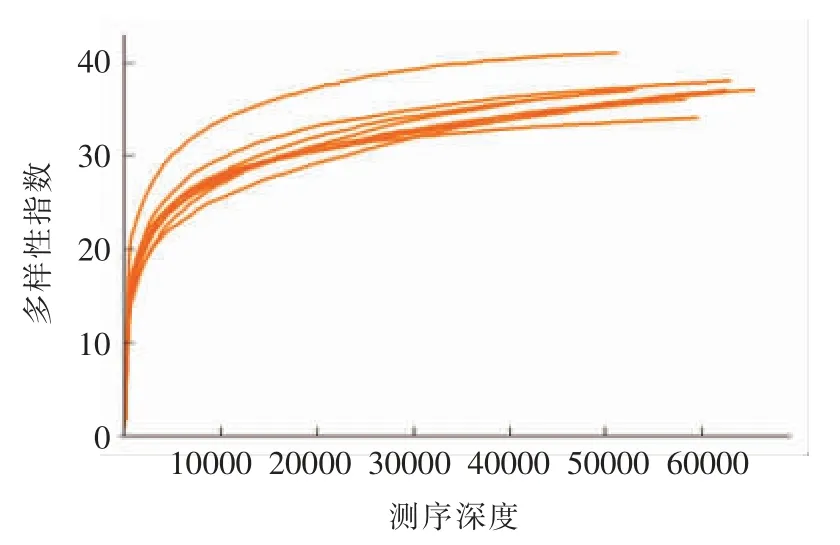
图3 真菌稀释曲线Fig.3 The dilution curve of fungi
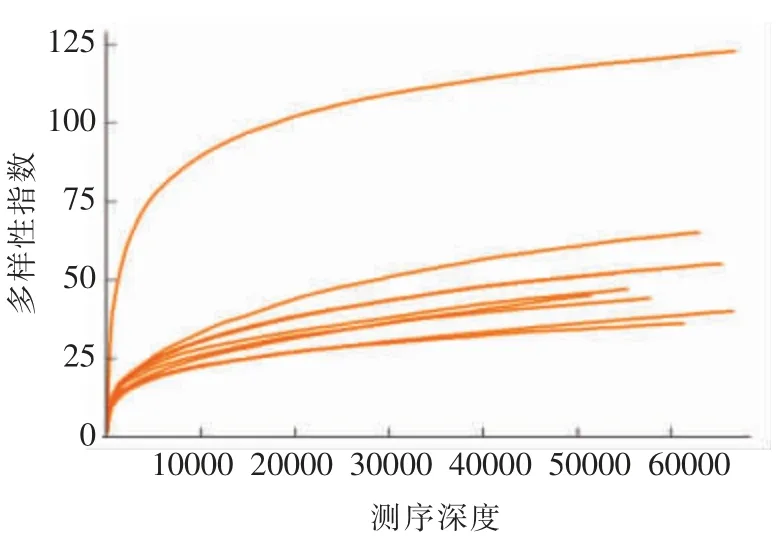
图4 细菌稀释曲线Fig.4 The dilution curve of bacteria
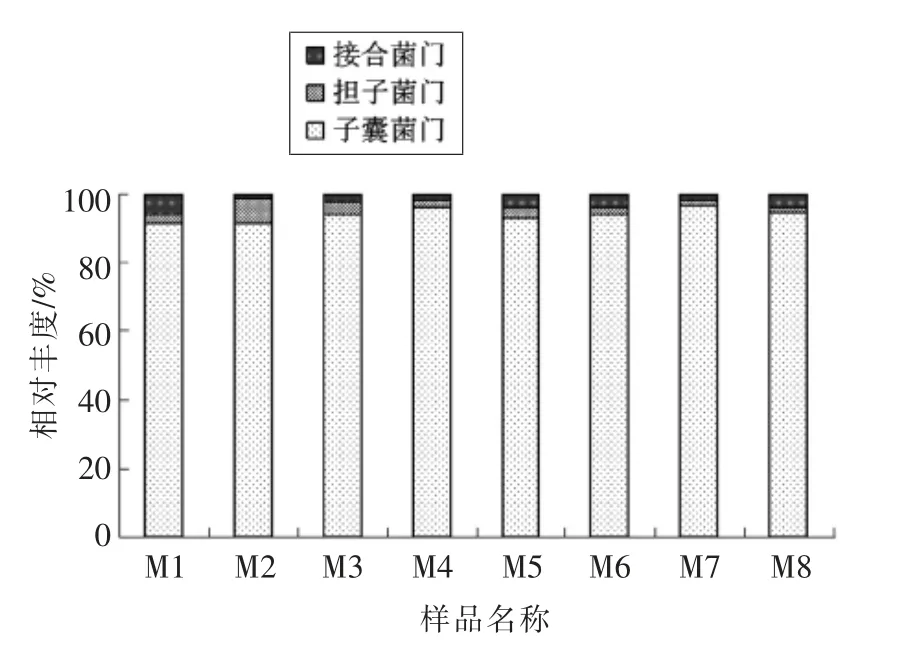
图5 豆酱发酵过程中真菌在门水平的分布Fig.5 Distribution of fungi at the phyla level during the fermentation of soybean paste

图6 豆酱发酵过程中细菌在门水平的分布Fig.6 Distribution of bacteria at the phyla level during the fermentation of soybean paste
豆酱整个发酵阶段共鉴定出9 个已知真菌属,其中占30%以上的优势菌属为青霉属(Penicillium) 和异常威克汉姆酵母属(Wickerhamomyces),其次还有德巴利氏酵母菌属(Debaryomyces)、毛霉菌属(Mucor)和兰久浩酵母菌属(Guehomyces)等。
豆酱整个发酵阶段共鉴定出7 个已知细菌属,豆酱发酵前期优势菌属为乳杆菌属(Lactobacillus)、肠球菌属(Enterococcus)和明串珠菌属(Leuconostoc),随着发酵时间的延长,四联球菌属(Tetragenococcus) 变为优势菌属,占77.98%~96.03%,在整个发酵过程中乳杆菌属为主要菌属,占比在1.98%~14.96%之间。
在发酵的中后期,四联球菌属成为绝对优势的菌属,研究表明该菌属是一种对健康有益的益生菌,在许多发酵食品中均可检测到,酵母菌在参与代谢反应之后可产生醇类和醛类等代谢物,然而四联球菌属在参与完代谢反应之后则主要产生乳酸等有机酸类,因此两者共同反应可明显提高豆酱等产品中的酯类含量。由此可知,在豆酱发酵过程中,四联球菌属对其风味的形成起着至关重要的作用[15,18]。武俊瑞等[19]初步推断嗜盐四联球菌(Tetragenococcus halophilus) 和植物乳杆菌(Lactobacillus plantarum)是黑龙江传统发酵豆酱中的优势乳酸菌菌群。植物乳杆菌广泛存在于酱油和豆酱中,它是FDA 批准使用的安全菌株[20]。
植物乳杆菌为豆酱中最主要的乳杆菌类型,也是发酵食品中不可或缺的菌种。植物乳杆菌可以将发酵食品中的糖转化为乳糖,也可以通过代谢生成多种氨基酸,如天冬氨酸、组氨酸以及精氨酸等,这几种氨基酸可有效改善豆酱的风味。并且该菌在人体内可以作为有益菌株调节机体,起到改善、调节肠道微生物菌群平衡,有效降低血液中的胆固醇含量以及缓解乳糖不耐症等作用[21-23]。
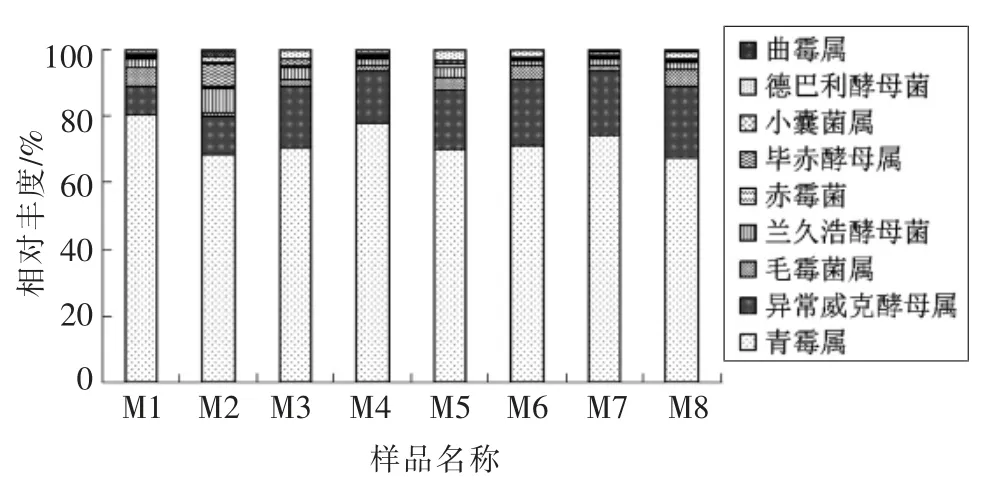
图7 豆酱发酵过程中真菌在属水平的分布Fig.7 Distribution of fungi at the genus level during the fermentation of soybean paste
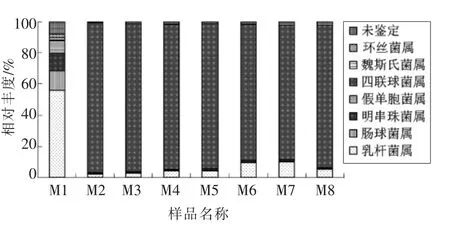
图8 豆酱发酵过程中细菌在属水平的分布Fig.8 The distribution of bacteria at the genus level during the fermentation of soybean paste
2.3 滋味特性与微生物多样性的相关性分析
在豆酱发酵过程中,不同滋味的变化是各种微生物相互作用代谢的结果,研究微生物与滋味间的相关性对与改善豆酱滋味有着重要作用。
对豆酱发酵过程中的滋味与微生物变化进行相关性分析(表3),其中微生物在豆酱中所占比例均在1%以上。

表3 细菌与滋味特性相关性分析Table 3 Correlation analysis of bacteria and taste characteristics
由表3数据可知,乳杆菌属等5 种菌属与涩味呈极显著负相关,与酸味、苦味、后味-B、后味-A 以及鲜度呈极显著正相关;乳杆菌属与咸味响应值呈负相关,而四联球菌和酸味的响应值呈极显著正相关,与咸味呈显著正相关。有研究表明细菌中的乳酸菌是促进豆酱风味物质形成的重要微生物,可以改善豆酱的风味品质[24],本研究发现与豆酱滋味品质呈正相关的微生物均为乳酸菌,验证了此结果。
由表4可知,异常威克酵母属与苦味呈显著负相关;毕赤酵母属与丰度呈显著负相关;毛霉菌属、酸味以及涩味呈显著负相关,而与后味-A、鲜味、丰度以及咸味所呈显著正相关。
通过相关性分析可以看出,大多数的细菌都对M 家豆酱风味的形成具有重要影响。真菌方面,毛霉菌属对M 家豆酱风味的影响相对较大。毛霉菌属可以分泌处理不同的酶,所分泌的酶有如下作用:1) 蛋白酶通过水解蛋白质生成呈味的氨基酸;2)淀粉酶水解淀粉产生糖类物质,其中一部分的糖类被细菌和酵母菌所利用,从而可以形成有机酸和酯类等相关的呈味物质;3) 毛霉分解果胶酶以及纤维素酶,对豆酱风味的形成有着至关重要的作用[25];4)毕赤酵母属与丰度呈显著负相关,可能由于毕赤酵母菌在豆酱发酵过程中产生醭,分解豆酱中的有机成分,从而降低豆酱的风味[26]。
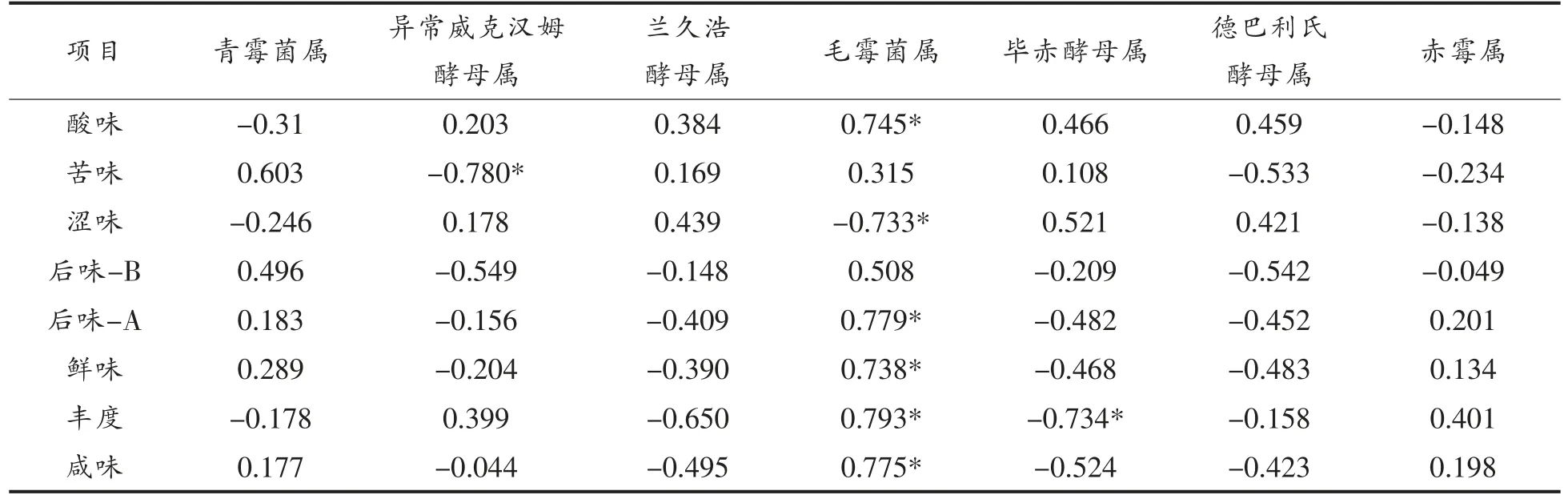
表4 真菌与滋味特性相关性分析Table 4 Correlation analysis of fungi and taste characteristics
3 讨论
本研究应用电子舌和高通量测序技术对自然发酵豆酱发酵过程中的滋味特性和微生物多样性进行分析。结果表明,在豆酱发酵过程中,不同发酵体系可能含有相同的微生物菌群,而相同的风味也可由不同菌群代谢产生。
研究显示豆酱在发酵过程中微生物多样性在门水平上,优势细菌为厚壁菌门,真菌为子囊菌门;在属水平上,主要细菌为乳杆菌属和四联球菌属,主要真菌为青霉菌属和异常威克汉姆酵母菌属。张颖等[27]通过PCR-DGGE 技术结合微生物多样性测序方法分析东北豆酱自然发酵过程中细菌的多样性,发现肠球菌属(Enterococcus)、四联球菌属(Tetragenococcus)和乳杆菌属(Lactobacillus)为不同发酵阶段豆酱样品的优势细菌属,该结果与本研究结果相近。Kim 等[28]对韩国的10 份豆酱采用DGGE 技术分析微生物多样性,细菌对16S rRNA V3 区采用通用引物,结果表明,乳酸菌如肠膜明串珠菌(Leuconostoc mesenteroide)、嗜盐四联球菌(Tetragenococcus halophilus) 和屎肠球菌(Enterococcus faecium)为优势菌株;真菌的分析结果表明毛霉菌(Mucor plumbeus)、米曲霉(Aspergillus oryzae)和汉逊德巴利酵母(Debaryomyces hansenii)是豆酱样本中最常见的真菌。而本研究中发现的真菌与上述结果略有不同,可能由于温度、水分等环境因素不同导致[16,29]。
此外,本研究结果显示不同属的细菌对豆酱的同一风味均有贡献。安飞宇等[29]利用宏转录组学技术对豆酱自然发酵过程中的活性菌群及风味物质的关联分析表明嗜盐四联球菌(Tetragenococcus halophilus)、植物乳杆菌(Lactobacillus plantarum)、酸鱼乳杆菌 (Lactobacillus acidipiscis)、蛋白原酶乳杆菌(Lactobacillus rennini)、枯草芽孢杆菌(Bacillus subtilis)及粪肠球菌(Enterococcus faecalis)与风味物质呈显著正相关,故将其定义为对风味物质合成有重要影响的核心发酵微生物种。该结果与本试验的研究结论一致,进一步说明不同发酵体系可能含有相同的微生物菌群,同时这些“共同”的核心菌群对发酵食品独特风味的形成也起到至关重要的作用。
