传统发酵食品中乳酸菌的抗生素耐药性评估及耐药基因分析
2020-08-03李雅茹王超宇王如福
许 女 李雅茹 王超宇 张 浩 王如福
(山西农业大学食品科学与工程学院 山西太谷030801)
细菌耐药性问题愈加严峻,已成为威胁全球性公共卫生的主要问题。长期以来,国内外科研人员的研究重点在于临床致病菌的耐药性方面,而对非致病菌耐药性的研究和报道较少。近年来,研究焦点逐步转向以食物链为媒介的抗性基因的产生和传播上。乳酸菌是很多发酵制品中的重要菌株,一直被认为是安全的。然而,由于抗生素的不正当使用,越来越多的乳酸菌具有耐药性或者携带耐药基因,大部分耐药基因位于可移动的非染色体遗传因子上,包括质粒、转座子、整合子-基因盒系统、噬菌体等,可通过水平转移进而传递给其它肠道菌株,甚至是致病菌,导致超级细菌的产生,增加抗生素治疗的失败率,给人类的健康带来严重的危害。
目前对于乳酸菌的耐药性还没有开展系统性研究,主要集中在动物源[1]、乳及乳制品[2-4]中的分离菌株,而关于传统发酵食品,如发酵肉类[5]、泡菜[6]、醋、酒及益生菌制剂[7]中乳酸菌的耐药性研究较少。本文主要研究山西老陈醋醋醅、农家发酵泡菜和发酵乳制品中乳酸菌的耐药表型和基因型,对乳酸菌耐药机制、传播机理的研究提供支持,对保证食品安全具有重要意义。
1 材料与方法
1.1 主要材料与试剂
发酵乳制品,西藏、内蒙地区农家发酵乳制品;泡菜汁,四川地区农家泡菜;醋醅,山西紫林醋业股份有限公司。
乳酸菌分离、培养MRS,M17 肉汤/琼脂培养基,北京陆桥技术有限责任公司;细菌提基因组试剂盒,北京博迈德科技发展有限公司;Taq DNA聚合酶、dNTP、10×聚合酶链式反应(Polymerase chain reaction,PCR) 反应缓冲液、10×Loading Buffer,大连宝生物工程有限公司。
1.2 主要仪器与设备
Veriti PCR 扩增仪,美国ABI 公司;电泳成套设备,美国Bio-rad 公司;凝胶成像系统,美国Alpha Innotech 公司;台式高速冷冻离心机,美国Sigma 公司。
1.3 试验方法
1.3.1 菌株的分离与鉴定 将样品用生理盐水稀释到10-7~10-9CFU/mL,吸取100 μL 置于加有0.04%溴甲酚紫的MRS 和M17 培养基平板上,37 ℃培养48 h,挑取单个产酸菌落进行生理生化和16S rDNA 菌种鉴定。
1.3.2 菌株的耐药表型检测 按照美国临床和实验室标准协会(CLSI)(2008)所推荐的MIC 法进行药物敏感性检测,质控菌株为金黄色葡萄球菌ATCC29213,所用抗生素均购自中国兽医药品监察所或中国药品与生物制品检定所。
1.3.3 耐药基因的PCR 扩增 参考文献[8-9]等的引物序列,采用PCR 方法对大环内酯类、林可胺类、四环素类和β-内酰胺类等耐药基因进行检测,引物序列及扩增片段长度见表1。
1.3.4 生物被膜检测
1.3.4.1 微量滴定板法(MTP) 过夜培养的乳酸菌菌株,调整菌悬液浓度为1.5×108CFU/mL,经TSB 1∶100 稀释后加到96 孔平底组织培养孔中,每孔加入200 μL,每株菌做3 个平行孔。以不接菌的TSB 培养基作为阴性对照,37 ℃培养24 h。轻弃上清,用PBS 缓冲液洗涤3 次后,60 ℃,干燥固定1 h,然后用1%的结晶紫染色1 min,蒸馏水冲洗后,加入200 μL 95%乙醇,待粘附在孔底的生物被膜菌全部溶解后,于570 nm 波长处测OD值。
ODc= 阴性对照样品的平均OD 值+3×SD(标准差)
不产生物被膜的菌株:OD ≤ODc;
产生物被膜能力较弱的菌株:ODc <OD ≤2×ODc;
产生物被膜能力适中的菌株:2 × ODc <OD≤4×ODc;
产生物被膜能力较强的菌株:4×ODc <OD
2 结果与讨论
2.1 传统发酵食品中乳酸菌的分离与鉴定
共分离鉴定出乳酸菌菌株97 株,具体分布如图1所示,并对典型分离菌株进行了16S rDNA系统发育树的构建(图2)。醋醅中乳酸菌的种类较丰富,共分离菌株41 株,其中戊糖片球菌10 株(24.39%)、发酵乳杆菌7 株(17.07%)、短乳杆菌6株(14.63%)、瑞士乳杆菌4 株(9.76%)、干酪乳杆菌2 株(4.88%)、面包乳杆菌2 株(4.88%)、淀粉乳杆菌2 株(4.88%)、耐久肠球菌2 株(4.88%)、植物乳杆菌1 株(2.44%)、凝结芽孢杆菌1 株(2.44%)、乳酸乳球菌1 株 (2.44%)、乳酸片球菌1 株(2.44%)、粘膜乳杆菌1 株(2.44%)、鼠李糖乳杆菌1 株(2.44%)。泡菜中共分离出乳酸菌21 株,其中主要是植物乳杆菌,分离出15 株(71.43%),另外还有5 株短乳杆菌(23.81%)和1 株戊糖片球菌(4.76%)。传统乳制品中共分离出35 株乳酸菌,其中植物乳杆菌11 株(31.34%)、凝结芽孢杆菌16株(45.71%)、戊糖片球菌1 株(2.86%)、耐久肠球菌7 株(20%)。
2.2 乳酸菌菌株的抗生素耐药性评估
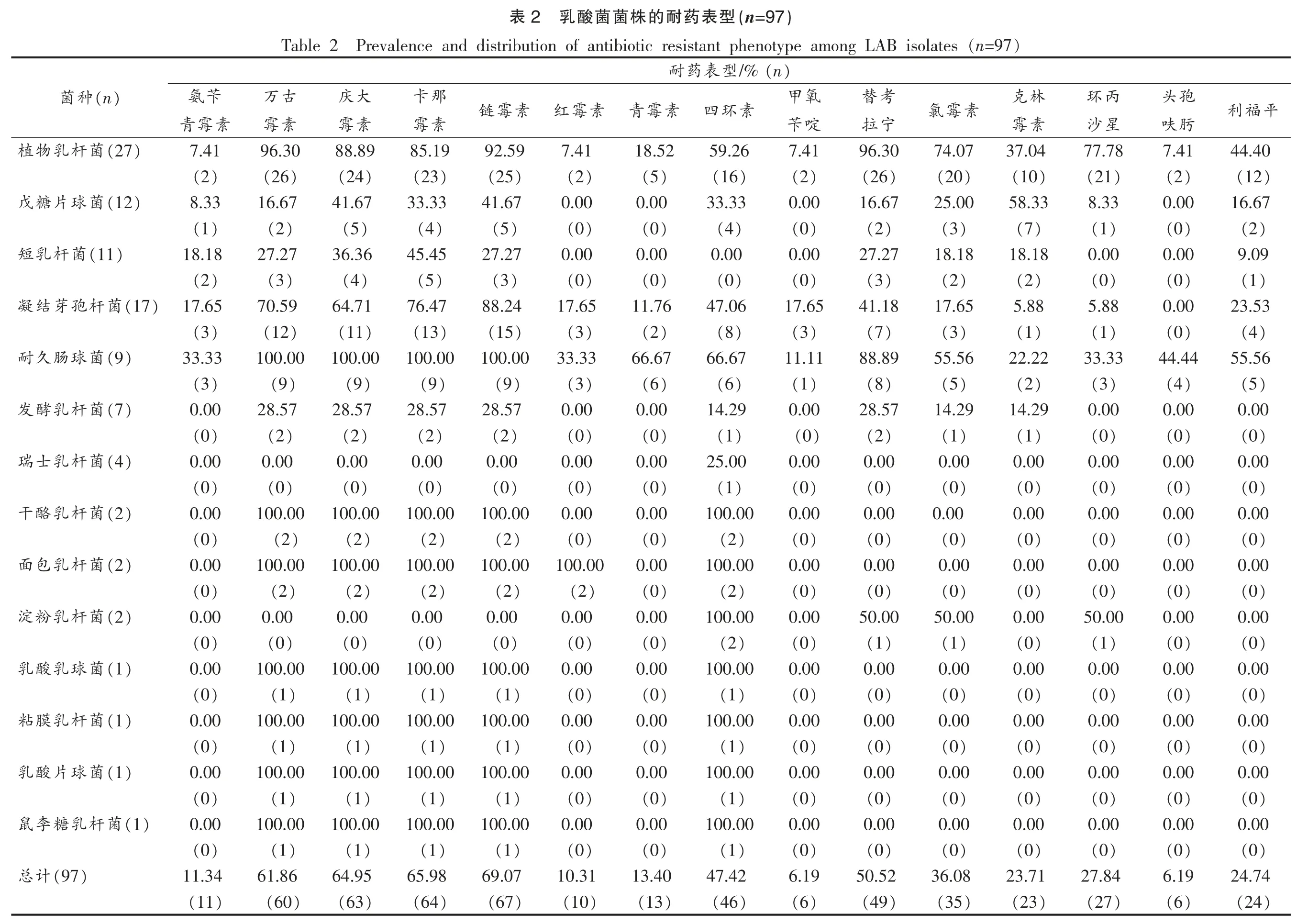
如表2和图3所示,乳酸菌对万古霉素、庆大霉素、卡那霉素、链霉素、四环素和替考拉宁的耐药性较强,耐药率达50%以上;对氨苄青霉素、红霉素、甲氧苄啶、头孢呋肟较敏感,耐药率为10%左右。1995年,Elisha 等[10]研究了不同种乳杆菌的耐药性,发现菌体中存在D-丙氨酸和D-丙氨酸连接酶,导致其对万古霉素形成天然耐药性。随后,其他学者也报道在鼠李糖乳杆菌、植物乳杆菌、乳酸乳球菌以及明串珠菌等也存在对万古霉素的天然耐药性,并证实其耐药耐性由位于染色体基因组上的vnaX 基因编码[11]。秦宇轩等[12]对分离自市售酸奶中的100 株乳酸菌进行耐药性检测,发现100%的菌株对链霉素和庆大霉素耐药,部分对万古霉素耐药。张灼阳等[13]、Danielsen 等[14]的研究也表明大部分乳酸菌对于庆大霉素、链霉素、卡那霉素、替考拉宁、万古霉素等抗生素具有耐药性。董银萍等[15]对北京市售酸奶中分离得到的乳酸菌菌株进行耐药性研究,发现所有菌株对青霉素、氨苄青霉素敏感。Comunian 等[16]对121 株来自意大利发酵产品中的乳酸菌的研究表明,94.2%的菌株对红霉素敏感,77.7%的菌株对四环素敏感。潘露[6]对来自11 种发酵食品中的乳酸菌进行耐药分析,结果发现对环丙沙星和克林霉素耐药的乳酸菌株最多(85.71%),其次是氨苄青霉素、氯霉素、红霉素(64.28%)。可见,乳酸菌菌株的耐药程度与食品来源、种类、加工环境及加工方法密切相关。
研究结果显示植物乳杆菌和耐久肠球菌的耐药性最强,对各种抗生素都具有不同程度的耐药性。85%以上的植物乳杆菌对万古霉素、庆大霉素、卡那霉素、链霉素和替拉考宁具有耐药性,并且对四环素(59.26%)、氯霉素(74.07%)、克林霉素(37.04%)和利福平(44.40%)的耐药性也较强,对氨苄青霉素、红霉素、甲氧苄啶和头孢呋肟较为敏感,耐药率均为7.41%。有报道[17]称乳酸杆菌通常对青霉素类抗生素 (氨苄青霉素和哌拉西林)和β-内酰胺酶抑制剂表现为敏感,这些抗生素通常用来抑制细胞壁合成,对抑制蛋白质合成的抗生素显示为敏感,如红霉素和克林霉素等,然而对氨基糖苷类(卡那霉素、链霉素和庆大霉素等),大部分乳酸杆菌对其显示为耐药。一般情况下,大部分乳酸杆菌对抑制核酸合成的抗生素耐药,如甲氧苄啶等为固有耐药,而本研究中的植物乳杆菌却对甲氧苄啶显示出高度敏感 (92.59%)。Lavilla-Lerma 等[18]对分离自西班牙农家山羊奶酪中的植物乳杆菌进行耐药性检测,发现所有菌株对环丙沙星、万古霉素和替考拉宁耐药,30%左右的菌株对青霉素、四环素、利福平、左氧氟沙星耐药,90%以上的菌株对氨苄西林、庆大霉素、链霉素、红霉素和氯霉素敏感。进一步证实了乳酸菌耐药的复杂机制。

图2 基于16S rDNA 序列的典型分离乳酸菌菌株系统发育树Fig.2 Dendrogram of LAB isolates based on 16S rDNA sequence
平福利4 4.40)(12 16.67)(2 9.09)(1 23.53)(4 55.56)(5 0.00(0)0.00)(0 0.00)(0 0.00)(0 0.00(0)0.00)(0 0.00)(0 0.00)(0 0.00)(0 24.74)(24孢头丙环肟呋星沙7.41 77.78)(2)(21 0.00 8.33)(0)(1 0.00 0.00)(0)(0 0.00 5.88)(0)(1 44.44 33.33)(4)(3 0.00 0.00(0)(0)0.00 0.00)(0)(0 0.00 0.00)(0)(0 0.00 0.00)(0)(0 0.00 50.00(0)(1)0.00 0.00)(0)(0 0.00 0.00)(0)(0 0.00 0.00)(0)(0 0.00 0.00)(0)(0 6.19 27.84)(6)(27(n=97)型表药耐的株菌菌酸乳2 表Prevalence and distribution of antibiotic resistant phenotype among LAB isolates (n=97)Table 2 ) (n /%型表药耐林克考替氧甲那卡大庆古万素霉氯素环四 素霉青 素霉红 素霉链素霉宁拉啶苄素霉素霉素霉37.04 74.07 96.30 7.41 59.26 18.52 7.41 92.59 85.19 88.89 96.30)(10)(20)(26)(2)(16)(5)(2)(25)(23)(24)(26 58.33 25.00 16.67 0.00 33.33 0.00 0.00 41.67 33.33 41.67 16.67)(7)(3)(2)(0)(4)(0)(0)(5)(4)(5)(2 18.18 18.18 27.27 0.00 0.00 0.00 0.00 27.27 45.45 36.36 27.27)(2)(2)(3)(0)(0)(0)(0)(3)(5)(4)(3 5.88 17.65 41.18 17.65 47.06 11.76 17.65 88.24 76.47 64.71 70.59)(1)(3)(7)(3)(8)(2)(3)(15)(13)(11)(12 22.22 55.56 88.89 11.11 66.67 66.67 33.33 100.00 100.00 100.00 100.00 )(2)(5)(8)(1)(6)(6)(3)(9)(9)(9)(9 14.29 14.29 28.57 0.00 14.29 0.00 0.00 28.57 28.57 28.57 28.57(1)(1)(2)(0)(1)(0)(0)(2)(2)(2)(2)0.00 0.00 0.00 0.00 25.00 0.00 0.00 0.00 0.00 0.00 0.00)(0)(0)(0)(0)(1)(0)(0)(0)(0)(0)(0 0.00 0.00 0.00 0.00 100.00 0.00 0.00 100.00 100.00 100.00 100.00 )(0)(0)(0)(0)(2)(0)(0)(2)(2)(2)(2 0.00 0.00 0.00 0.00 100.00 0.00 100.00 100.00 100.00 100.00 100.00 )(0)(0)(0)(0)(2)(0)(2)(2)(2)(2)(2 0.00 50.00 50.00 0.00 100.00 0.00 0.00 0.00 0.00 0.00 0.00(0)(1)(1)(0)(2)(0)(0)(0)(0)(0)(0)0.00 0.00 0.00 0.00 100.00 0.00 0.00 100.00 100.00 100.00 100.00 )(0)(0)(0)(0)(1)(0)(0)(1)(1)(1)(1 0.00 0.00 0.00 0.00 100.00 0.00 0.00 100.00 100.00 100.00 100.00 )(0)(0)(0)(0)(1)(0)(0)(1)(1)(1)(1 0.00 0.00 0.00 0.00 100.00 0.00 0.00 100.00 100.00 100.00 100.00 )(0)(0)(0)(0)(1)(0)(0)(1)(1)(1)(1 0.00 0.00 0.00 0.00 100.00 0.00 0.00 100.00 100.00 100.00 100.00 )(0)(0)(0)(0)(1)(0)(0)(1)(1)(1)(1 23.71 36.08 50.52 6.19 47.42 13.40 10.31 69.07 65.98 64.95 61.86)(23)(35)(49)(6)(46)(13)(10)(67)(64)(63)(60苄氨素霉青7.41)(2 8.33)(1 18.18)(2 17.65)(3 33.33)(3 0.00(0)0.00)(0 0.00)(0 0.00)(0 0.00(0)0.00)(0 0.00)(0 0.00)(0 0.00)(0 11.34)(11)(n种菌)(27菌杆乳)(12菌球片(11)菌杆) (17菌杆孢芽)(9菌球肠)(7菌杆乳)(4菌杆乳)(2菌杆乳)(2菌杆乳(2)菌杆乳)(1菌球乳)(1菌杆乳)(1菌球片(1)菌杆乳糖)(97物植糖戊乳短结凝久耐酵发士瑞酪干包面粉淀酸乳膜粘酸乳李鼠计总
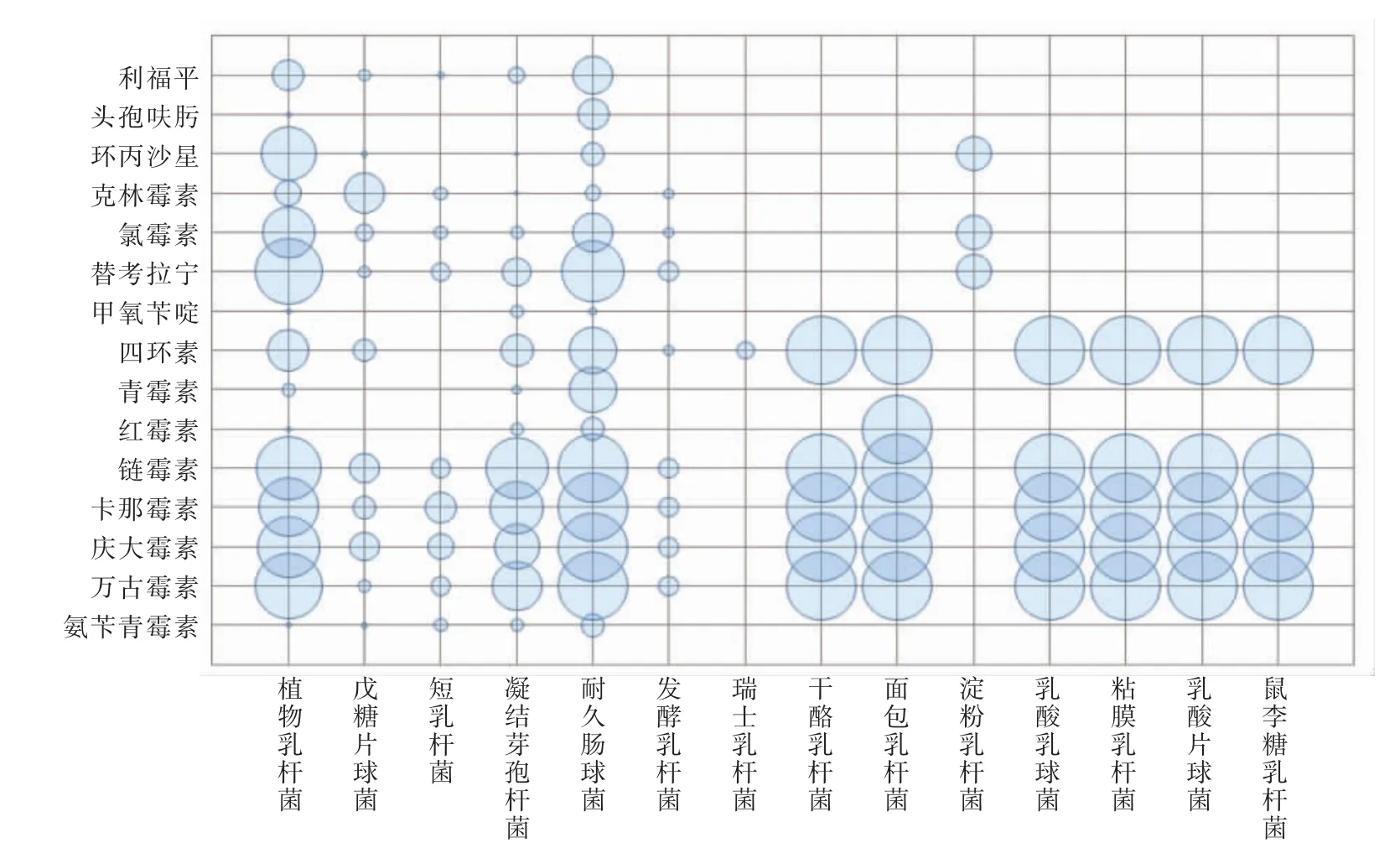
图3 乳酸菌分离菌株的耐药表型分布气泡图(气泡大小反映检出率高低)(n=97)Fig.3 Bubble chart of antibiotic resistant phenotype among LAB isolates (n=97)
肠球菌属作为获得性耐药的典型菌属代表,近年来倍受关注,尤其是有关其耐药基因的携带、转移、突变等耐药机制。研究结果显示100%的耐久肠球菌对万古霉素、庆大霉素、卡那霉素、链霉素具有耐药性,另外对青霉素(66.67%)、四环素(66.67%)、替拉考宁(88.89%)、氯霉素(55.56%)、利福平(55.56%) 的耐药性也较强。对甲氧苄啶(11.11%)和克林霉素(22.22%)较为敏感。王梦姣[19]对分离自内蒙古牧区马奶及其制品中的肠球菌属乳酸菌进行耐药性试验,结果表明100%的菌株对红霉素、氨苄西林、阿莫西林敏感,86%以上的菌株对氧氟沙星、诺氟沙星、环丙沙星等喹诺酮类药物敏感。Erbas 等[20]对来源于奶牛乳腺炎乳样中的94 株肠球菌进行了耐药表型测定,发现其耐药率分别为四环素81.9%、红霉素28.7%、氯霉素10.7%、万古霉素1.06%。
从食品中分离出的片球菌属的药物敏感性数据很少。本试验所分离的12 株戊糖片球菌的所有菌株对红霉素、青霉素、甲氧苄啶和头孢呋肟敏感,对环丙沙星8.33%、氨苄青霉素8.33%、利福平16.67%也较为敏感,有报道证实此研究结果。一般来说,片球菌对青霉素、红霉素、亚胺培南、氯霉素、利福平等抗生素的药敏结果表明为敏感。本试验中的戊糖片球菌对克林霉素(58.33%)、庆大霉素(41.67%)、链霉素(41.67%)、四环素(33.33%)和卡那霉素(33.33%)的耐药性较强。Swenson 等[21]也曾报道片球菌属对糖肽类四环素、万古霉素、环丙沙星、替考拉宁、复方新诺明等显示为固有耐药。而本文中仅有2 株片球菌对环丙沙星替考拉宁和万古霉素具有耐药性。11 株短乳杆菌对红霉素、青霉素、四环素、甲氧苄啶、环丙沙星和头孢呋肟敏感,对庆大霉素、卡那霉素耐药,耐药率分别为36.36%和45.45%。60%以上的凝结芽孢杆菌对万古霉素、庆大霉素、卡那霉素和链霉素呈耐药性,对四环素(47.06%)和替考拉宁(41.18%)的耐药性也较强,而对其它类抗生素的耐药性较弱(0~23.53%)。另外,还有2 株干酪乳杆菌、2 株面包乳杆菌、1 株乳酸乳球菌、1 株粘膜乳杆菌、1 株乳酸片球菌和1 株鼠李糖乳杆菌对万古霉素、庆大霉素、卡那霉素、四环素和链霉素呈现出100%的耐药性,而对其它类抗生素均敏感。2 株淀粉乳杆菌呈现出50%的替考拉宁、氯霉素环丙沙星耐药性和100%的四环素耐药性。
2.3 乳酸菌菌株的耐药基因分布情况
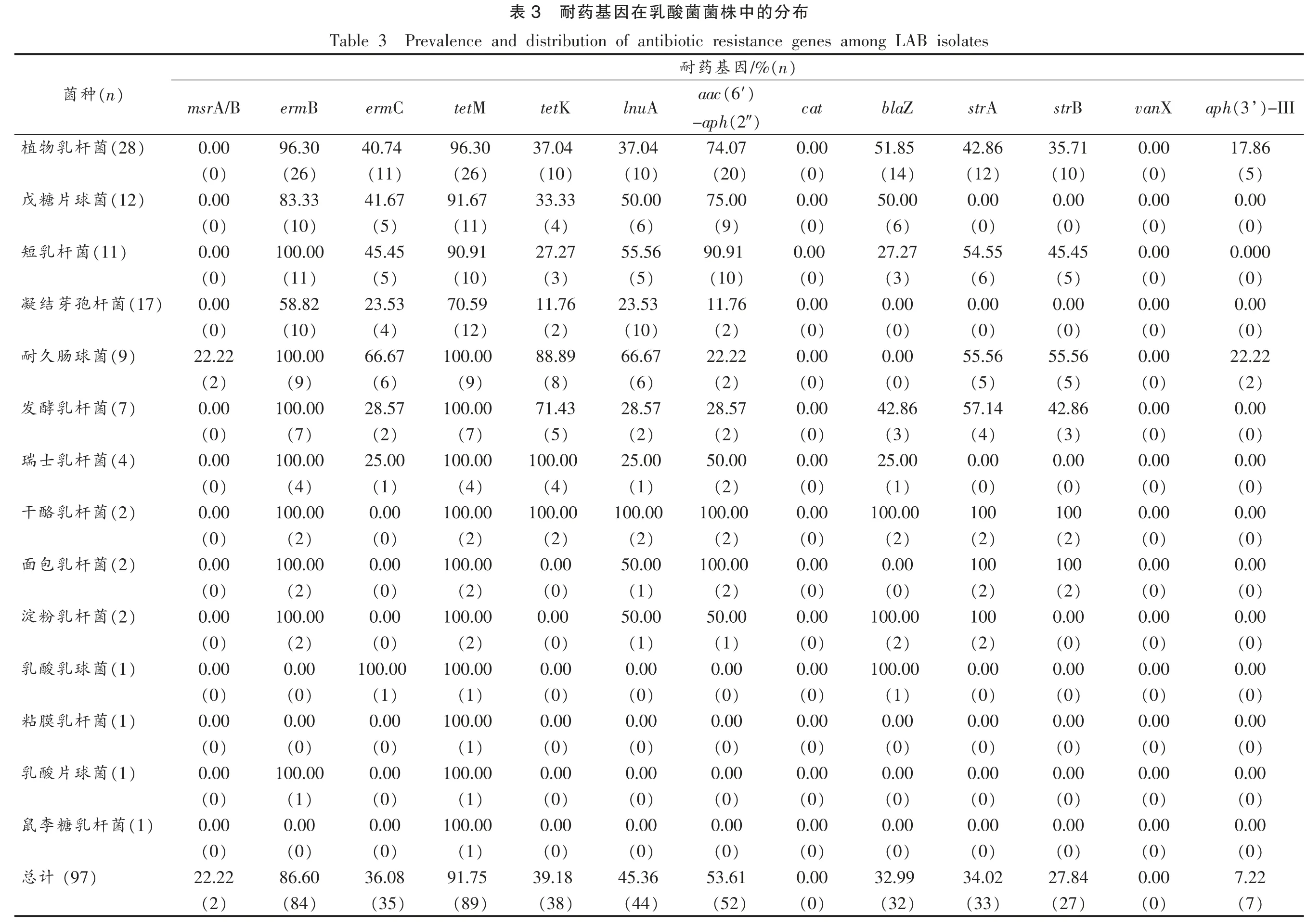
为初步探究乳酸菌的耐药机制,实验人员检测了大环内酯-林肯酰胺类ML(ermA,ermB,msrA/B,lnuA)及四环素类(tetM,tetK)、氨基糖苷类(aac(6′)-aph(2″),aph(3’)-III,strA,strB)、β-内酰胺类(blaZ)、氯霉素(cat)和万古霉素(vanX)等抗生素耐性基因在97 株乳酸菌中的分布情况。
试验结果显示携带最多的ML 耐药基因是ermB (86.60%),其次是lnuA (45.36%),ermC(36.08%)和msrA/B(22.22%)。菌株对大环内酯-林肯酰胺类(ML)的耐药机制主要有3 种[22]:1)erm基因编码的核糖体甲基化修饰酶,对23S rRNA核糖体的修饰、突变作用,改变了大环内酯类抗生素(如红霉素)与抗生素的结合位点;2)由msr 基因编码抗生素溢流泵系统,属于ABC 转运子,主要负责诱导对大环内酯类抗生素及链霉杀阳菌素的抗性;3)lnuA 编码的林肯(酰)胺核甙酸基转移酶,Loeza-Lara 等[23]于2004年从隐性乳腺炎乳样中分离的金黄色葡萄球菌中检出该基因。
四环素能封闭核糖体30 S 亚基上的A 部位,使氨酰-tRNA 的反密码子不能与mRNA 结合,从而阻断肽链延伸。乳酸菌中常见的四环素抗性基因有核糖体保护蛋白tet(M)、tet(W),四环素外排蛋白tet(K)、tet(L)。本文中tetM 和tetK 的检出率分别为91.75%和39.18%。Ouoba 等[24]和董春阳[25]也发现了tetM 在乳酸菌中的高检出率(75%以上)现象。Huys 等[26]、杨埔[27]和Mannu 等[28]也曾分别证明tetM 基因位于粪肠球菌的质粒pM7M2 和转座子家族Tn9162 和Tn1545 上,可以在不同的微生物间转移,对人类健康有潜在威胁。
氨基糖苷类抗生素产生作用的主要靶点是核糖体,16S rRNA 的突变、甲基化修饰等,使抗生素与之结合的亲和力降低,产生耐药性等。本文氨基糖苷类耐药基因中,携带率最高的为aac(6′)-aph(2″)(53.61%),最低的为aph(3′)-III 基因(7.22%),与周宁[29]报道的市售酸奶中分离的保加利亚乳杆菌和嗜热链球菌种16.3%的aph(3′)-III 基因携带率相似。2008年,Ouoba 等[24]从乳酸菌中检测出编码卡那霉素的耐药基因aph (3′)-III,之后Paula等[30]进一步证实了aph(3′)-III 存在于质粒上,指出其可以转移到其它致病菌的可能性。本文中编码链霉素的耐药基因strA(34.02%)和strB(27.84%)的携带率高于周宁[29]的报道(strA,20.51%和strB,15.38%),远远低于耐药表型的检出率(69.07%),可能存在其它耐药基因(如:aadE 等)及耐药机制(外排、生物被膜等)。
β-内酰胺类抗生素包括临床最常用的青霉素与头孢菌素等。blaZ 编码β-内酰胺酶,可水解青霉素的β-内酰胺环,使药物失去作用。本试验中blaZ 的检出率为32.99%,其中在干酪乳杆菌、淀粉乳杆菌、乳酸乳杆菌的检出率都为100%,而耐药表型却对氨苄青霉素、青霉素和头孢呋肟敏感。可能由于基因的某个位点发生突变导致的“基因沉默”现象,可见耐药分子机制的复杂性需进一步研究。
乳酸杆菌对万古霉素为固有耐药,耐药基因vanX 由染色体编码,无转移特性。主要是肽聚糖骨架中NAM-肽和NAG-肽末端的氨基酸残基发生改变,变成D-丙氨酰乳酸,使万古霉素与末端的亲和力下降1 000 倍。本文的试验结果与谢丽斯等[31]对来自于传统发酵食品酸奶和泡菜中的53株乳酸菌检测结果相似,即耐药表型的检出率都很高,分别为61.86%和100%,而基因的检出率却为0。
乳酸菌中最常见的氯霉素抗性基因是乙酰转移酶基因(cat)。与万古霉素类似,试验中cat 基因的检出率为0,表型检测显示其具有36.08%的耐药性,杨埔[27]证实了此类现象。说明这些菌株的氯霉素抗性不是由cat 基因引起的,可能存在一些药物外排系统。对E.faecalis V583 的氯霉素应激性反应的研究表明,加入氯霉素后,一些转运蛋白的表达上调,可能将氯霉素排出细胞外,而脂肪酸代谢的基因表达上调,则使细胞膜发生改变,可能阻止氯霉素的进入。这些研究表明,乳酸菌对氯霉素的应激反应是一个复杂的过程,有待深入研究。另外,自发突变也会导致抗性的产生。
aph(3’)-III vanX strB 17.86 0.00 35.71)(5)(0)(10 0.00 0.00 0.00(0)(0)(0)0.000 0.00 45.45)(0)(0)(5 0.00 0.00 0.00)(0)(0)(0 22.22 0.00 55.56)(2)(0)(5 0.00 0.00 42.86)(0)(0)(3 0.00 0.00 0.00)(0)(0)(0 0.00 0.00 100)(0)(0)(2 0.00 0.00 100(0)(0)(2)0.00 0.00 0.00)(0)(0)(0 0.00 0.00 0.00)(0)(0)(0 0.00 0.00 0.00)(0)(0)(0 0.00 0.00 0.00(0)(0)(0)0.00 0.00 0.00)(0)(0)(0 7.22 0.00 27.84)(7)(0)(27布分的中株菌菌酸乳在因基药耐 3表Prevalence and distribution of antibiotic resistance genes among LAB isolates Table 3 )(n /%因基药耐)(6′aac strA blaZ cat lnuA tetK tetM ermC ermB)(2″-aph 42.86 51.85 0.00 74.07 37.04 37.04 96.30 40.74 96.30)(12)(14)(0)(20)(10)(10)(26)(11)(26 0.00 50.00 0.00 75.00 50.00 33.33 91.67 41.67 83.33(0)(6)(0)(9)(6)(4)(11)(5)(10)54.55 27.27 0.00 90.91 55.56 27.27 90.91 45.45 100.00)(6)(3)(0)(10)(5)(3)(10)(5)(11 0.00 0.00 0.00 11.76 23.53 11.76 70.59 23.53 58.82)(0)(0)(0)(2)(10)(2)(12)(4)(10 55.56 0.00 0.00 22.22 66.67 88.89 100.00 66.67 100.00)(5)(0)(0)(2)(6)(8)(9)(6)(9 57.14 42.86 0.00 28.57 28.57 71.43 100.00 28.57 100.00)(4)(3)(0)(2)(2)(5)(7)(2)(7 0.00 25.00 0.00 50.00 25.00 100.00 100.00 25.00 100.00)(0)(1)(0)(2)(1)(4)(4)(1)(4 100 100.00 0.00 100.00 100.00 100.00 100.00 0.00 100.00)(2)(2)(0)(2)(2)(2)(2)(0)(2 100 0.00 0.00 100.00 50.00 0.00 100.00 0.00 100.00(2)(0)(0)(2)(1)(0)(2)(0)(2)100 100.00 0.00 50.00 50.00 0.00 100.00 0.00 100.00)(2)(2)(0)(1)(1)(0)(2)(0)(2 0.00 100.00 0.00 0.00 0.00 0.00 100.00 100.00 0.00)(0)(1)(0)(0)(0)(0)(1)(1)(0 0.00 0.00 0.00 0.00 0.00 0.00 100.00 0.00 0.00)(0)(0)(0)(0)(0)(0)(1)(0)(0 0.00 0.00 0.00 0.00 0.00 0.00 100.00 0.00 100.00(0)(0)(0)(0)(0)(0)(1)(0)(1)0.00 0.00 0.00 0.00 0.00 0.00 100.00 0.00 0.00)(0)(0)(0)(0)(0)(0)(1)(0)(0 34.02 32.99 0.00 53.61 45.36 39.18 91.75 36.08 86.60)(33)(32)(0)(52)(44)(38)(89)(35)(84 msrA/B 0.00)(0 0.00(0)0.00)(0 0.00)(0 22.22)(2 0.00)(0 0.00)(0 0.00)(0 0.00(0)0.00)(0 0.00)(0 0.00)(0 0.00(0)0.00)(0 22.22)(2(n)种菌)(28菌杆乳(12)菌球片)(11菌杆)(17菌杆孢芽)(9菌球肠(7)菌杆乳)(4菌杆乳)(2菌杆乳)(2菌杆乳)(2菌杆乳)(1菌球乳)(1菌杆乳(1)菌球片)(1菌杆乳糖)(97物植糖戊乳短结凝久耐酵发士瑞酪干包面粉淀酸乳膜粘酸乳李鼠计总

图4 乳酸菌分离菌株的耐药基因分布气泡图(气泡大小反映检出率高低)(n=97)Fig.4 Bubble chart of antibiotic resistance genes among LAB isolates (n=97)

图5 多重耐药乳酸菌菌株在醋醅(n=41),泡菜(n=21)和乳制品(n=35)中的分布Fig.5 Distribution of multidrug resistant LAB isolates in brewing mass (n=41),pickle (n=21) and dairy products (n=35)
本试验中共检测出耐药表型≥6 的多重耐药菌株48 株,其中醋醅中5 株、泡菜中15 株、乳制品中28 株,多重耐药菌株分离率分别为(5/41,12.20%),(15/21,71.43%),(28/35,80.00%)。耐药基因型≥5 的多重耐药菌株57 株,其中醋醅中16株、泡菜中16 株、乳制品中25 株,多重耐药菌株分离率分别为(16/41,39.02%),(16/21,76.19%),(25/35,71.43%)。并且多重耐药菌株主要分布在植物乳杆菌(22/48,45.83%;24/57,42.11%)、凝结芽孢杆菌(10/48,20.83%;4/57,7.02%)、耐久肠球菌(7/48,14.58%;7/57,12.28%)和短乳杆菌(4/48,8.33%;6/57,10.53%)中。
2.4 乳酸菌菌株的生物被膜形成能力与耐药性之间的关系
生物被膜的产生使膜内菌对抗生素的耐药性比浮游菌增加10~1 000 倍,菌体一旦形成生物膜,即可表现出很高的耐药性,其机制[32]主要为:1)抗生素渗透障碍,一般的抗生素难以穿透生物被膜,它带有大量的阴离子而能通过氢键、共价键、范德华力吸附带有阳离子的抗菌药物,它还带有许多钝化酶、水解酶、过氧化氢酶而能灭活部分抗菌药物;2)生物膜内细菌代谢的毒素难以释放,氧气和营养物质少,恶劣的环境使细菌代谢缓慢,对抗生素的敏感性降低;3) 生物膜内细菌特殊的基因表达方式,可使耐药基因表达增加。
为探讨生物被膜产生能力与菌株耐药性之间的关系,测定了97 株乳酸菌产生物被膜的能力,如图6所示,MTP 定量测定方法将菌株产生物被膜的能力分为强(18 株)、适中(27 株)、较弱(17株)、不产(35 株)4 个等级,共有62 株菌的测定结果为阳性。图7显示产生物被膜和不产生物被膜菌株间的多重耐药性的比较情况,相比不产生物被膜的菌(Res≥6 和Res≥10 的菌株数分别为12和0),产生物被膜的菌株呈现出更强的多重耐药性 (Res≥6 和Res≥10 的菌株数分别为36 和12)。谢丽斯等[31]通过研究发酵食品中乳酸菌的生物被膜介导耐药研究中也得到相似的结论,证明32 株乳酸菌具有不同的生物成膜能力,且成膜后的乳酸菌抗生素耐药性增强。生物被膜的形成过程、机理非常复杂,由众多基因调控。为有效预防、解决所面临的公共食品安全问题,今后不仅要对食品中分离菌株的耐药基因进行实时监控,还要对生物被膜的表型、基因型及其调控机制进行深入研究。
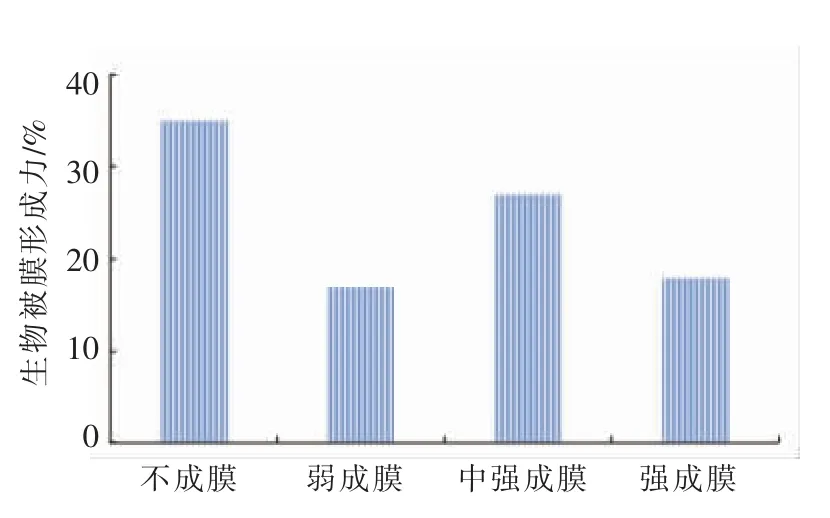
图6 97 株乳酸菌生物被膜形成能力Fig.6 The ability of biofilm production among 97 LAB isolates

图7 产生物被膜和不产生物被膜乳酸菌菌株间的多重耐药性的比较Fig.7 Multiple drug resistance among MTP + and MTP- LAB strains
3 结论
本文对我国传统发酵食品,主要分析研究了醋醅、泡菜和发酵乳制品中乳酸菌的耐药表型和基因型。结果表明,所分离的97 株乳酸菌对所有测试抗生素均呈不同程度的耐药性,其中对万古霉素、庆大霉素、卡那霉素、链霉素、四环素和替考拉宁的耐药性较强。携带最多的耐药基因是tetM(91.75%)和ermB(86.60%)基因,其次为aac(6′)-aph(2″)(53.61%),lnuA(45.36%),tetK(39.18%),ermC(36.08%),strA(34.02%)和blaZ(32.99%)基因。具有产生物被膜能力的菌株的多重耐药性显著高于不产生物被膜的菌株。研究显示,传统发酵食品中菌株的耐药性已成为食品安全的重要隐患,今后需加强耐药检测、追溯、监督、管理和控制。
