薄荷油的β-环糊精包合物的制备、表征及性能研究
2020-07-23范光龙
范光龙
(烟台市北海医院,山东烟台265700)
0 引言
薄荷油具有多种药理功能,能够消炎镇痛、止痒安神,可用于风热感冒、风湿初起、头痛、目赤、喉痹、咽喉肿痛、口舌生疮、牙痛等病症[1-4]。其常温下易挥发,可溶于乙醇和大多数有机溶剂,但几乎不溶于水,遇光和热不稳定。β-环糊精(β-CD)是一种理想的包合材料,采用β-CD 包合后可形成稳定的包合物,增加薄荷油的稳定性,降低其挥发性,减少刺激,降低毒副作用,在掩盖药物味道等方面有良好效果[4-7]。且β-CD 包合物与纤维复合制备成的药物功能织物可在体表缓释药效[8-9]。
在溶液法制备β-CD 包合物过程中,采用适量的无水乙醇溶解薄荷油可使其分散得更加均匀,便于β-CD 与薄荷油的相互作用[10-11]。本实验采用饱和溶液法制备薄荷油的β-CD 包合物,通过差示扫描量热法(differential scanning calorimetry,DSC)、热重分析法(thermogravimetric analysis,TGA)、扫描电子显微镜(scanning electron microscope,SEM)及傅里叶变换红外吸收光谱仪(Fourier transform infrared spectrometer,FTIR)分析产物,以证实该产物即是包合物。另外,采用粒度分析法分析生成的包合物是否达到制备功能纺织品的粒径要求,并测试包合物的热稳定性能、溶解速率及附载后的缓释性能。
1 实验
1.1 实验试剂
β-CD(生化试剂BR,天津市科密欧化学试剂有限公司);薄荷油(吉安市恒诚天然香料油提炼厂,批号:20180916);无水乙醇(分析纯,天津市江天化工技术有限公司);对-二甲基苯甲醛(分析纯,天津市天新精细化工开发中心);浓硫酸(分析纯,广州市东红化工厂)。
1.2 实验仪器
BME-10L-E 高剪切混合乳化机(上海环保设备总厂,新瑞机电有限公司);JB50-D 型增力电动搅拌器(上海标本模型厂);HH-S 型水浴锅(巩义市予华仪器有限责任公司);VIS-7220 紫外可见分光光度计(北京瑞利分析仪器公司);DT2100 型分析天平(北京光学仪器厂);DL-1G1-1 电热鼓风干燥机(天津市中环实验电炉有限公司);SHZ-DⅢ循环水真空泵(巩义市予华仪器有限责任公司);CQX-25-06 超声波清洗器(上海必能信超声有限公司);TL80-1 型医用离心机(姜堰市天力医疗器械有限公司)。
1.3 实验方法
1.3.1 包合物的制备
制备薄荷油的β-CD 包合物的方法主要有匀质法、饱和溶液法、研磨法及超声法[8,11]等,其中饱和溶液法制得的包合物包埋效率较高,且重复性好、操作简单。本实验采用饱和溶液法制备薄荷油的β-CD 包合物,有助于提高实验效率及结果的稳定性。具体方法为:称取10 g β-CD 加入100 ml 乙醇水溶液(乙醇∶水为1∶3)中搅拌,保持40 ℃恒温。将2 g 薄荷油溶于无水乙醇中制成体积分数为10%的薄荷油乙醇溶液,待β-CD 完全溶解后缓缓加入,以5 000 r/min 均质乳化5 min。40 ℃下水浴搅拌2 h,冰浴搅拌冷却,静置冷藏20 h,过滤洗涤后置于40 ℃烘箱内干燥1 h。
1.3.2 样品薄荷油含量的测定
精确量取0.1 mg 薄荷油溶液,用去离子水定容于200 ml 容量瓶,摇匀后取2、4、6、8 和10 ml 溶液至50 ml 容量瓶中定容,在439.5 nm 处测定吸光度。以浓度(X)为横坐标、吸光度(Y)为纵坐标,绘制标准曲线,得到线性回归方程Y=0.000 8+0.002 35X,r=0.998 72。
精确称取包合物20 mg 于容量瓶中,加入20 ml去离子水,水浴超声处理30 min,离心10 min 后取5 ml 上清液定容至10 ml 容量瓶,在439.5 nm 处测定其吸光值,代入线性回归方程,计算包合物中薄荷油的含量。再根据公式(1)、(2)计算包合物含油量及薄荷油包埋效率:

1.3.3 包合物的物相鉴定及质量评价
1.3.3.1 DSC 分析
采用德国NETZSCH DSC 200 F3 Maia 差示扫描量热仪对薄荷油、β-CD、β-CD 与薄荷油的混合物、薄荷油的β-CD 包合物4 种样品进行分析:以空坩锅为参比,准确称取微量样品于另一坩锅,升温范围为25~350 ℃(薄荷油为25~120 ℃),升温速率10 ℃/min,气氛为N2。
1.3.3.2 TGA 分析
采用德国NETZSCH STA 409 PC/PG 热分析仪对薄荷油、β-CD、薄荷油与β-CD 的混合物及薄荷油的β-CD 包合物进行分析,称取适量包合物(约30 mg)置于热重仪器的样品池中,气氛为N2,流量为20 cm3/min,升温速率为10 ℃/min,在室温至1 000 ℃的温度范围内进行热重分析。
1.3.3.3 包合物形态观察
采用日本OLYMPUS BX51 型研究级显微镜及捷克FEI Quanta 200 型扫描电子显微镜观察包合物的形态。
1.3.3.4 FTIR 分析
采用FTIR 分析薄荷油、β-CD、β-CD 与薄荷油的混合物、薄荷油的β-CD 包合物4 种样品,并进行比较。
1.3.3.5 粒度分析
采用日本Horiba la-300 颗粒粒度分布分析仪分析反应结束后的包合乳液,绘制包合物的粒度分析图。
1.3.4 热稳定性
分别称取包合物及β-CD 与一定比例的薄荷油混合物(薄荷油体积∶β-CD 质量为1∶4)置于培养皿中加盖,并置于60 ℃的烘箱中,分别于0、1、2、3、4、5、7、9 d 时从中取样品20 mg,按1.3.2 章节测试样品中薄荷油的剩余含量,并以每20 mg 样品中薄荷油的剩余含量列表分析。
1.3.5 包合物的释放测定
按2005 年版《中国药典》附录“溶出度测定法”第二法(浆法)[1],测试薄荷油的β-CD 包合物中薄荷油的释放度:量取100 ml 去离子水作为溶出介质,取0.1 g 薄荷油的β-CD 包合物同溶出介质共同置于250 ml 具塞三口烧瓶中,保持(37±0.5)℃,转速100 r/min,即刻开始计时。分别在5、10、15、20、30、40、55、70、85、100、130、160 min 时从中吸取溶出液1 ml,置于10 ml 试管中同时补充等量的溶出介质,在439.5 nm 处测定吸取液的吸光值,并计算其累计释放度。
1.3.6 包合物在附载纤维中的释放测定
在5%的海藻酸钠[12]纺丝原液中分别添加质量分数为5%、10%的包合物,成纤过程中包合物均匀地分布于纤维中制得载药纤维,并测试其释放度:分别称取原液质量分数为5%、10%的载药纤维0.1 g置于250 ml 具塞三口烧瓶中,即刻开始计时。分别在5、10、15、20、30、40、55、70、85、100、130、160 min时从中吸取溶出液1 ml,置于10 ml 试管中同时补充等量的溶出介质,在439.5 nm 处测定吸取液的吸光值,并计算其累计释放度。
2 结果
2.1 包合物的物相鉴定及质量评价
2.1.1 包合物含油量及挥发油的包埋效率
本实验在乙醇∶水为1∶3、β-CD∶薄荷油为5∶1、40 ℃、5 000 r/min 条件下制得薄荷油的β-CD 包合物,测得其含油量为13.6%,薄荷油包埋效率为77.5%,证明了制备工艺的可行性。
2.1.2 包合物的TGA 分析结果
4 种样品的TGA 曲线如图1 所示。由图1 可知,薄荷油在不到100 ℃时就开始挥发,在100~200 ℃出现了显著失重;而β-CD 在35~130 ℃有微小的失重,对应了吸附水与结晶水的失去,在此之后至300 ℃左右,TGA 曲线较为平稳;薄荷油与β-CD 的混合物中薄荷油在130 ℃之前已基本挥发殆尽,之后与β-CD 的TGA 曲线基本一致;薄荷油的β-CD 包合物在280 ℃处开始出现明显失重,这是被包合的薄荷油从β-CD 空腔中释放所致。由此可见薄荷油与β-CD 之间确实形成了包合物,在被包合后,其热稳定性有了显著提升。
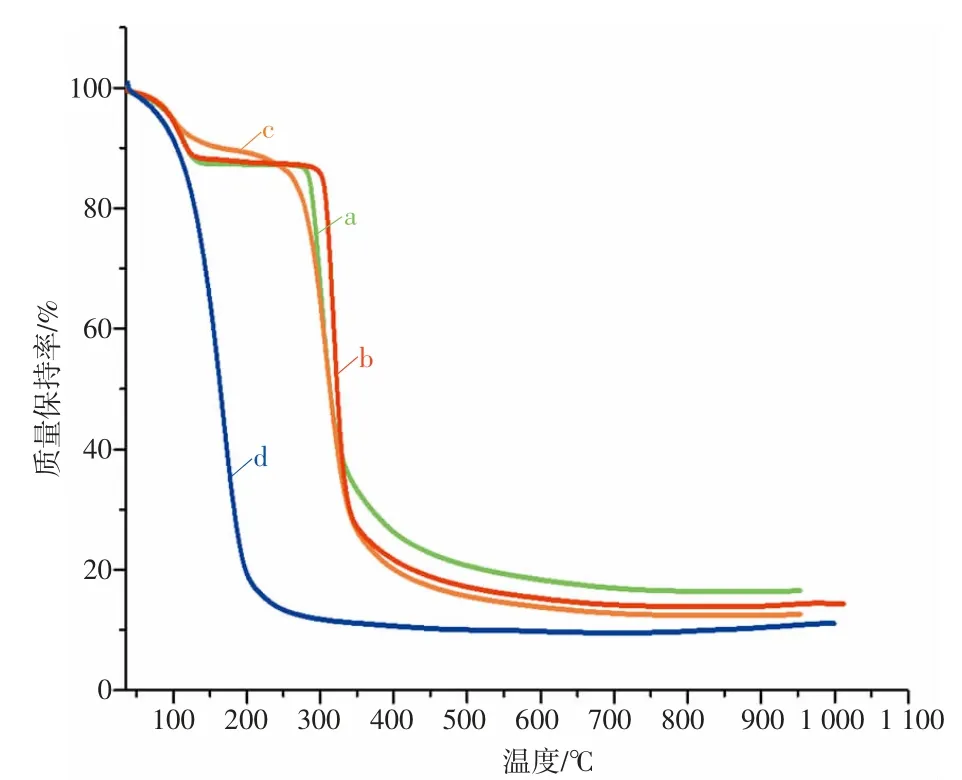
图1 4 种样品的TGA 曲线
2.1.3 包合物的DSC 分析结果
4 种样品的DSC 曲线如图2 所示。β-CD 在115.1 及221.6 ℃处出现吸收峰;β-CD 与薄荷油的混合物在105.5 及222.2 ℃处出现吸收峰;薄荷油的β-CD 包合物在82.5 和300 ℃左右出现2 处吸收峰。可以看出β-CD、薄荷油与β-CD 的混合物的DSC 曲线相似,β-CD 在115.1 ℃的吸收峰为脱水峰,混合物中薄荷油的吸热使β-CD 的特征峰迁移至105.5 ℃,这是因为混合物中薄荷油仅附着于β-CD 的表面,未能进入其空腔中。而薄荷油的β-CD包合物图谱在250 ℃后差别很大,这是由于薄荷油已进入β-CD 的空腔,稳定性提高,证明薄荷油与β-CD 的包合物已经形成。
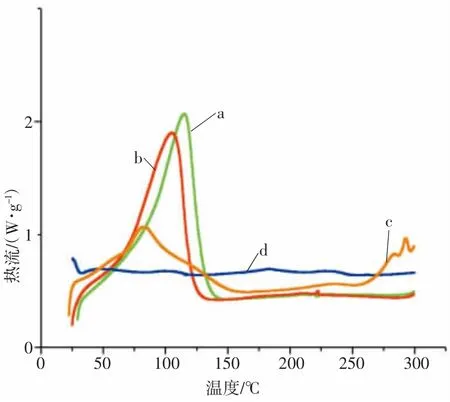
图2 4 种样品的DSC 曲线
2.1.4 包合物形态
薄荷油的β-CD 包合物表面无薄荷味,将微粉润湿于水中呈均匀分散的微细晶粒,置于光学显微镜下观察没有明显板块结晶或油状物。β-CD 微粉、薄荷油的β-CD 包合物微粉的SEM 图像如图3 所示。从图中可以看出,包合物微粉形态为菱形结晶,而β-CD 微粉呈不规则结晶且粒径较大,二者存在明显差异,这是因为薄荷油与β-CD 形成了包合物,晶格排列发生变化所致,与TGA 分析结果一致。

图3 β-CD 微粉及薄荷油的β-CD 包合物微粉的SEM 图像
2.1.5 FTIR 分析
薄荷油、β-CD、β-CD 与薄荷油的混合物、薄荷油的β-CD 包合物的FTIR 谱图如图4 所示。比较包合物形成前后1 000~2 000 cm-1红外区间透射峰的变化发现,包合物与混合物有较大差异,混合物中薄荷油在1 709.39、1 454.24、1 373.23 cm-13 处的特征峰在形成包合物后消失,包合物在1 000~1 300 cm-1C-H 基团伸缩振动峰有明显差异,进一步证明经过包合后薄荷油已进入β-CD 的空腔。

图4 4 种样品的FTIR 谱图
2.1.6 粒度分析
乙醇∶水为1∶3、β-CD∶薄荷油为5∶1、温度50 ℃、4 000 r/min 条件下反应结束后的包合乳液的粒度分布如图5 所示。由图5 可知,包合乳液中值粒径为2.9 μm,线性平均粒径为4.1 μm。薄荷油的β-CD 包合物中值粒径在3 μm 左右,粒径在5 μm 以下占至75%左右,10 μm 以下为95%左右,粒径分布良好。
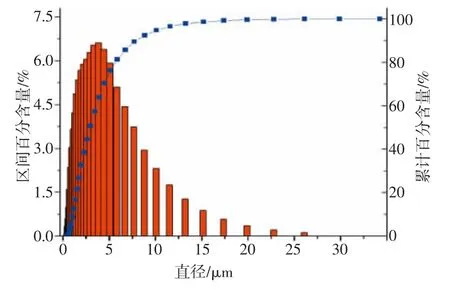
图5 薄荷油的β-CD 包合物的粒度分析
2.2 热稳定性
从表1 可以看出,混合物中的薄荷油在60 ℃下9 d 内基本上挥发殆尽,而包合后的薄荷油在此期间虽有挥发,但损失量较少。由此可知,经包合后的薄荷油相比混合物的热稳定性明显提高,因此薄荷油的β-CD 包合物的热稳定性较为优良,贮藏性能良好。
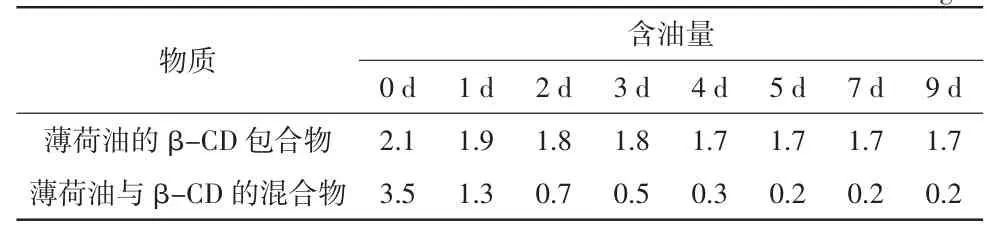
表1 包合物及β-CD 与薄荷油的混合物中薄荷油的热稳定性mg
2.3 包合物的释放测定
如图6 所示,以包合物中包埋的薄荷油含量为100%,并以薄荷油释放度为标准,薄荷油的β-CD包合物的最终释放度达到了95%以上,20 min 内薄荷油的β-CD 包合物的释放率超过了80%,能够取得较好的效果。与薄荷油难溶于水相比,采用β-CD包合可显著提高薄荷油的释放效率,这是由于β-CD 具备较高的溶解度、润湿性和包合能力。Loftsson等[13]研究发现,在包合物水溶液中,药物处于包合络合物、非包合络合物共存的平衡状态中。在这种平衡状态中,药物的溶解度得到显著提高。

图6 薄荷油及其β-CD 包合物释放曲线
2.4 包合物在附载纤维中的释放测定
包合物属于难溶性物质,在水中存在解离平衡,溶于纺丝原液时由于β-CD 空腔中的薄荷油分子与原液水分子发生竞争作用,部分会从中解离释放,造成一定量的损失。从图7 的释放数据中可知,在包合物含量较少时,释放度较大,当含量较多超出其离解平衡时会抑制薄荷油的释放,因此其释放度以最终释放量为100%计。从海藻酸钠纤维溶液释放曲线中可见,随着包合物含量的增多,溶出液中药物的最终释放度也相应增加,在1 h 内基本上能达到80%以上。相比胶囊或包合物在溶液中的直接溶出过程,包合物添加至纤维内其薄荷油的释放减缓,显著延缓了释放程度,具有较为良好的缓释效果。
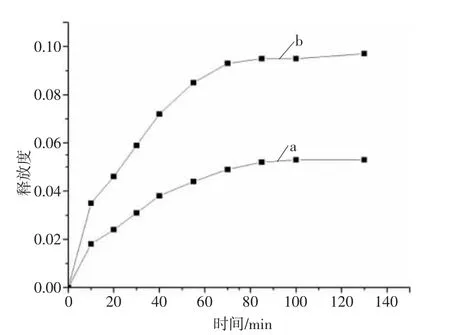
图7 附载薄荷油的β-CD 包合物的海藻酸钠纤维释放曲线
3 结语
饱和溶液法制得的薄荷油的β-CD 包合物通过TGA 曲线、SEM 图像及FTIR 等表征方法可有效表征其生成,包合物的结构稳定且在水溶液中分散良好,形态多为菱形晶体,粒径多小于5 μm;包合物中的薄荷油经包埋后,其挥发性降低,热稳定性提高,具备良好的缓释性能,而在水溶液里包合物中的薄荷油释放速率较快,这是由于β-CD 具备较高的溶解度、润湿性和包合能力。将包合物附载至海藻酸钠纤维后,相比未附载前薄荷油的释放速率得以延缓,1 h 内的释放度可达到最终释放度的80%以上,药物释放量随着附载的薄荷油成比例变化。
本研究采用多种方法表征了薄荷油的β-CD 包合物的生成,但在将包合物附载至海藻酸钠纤维并进行缓释实验中,采用的方法及材料都较为单一,量化分析手段简单,准确性和科学性或有欠缺。为达到制备薄荷油包合物附载纤维织物的目的,后期应筛选部分适宜材料对包合物进行附载,进一步选取并论证附载纤维中薄荷油缓释的量化方法,设计科学方案用于确定更为适合包合物的附载材料及附载比例。
