利用酵母细胞对薄荷油进行微胶囊化的研究
2014-03-13程玉霞关鹏翔卢锦丽傅玉颖
程玉霞 程 丹 关鹏翔 卢锦丽 武 肖 傅玉颖
(浙江工商大学食品与生物工程学院,杭州 310012)
酵母细胞是球形或椭球形的单细胞生物,直径从几微米到20μm,安全无毒[1],来源广泛,生长繁殖迅速并且易于大规模培养[2],具有天然的真核细胞典型结构,其完整的细胞壁和细胞膜结构具有一定的强度和通透性,是理想的微胶囊壁材[3]。酵母细胞作为微胶囊壁材具有独特的优点[4]:在微胶囊制备过程中不需要或很少添加其他化学试剂,只需水、酵母细胞和活性芯物质高频度接触即可;对芯物质载荷能力可达70%以上,非常适合药物和食品添加剂的包覆;具有天然的双层囊腔结构[5],可以避免挥发性物质的挥发,也可以避免光照、氧气所引起的氧化变质;获得的微囊产品大小均一、无毒、生物相容性好、易生物降解。目前,酵母微胶囊化技术的应用范围包括食品、医药、化妆品、生物型农药、纺织品[4,6]、戒烟产品中封装尼古丁[7]和无碳复写纸等多个领域。
薄荷油是唇形科植物薄荷的新鲜茎叶经蒸馏、冷冻、部分脱脂加工得到的无色或淡黄色澄清芳香挥发油[8],它具有疏风散热、消炎镇痛、清利头目、止痒安神等功效,在国内外被广泛用于食品、保健品、医药、饮料、日用化工等领域[9]。薄荷油极易挥发,在常温下为液态,遇光和热不稳定,在加工中不耐高温,加工的稳定性与贮藏稳定性差,严重限制了其发展应用。
为了提高薄荷油在加工与贮存过程中的稳定性能,更好地发挥薄荷油的功效,本试验采用酵母细胞将薄荷油微胶囊化,使其从挥发性强的液态香料转变成粉末香料,主要运用BBD设计原理探讨研究了酵母微胶囊化薄荷油的工艺,并通过红外光谱观察来表征薄荷油微胶囊。
1 材料与方法
1.1 材料与仪器
啤酒干酵母:食品级,湖北安琪酵母股份有限公司,细胞内脂含量2.0%~2.5%;薄荷油:食品级,郑州蓝宇化工有限公司;尼罗蓝A:Nile Blue A,合肥博美生物科技有限责任公司;其他试剂均为分析纯。
D-1-50真空冷冻干燥机:北京博医康实验仪器有限公司;78HW-1数显恒温磁力搅拌器:杭州仪表电机有限公司;UV-3200PC紫外分光光度计:上海美谱达仪器有限公司;傅里叶红外光谱仪:美国Thermo公司;3K30高速冷冻离心机:德国Sigma公司。
1.2 试验方法
1.2.1 薄荷油微胶囊的制备
按一定芯壁比将薄荷油与活化后的酵母细胞混合,加水,置于恒温磁力搅拌器中搅拌一定时间,离心后倾出,真空抽滤回收未包入油,再用乙醇洗去酵母细胞表面残留的薄荷油。真空冷冻干燥24 h,得到薄荷油微胶囊。薄荷油被包埋在酵母细胞中。
工艺流程:酵母→活化→加入薄荷油和水→搅拌→离心→真空抽滤→清洗→冷冻干燥→微胶囊→包装→储存。
1.2.2 薄荷油微胶囊效果的评定
准确称取0.2 g微胶囊后加入20 mL无水乙醇,在60℃下超声波浸提80 min后过滤,采用紫外分光光度法测定薄荷油浓度。对薄荷油无水乙醇溶液,薄荷油微胶囊的乙醇抽取液及干酵母的乙醇抽提液(空白)在200~600 nm进行波谱扫描,发现薄荷油无水乙醇溶液及微胶囊的乙醇抽取液均在204 nm下有最大吸收峰,与文献报道一致[3],而干酵母的乙醇抽提液(空白)在204 nm处没有明显的吸收峰。得到薄荷油浓度和吸光度的线性方程y=1.039 8x-0.008 1,R2=0.998 8,式中:x为吸光度;y为浓度;R2为相关系数。
微胶囊化效果用包埋率来衡量,计算公式如下:
包埋率=酵母微胶囊中薄荷油质量/初始薄荷油总质量×100%
1.2.3 微胶囊制备工艺的优化
在考察了芯壁比、包埋温度、包埋时间、加水量等单因素包埋条件的基础上,以包埋温度、包埋时间、加水量3个因素作为自变量,以薄荷油包埋率为响应值,根据BBD(Box-Behnken design)试验设计原理,进行三因素三水平试验设计,采用Design Expert7.1.3软件处理数据,试验因素及水平。
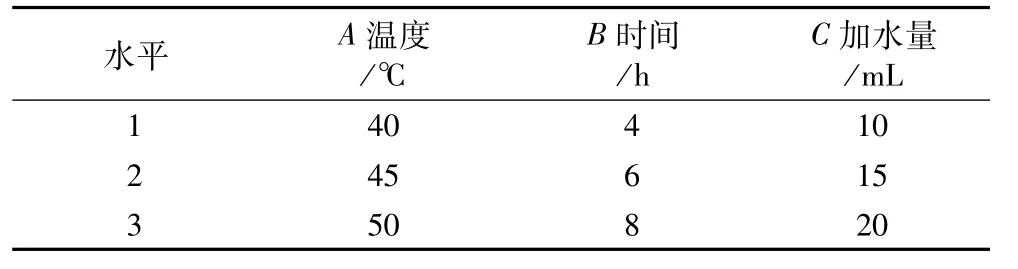
表1 试验因素与水平
1.2.4 傅里叶红外仪观察
采用溴化钾压片法。将酵母细胞、薄荷油微胶囊以及薄荷油与壁材的物理混合物分别与KBr按2∶200(质量)的比例混合、压片,在傅里叶红外光谱仪上测量透光率。压片时控制微胶囊和混合物中薄荷油的量一致。
2 结果与讨论
2.1 单因素对薄荷油包埋率的影响
2.1.1 芯壁比的影响
在包埋温度45℃,包埋时间5 h,加水量10 mL条件下,研究芯壁比为 1∶1、2∶1、3∶1、4∶1、5∶1对薄荷油包埋率的影响。结果如图1所示。

图1 芯壁比对薄荷油包埋率的影响
由图1可知,芯壁比对薄荷油包埋率的影响不大。当芯壁比小于2∶1时,薄荷油包埋率随芯壁比的增大而增大,当芯壁比为2∶1时,薄荷油包埋率达到最大值,当芯壁比大于2∶1时,薄荷油的包埋率反而随着芯壁比的增大而略有下降,但变化幅度不是很大。分析原因可能是由于薄荷油通过自由扩散进入酵母细胞[10],当芯壁比增大时,进入酵母细胞内薄荷油含量也相应增大。综合考虑选择芯壁比1∶1。
2.1.2 包埋温度的影响
在芯壁比为1∶1,包埋时间为5 h,加水量为10 mL的条件下,研究包埋温度为 35、40、45、50、55、60℃对薄荷油包埋率的影响。结果如图2所示。
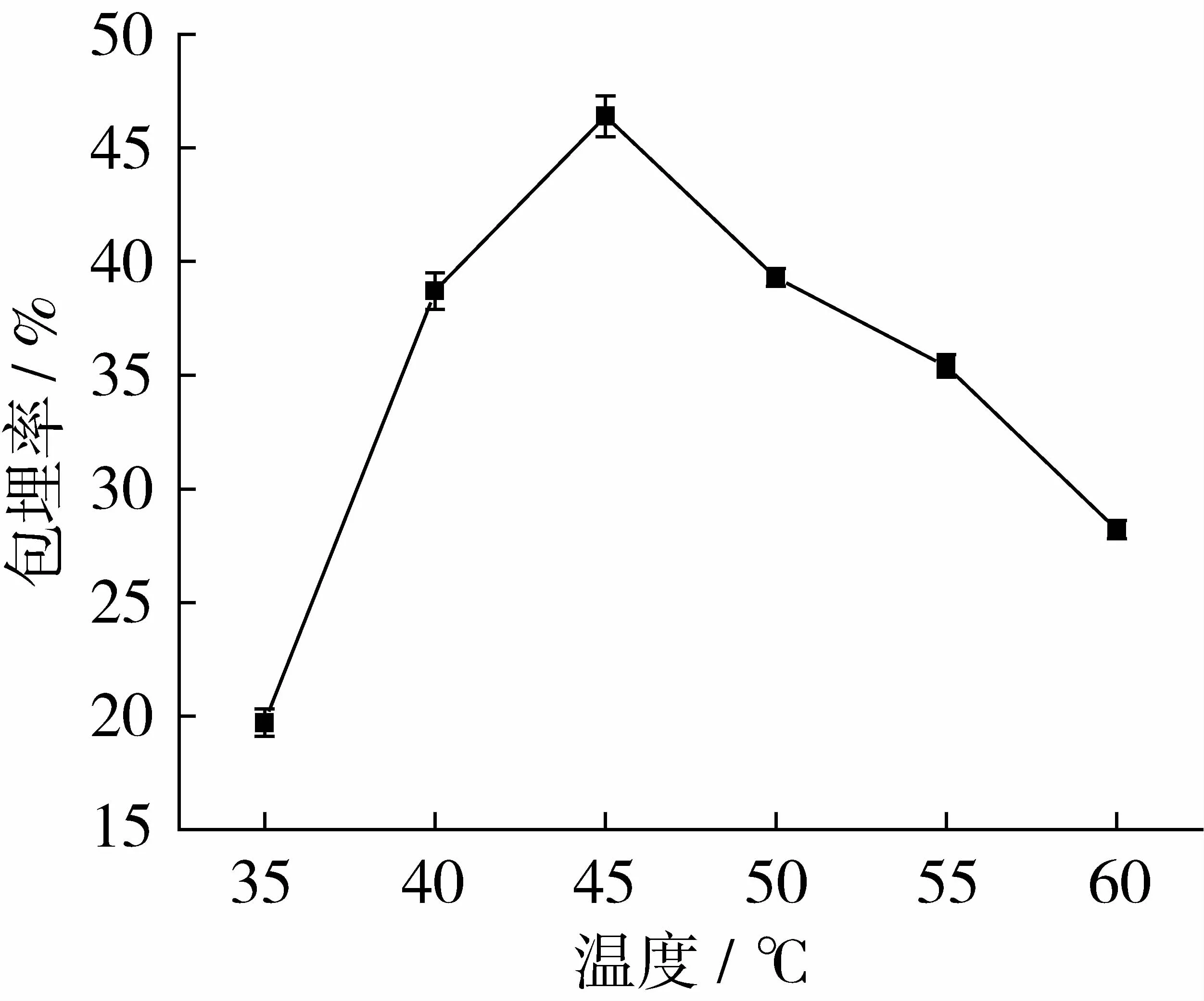
图2 包埋温度对薄荷油包埋率的影响
由图2可知,包埋温度对薄荷油的包埋率影响较大。当温度小于45℃时,薄荷油的包埋率随着温度的升高而不断增大;当温度达到45℃时,薄荷油包埋率达到最大;然而,当温度大于45℃时,随着温度的继续升高,薄荷油的包埋率反而不断减小。分析原因可能是酵母细胞通过自由扩散包埋薄荷油,温度升高会增大酵母细胞壁和细胞膜的通透性,加快分子运动速度,从而促使薄荷油向酵母细胞内扩散,提高薄荷油包埋率。但温度过高会加快薄荷油的氧化与蒸发,从而降低薄荷油包埋率。
2.1.3 包埋时间的影响
在芯壁比为1∶1,包埋温度为45℃,加水量为10 mL的条件下,研究包埋时间 3、4、5、6、7 h对薄荷油包埋率的影响。试验结果如图3所示。
由图3可知,包埋时间对薄荷油的包埋率影响较大。当包埋时间小于5 h时,随着时间的延长,薄荷油的包埋率不断增大;当时间延长到5 h时,薄荷油的包埋率达到最大,然而随着包埋时间的继续延长,薄荷油的包埋率反而不断下降。分析原因是:时间的延长使得通过自由扩散进入酵母细胞的薄荷油量增大,然而时间过长,薄荷油会容易蒸发和氧化,从而降低薄荷油包埋率。

图3 包埋时间对薄荷油包埋率的影响
2.1.4 加水量的影响
在芯壁比为1∶1,包埋温度为45℃,包埋时间为5 h的条件下,研究加水量为 5、10、15、20、25、30 mL/g对薄荷油包埋率的影响。试验结果如图4所示。
由图4可知,加水量对薄荷油的包埋率影响较大。当加水量小于15 mL/g时,随着加水量的增大,薄荷油的包埋率不断增大;当加水量达到15 mL/g时,薄荷油的包埋率达到最大;然而当加水量大于15 mL/g时,随着加水量的继续增大,薄荷油的包埋率反而不断减少。分析原因为:加水量是包埋进行的必要介质,加水量增加时会促进薄荷油进入酵母细胞内,然而由于薄荷油通过自由扩散的方式进入酵母细胞内,加水量过多会稀释薄荷油,导致进入酵母细胞的薄荷油量减少,从而引起薄荷油包埋率下降。
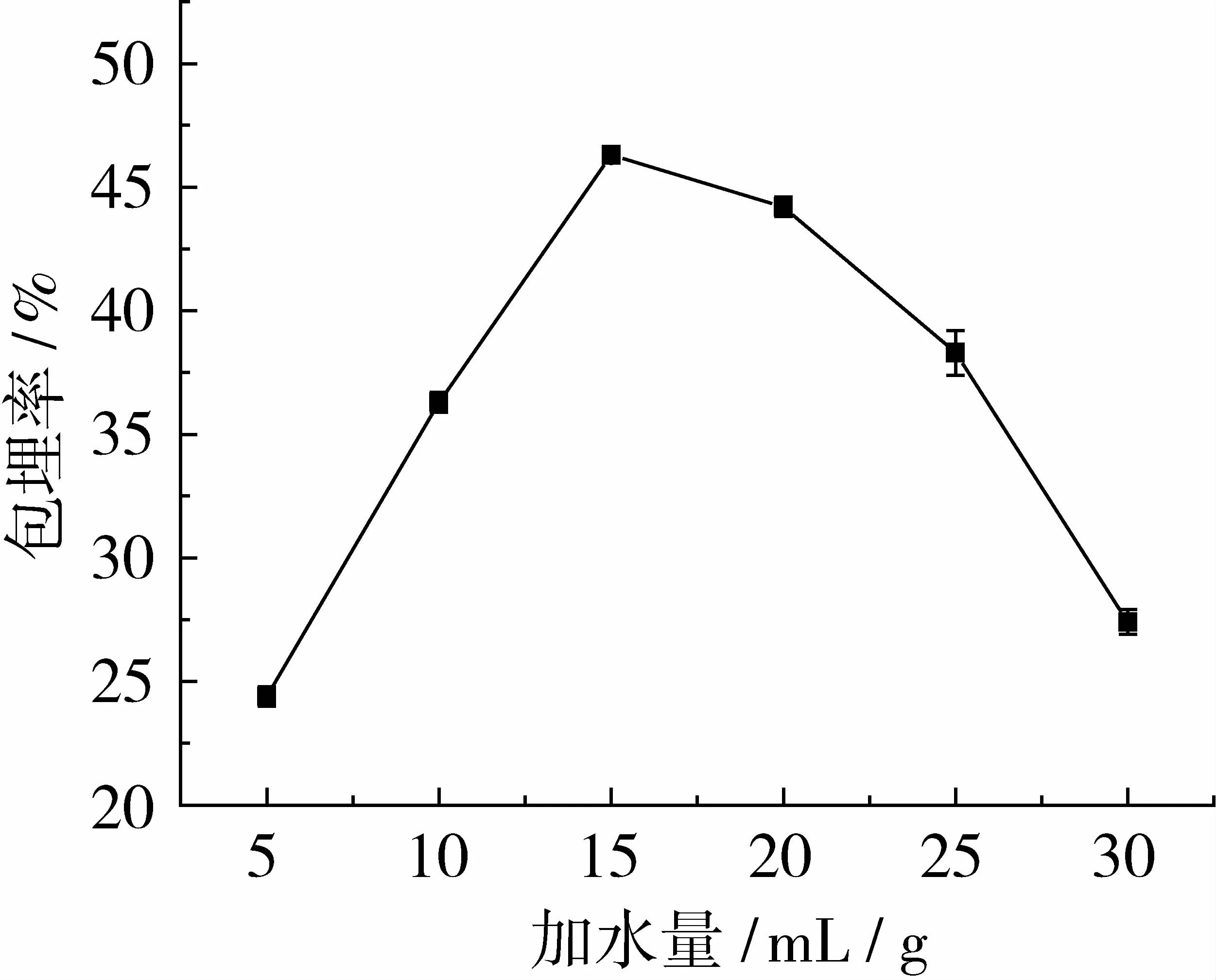
图4 加水量对薄荷油包埋率的影响
2.2 响应面试验结果及分析
根据Box-Behnken design(BBD)试验设计原理,选取15个试验点,以包埋温度、包埋时间、加水量3个因素作为自变量,以薄荷油包埋率为响应值,试验设计及结果见表2。

表2 响应面设计及结果
采用Design Expert 7.1.3软件对表2的数据进行多元回归分析,得到包埋率(Y)与温度(A)、时间(B)与时间(C)的二次回归方程:
Y=53.63+7.77A+3.13B-8.34C+2.06AB-0.51AC-4.27BC-8.315A2-20.33B2-6.07C2
回归方程系数显著性检验结果见表3,各因素及其交互作用对薄荷油包埋率的影响主次次序为B2>C>A>A2>C2>B>BC>AB>AC,各因素对试验结果的影响依次为时间>温度>加水量,建立的二次回归方程具有极显著性(P<0.000 1),失拟项0.187 8>0.05,不显著,说明该模型拟合程度好,试验误差小,可以用此模型对酵母微胶囊化薄荷油工艺进行分析和预测。

表3 回归方程系数显著性检验
图5~图7反应各因素之间交互作用对包埋率的影响,可知包埋温度和包埋时间、包埋时间和加水量的交互作用对包埋率影响显著,而包埋时间和加水量的交互作用对包埋率影响不显著;3个因素对包埋率的影响顺序依次为:时间>温度>加水量,与显著性分析结果一致。
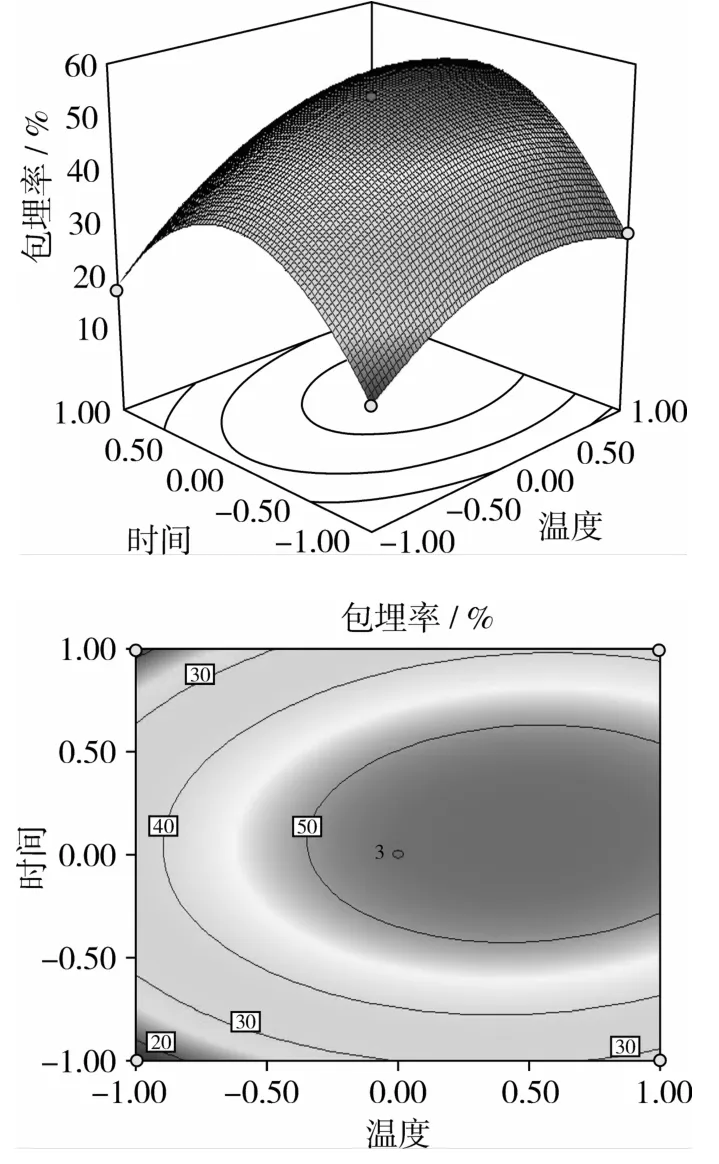
图5 温度和时间对薄荷油包埋率影响的交互作用

图6 温度和加水量对薄荷油包埋率的交互影响
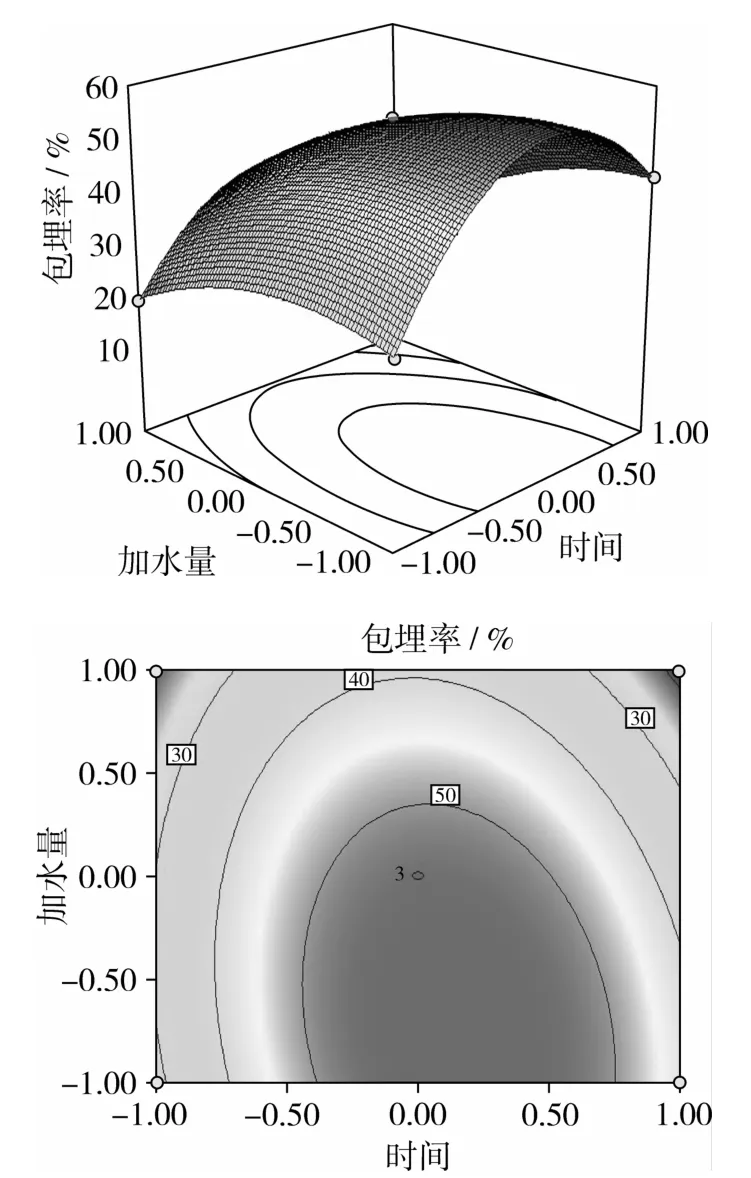
图7 时间和加水量对薄荷油包埋率的交互影响
2.3 最佳工艺条件及验证
由包埋率的回归方程得到酵母微胶囊化薄荷油的最佳工艺条件:温度为48.35℃,时间为6.56 h,加水量为13.15 mL/g,包埋率可达57.15%。采用上述最优条件进行试验,同时结合实际操作情况,将包埋率试验条件调整为:温度48℃,时间6 h,加水量13 mL,在此条件下进行3次验证试验,平均包埋率为57.33%,与预测值十分接近。由此可见,利用响应面法优化得到的酵母微胶囊化薄荷油工艺参数准确可靠。
2.4 傅里叶红外光谱试验
对酵母细胞、薄荷油微胶囊以及薄荷油与酵母细胞进行红外扫描,红外光谱图见图8。由图8可知,酵母细胞红外光谱曲线与文献报道非常相似[11]。薄荷油微胶囊与酵母细胞的红外光谱曲线无明显的差异,但与薄荷油和酵母混合物的红外曲线有明显差异,由此说明薄荷油已包埋在酵母中。
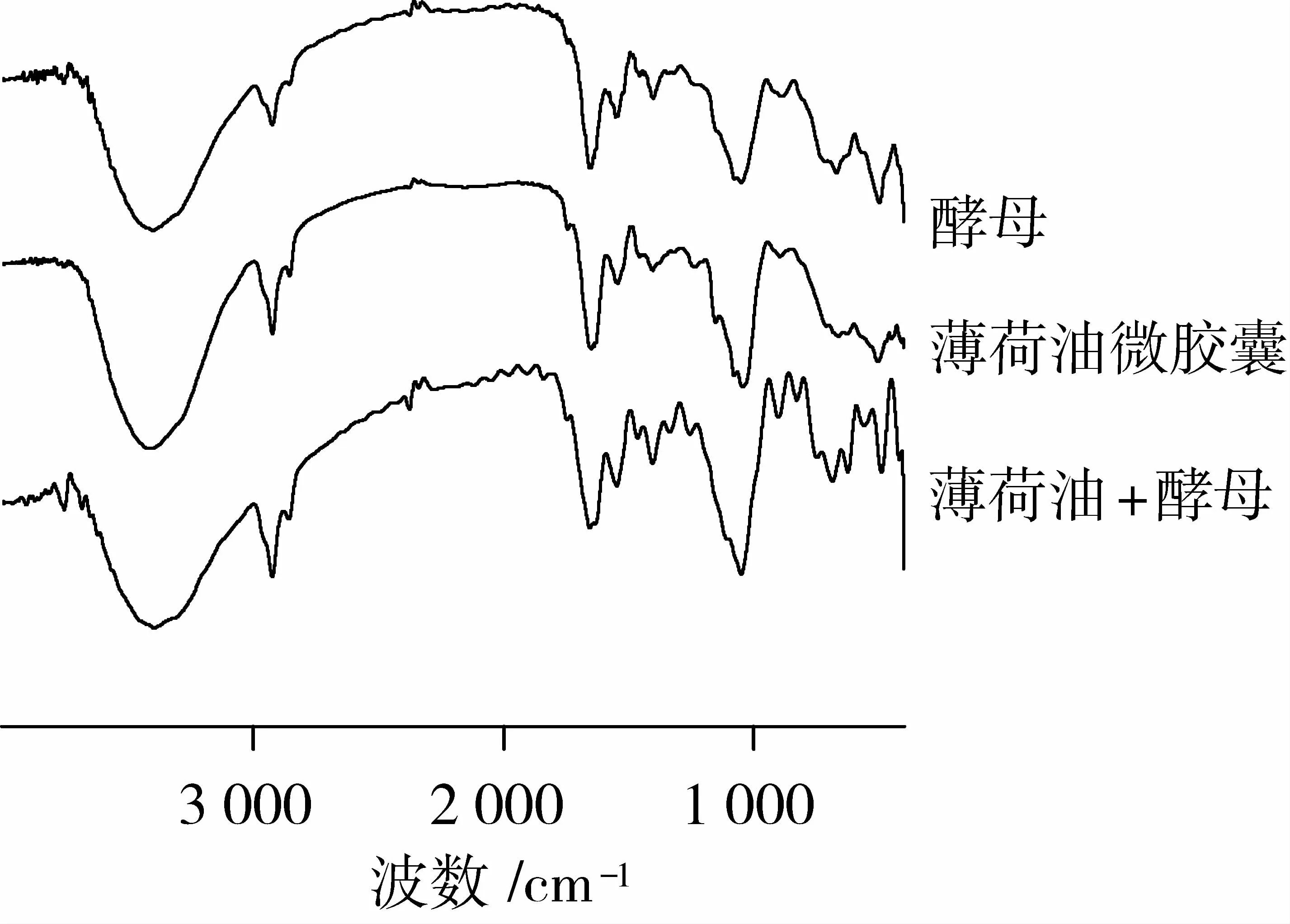
图8 酵母、微胶囊以及薄荷油与酵母混合物的红外光谱
3 结论
在单因素试验基础上,选定包埋温度、包埋时间和包埋温度为目标变量,采用BBD响应面法,以包埋率为响应值指标,建立二次项回归模型:Y=53.63+7.77A+3.13B-8.34C+2.06AB-0.51AC-4.27BC-8.315A2-20.33B2-6.07C2。所得模型方程(P<0.01)具有极显著性,失拟项(P>0.05)不显著,说明方程拟合程度良好。3个因素的主次关系为时间>温度>加水量。优化得到薄荷油的最佳微胶囊化条件为:温度48℃,时间6 h,加水量13 mL/g,薄荷油包埋率高达为57.33%。傅里叶红外光谱图中薄荷油微胶囊与酵母壁材的红外光谱曲线基本相同,表明薄荷油微胶囊薄荷油已被包入酵母壁材内。
[1]蒋和体,刘晓丽.酵母胞壁微胶囊化姜油及其释放规律的研究[J].中国粮油学报,2005,20(6):91-97
[2]Mitsuyoshi U,Atsuo T.Cell surface engineering of yeast:Construction of arming yeast with biocatalyst[J].Journal of Bioscience and Bioengineering,2000,90(2):125-136
[3]邹克琴,王金宇,李淑芬,等.利用干酵母细胞微胶囊化丁香油的研究[J].农业工程学报,2006,22(9):206-209
[4]Nelson G.Application ofmicroencapsulation in textiles[J].International Journal of Pharmaceutics,2002,242:55-62
[5]薛峰,黄晓青.微胶囊技术主要方法概论[J].食品科学,1990(11):5-8
[6]Sager B,Wales D,Nelson G.Treating Materials.International patentWO/010772[D].1992
[7]McNeight D L.Nicotine Delivery Systems.European patent EP1176961[D].2000
[8]中华人民共和国国家药典委员会.中华人民共和国药典[S].北京:化学工业出版社,1995
[9]李静茹,金征宇.可降解淀粉微球吸附薄荷油的研究[J].食品与生物技术学报,2006,25(5):25-34
[10]Bishop J.R.P,Nelson G.Microencapsulation in yeast cells[J].Journal of Microencapsulation,1998,15(6):761-773
[11]Burattini E,Cavanga M,Dell Anna R,et al.An FT-IR microspectroscopy study of autolysis in cells of the wine yeast Saccharomyces cerevisiae[J].Vibrational Spectroscopy,2008,47:139-147.
