重组大肠杆菌产乙酰乳酸合成酶发酵条件优化
2020-07-29赵婷黄礼清金紫阳袁思棋刘君
赵婷,黄礼清,金紫阳,袁思棋*,刘君,2,3*
1(四川轻化工大学 生物工程学院,四川 宜宾,644000)2(宜宾五粮液集团有限公司,四川 宜宾,644000) 3(四川大学 轻工科学与工程学院,四川 成都,610000)
双乙酰(diacetyl),又称2,3-丁二酮,是一种具有特殊气味的黄绿色油状液体,广泛存在于郁金香、草莓和薰衣草等天然植物内,以及奶油、奶酪、酸奶等乳制品中[1]。2分子丙酮酸在乙酰乳酸合酶(acetolactate synthase, ALS, EC 4.1.3.18)作用下产生1分子α-乙酰乳酸(α-acetolactate, α-AL),再经过非酶催化脱羧生成双乙酰[2-4]。双乙酰在工业应用广泛,例如,在奶油风味食品的生产过程中,主要通过添加化学工业生产的双乙酰作为食品添加剂,从而改善食品的风味。但是,化学工业生产双乙酰的过程一般需要涉及亚硝酸酯等有毒物质;另一方面,双乙酰具有很强的挥发性,一次性添加不能使食品的风味持续很久[5]。
在发酵过程中,能够表达α-乙酰乳酸合成酶的菌株(如乳酸乳球菌)的酶产量有限,不能满足当前食品市场非常巨大的需求[6-7]。因此,为了提高乳酸菌发酵过程中双乙酰的产量以及延长双乙酰风味的作用时间,更健康、安全的方法是添加乙酰乳酸合成酶酶制剂[5]。常用的工程菌自身组成性表达的乙酰乳酸脱羧酶会不可逆地催化α-乙酰乳酸生成乙偶姻,很大程度上降低了双乙酰的产率。研究报道,通过基因工程过表达α-AL编码基因或在天然产双乙酰的菌株中过表达α-AL编码基因,增加双乙酰合成途径的通量,可以有效提高双乙酰的产率[1]。大肠杆菌不仅没有乙酰乳酸脱羧酶基因,不具有催化乙偶姻生成的能力,而且具有培养周期短、代谢易控制、营养要求粗放等许多优势,较适合作为双乙酰生产的工程菌[8-9]。
本实验室筛选得到1株高产乙酰乳酸合成酶的地衣芽孢杆菌T2,从T2中克隆获取乙酰乳酸合成酶基因alsS,构建重组质粒pEGX-6p-1-alsS,并转化到E.coliBL21(DE3)进行异源表达,并对重组alsS的发酵条件进行优化,获得重组目的基因的最佳表达条件,提高具有活性的乙酰乳酸合成酶产量。从而为后续酶降低酶制剂生产成本奠定基础,增强双乙酰的合成代谢流,使得利用微生物更安全、更环保地进行双乙酰生物合成生产[7,10-11]。
1 材料与方法
1.1 实验材料
1.1.1 菌株
E.coliBL21(DE3)/pEGX-6p-1-alsS,作者所在实验室构建并保存。
1.1.2 培养基
种子培养基为LB培养基(g/L):蛋白胨10,酵母浸粉5,NaCl 10;发酵基础培养基(g/L):葡萄糖5,酵母浸粉5,蛋白胨5,NaCl 5。使用250 mL摇瓶,装液量为50 mL。将上述基础培养基中碳源、氮源及无机盐替换成不同的成分以进行发酵培养基优化。
1.1.3 试剂
发酵培养基各成分,上海源叶生物技术有限公司;异丙基-β-D硫代半乳糖苷(isopropyl-β-D-thiogalactopyranoside,IPTG)、氨苄青霉素,购自生工生物工程股份(上海)有限公司。
1.1.4 仪器与设备
UV-1800分光光度计,翱艺仪器(上海)有限公司;SCIENTZ-ⅡD超声波破碎仪,宁波新芝生物科技股份有限公司。
1.2 实验方法
1.2.1 菌种活化
将甘油管保藏菌种接入LB培养基中,37 ℃、200 r/min过夜培养;按体积分数5%接入发酵(基础)培养基中,37 ℃、200 r/min继续培养至OD600为0.6~0.8时,加入0.2 mmol/L IPTG,于25 ℃诱导培养6 h。
1.2.2 重组大肠杆菌产乙酰乳酸合成酶的发酵条件优化
参照1.2.1的方法培养重组大肠杆菌,LB培养基中培养种子液,以体积分数2%接种量接入发酵(基础)培养基中,37 ℃、180 r/min继续培养至OD600为0.6~0.8时,加入1 mmol/L IPTG,于30 ℃诱导培养6 h。诱导培养结束后,4 ℃、8 000 r/min 离心5 min,以工程菌作为对照。
1.2.3 菌体吸光度分析
将所得菌悬液稀释适当倍数,UV-1800分光光度计测定其吸光值,如公式(1)所示:
OD600=读数×稀释倍数
(1)
1.2.4 菌体生物量的测定
为考察单位菌体产酶量参数,建立了OD600与菌体质量浓度(g/L)的线性关系。取相同体积不同浓度的菌体,测定其OD600后,8 000 r/min离心10 min,弃上清,用去离子水悬浮菌体,再离心,弃上清,将菌体放置于70 ℃烘干至恒重。
1.2.5 菌体破碎
诱导培养结束后,离心收集菌体,用7.5 mL K3PO4缓冲液(100 mmol/L,pH 6.0)悬浮菌体,使用超声波破碎仪处理10 min后置于 4 ℃、8 000 r/min、离心20 min,取上清液进行酶活测定。
1.2.6 重组蛋白质酶活力的测定
酶活测定:乙酰乳酸在一定温度条件下会脱羧形成乙偶姻,而乙偶姻在碱性条件下可以与肌酸和α-萘酚的混合物反应生成红色物质,在525 nm有吸光度[12]。反应体系为l mL 100 mmol/L磷酸钠缓冲液(pH 7.0),其中含40 mmol/L的丙酮酸钠,1 mmol/L MgCl2,1 mmol/L TPP,10 μmol/L FAD,37 ℃加入20 μL 酶液,10 min后加50 μL 3 mol/L H2SO4终止反应,37 ℃脱羧25 min,2 000 r/min离心1 min,上清稀释20倍后取200 μL加入1 mL 1.7 g/L肌酸和1 mL 17 g/L的α-萘酚,37 ℃显色 30 min,于525 nm处测定吸光度[13]。乙偶姻的标准曲线方程为:y=0.060 2x+0.095 5(R2=0.995 1),其中x为乙偶姻浓度(μmol/L),y为OD525值。酶活单位(IU)定义为在37 ℃条件下,1 min内催化生成 1 μmol/L乙偶姻所需的酶量。
1.2.7 单因素实验
1.2.7.1 碳源及质量浓度对重组大肠杆菌产乙酰乳酸合成酶的影响
根据已有文献[14]进行优化,分别以葡萄糖、甘油、蔗糖、可溶性淀粉、乳糖、麦芽糖(质量浓度均是5 g/L)为发酵培养基的碳源,以酵母浸粉5 g/L和蛋白胨10 g/L为发酵培养基的氮源,测定酶活力,确定最佳碳源。在最佳碳源的基础上,根据文献[10]选择添加量(质量浓度)4、6、8、10、12 g/L,确定最佳浓度。
1.2.7.2 氮源及质量浓度对重组大肠杆菌产乙酰乳酸合成酶的影响
在最佳碳源及浓度的基础上,分析氮源添加条件对菌体生长及产酶的影响:(1)仅添加无机氮源(NH4)2SO4和NH4Cl(各3 g/L);(2)仅添加有机氮源牛肉膏;(3)酵母膏;(4)蛋白胨及牛肉膏蛋白胨组合;(5)牛肉膏酵母膏组合;(6)酵母膏蛋白胨组合。根据以上结果,分别测定对应条件下酶活力,确定最佳氮源。在此基础上,根据文献资料[15]选择添加量5、10、15、20、25 g/L,确定最佳质量浓度。
1.2.7.3 无机盐离子及质量浓度对重组大肠杆菌产乙酰乳酸合成酶的影响
无机盐对微生物有非常重要的生理功能,可作为酶的激活剂或辅基,并且在维持渗透压、pH的稳定以及组成细胞物质等方面均有重要体现[16]。最佳碳源及氮源的种类和添加量确认后,以产酶水平为考察指标,使用正交实验设计对无机盐种类及浓度进行优化。选用4种常用的无机盐(柠檬酸钠、KH2PO4、MgSO4·7H2O、NaCl)对菌体生长及产乙酰乳酸合成酶的影响[15]。
1.2.8 重组大肠杆菌诱导表达条件优化
甘油管菌种接种于5 mL LB Amp+培养基37 ℃活化过夜, 将活化的菌种接种于LB Amp+培养基中,37 ℃、 200 r/min培养,分析以下不同发酵条件对工程菌生长和目标蛋白表达的影响[17-19]:(1)改变加入IPTG诱导剂的培养时间;(2)加入不同浓度的IPTG诱导剂;(3)改变加入IPTG诱导剂的培养温度;(4)改变接种量;(5)改变培养基的pH;(4)改变培养摇床的转速。
1.2.9 响应面Box-Behnken试验设计
基于单因素实验结果,选择对产酶水平影响较大的3个因素,通过 Box-Behnken 法设计出3因素(pH、温度、IPTG浓度)、3水平正交实验。pH的3水平分别为6、7和8;温度的3水平分别为25、 30、 37 ℃;IPTG浓度的3水平分别为0.2、 0.4、0.6 mmol/L(表1)。
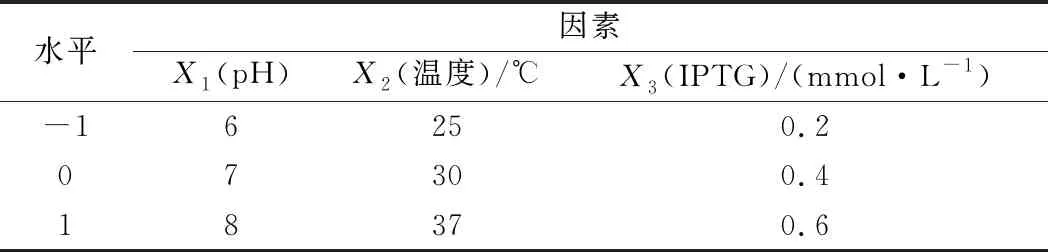
表1 基于 Box-Behnken 设计的 3 因素 3水平正交实验表Table 1 Design and protocol of the three-variable/three-level Box-Behnken method
2 结果与分析
2.1 菌体干重与OD600的线性关系
根据1.2.4实验方法处理,获得菌体干重(g/L)与OD600回归方程,y=0.376 7x-0.015 9(R2=0.999 3),其中x为OD600,y为菌体干重(g/L)。
2.2 发酵培养基的优化
2.2.1 碳源对菌体生长及产酶的影响
由表2可知,菌体质量浓度在6种不同碳源培养基中,淀粉最高,依次是甘油、蔗糖、葡萄糖和麦芽糖,乳糖最低。当葡萄糖作为碳源时,单位菌体产酶量及产酶水平均最高,其他碳源对应的单位菌体产酶量及产酶水平均低于葡萄糖。

表2 不同碳源对重组大肠杆菌菌体生长及产酶的影响Table 2 Effects of different carbon sources on the growth and enzyme production of recombinant E. coli
通过不同碳源影响因素的确定,随着不同葡萄糖添加质量浓度增加,单位菌体产酶量呈小幅度增加,而产酶水平呈明显增加趋势(图1),即当葡萄糖质量浓度为12 g/L时,单位菌体产酶量及产酶水平分别为112.990 kU/g和122.779 U/mL。

图1 不同葡萄糖质量浓度对乙酰乳酸合成酶活力的影响Fig.1 Effects of different glucose concentrations on acetolactate synthase activity
2.2.2 氮源对菌体生长及产酶的影响
重组大肠杆菌可以有效利用有机氮源和无机氮源。由表3可知,重组大肠杆菌对单一有机氮源的利用效率高于无机氮源,而混合的有机氮源利用效率较低。根据表3数据显示,(1)无机氮源NH4Cl的单位菌体产酶量和产酶水平明显比(NH4)2SO4高;(2)单一有机氮源中,蛋白胨对应的菌体质量浓度、单位菌体产酶量和产酶水平均高于牛肉膏和酵母膏;(3)混合有机氮源中,除单位菌体产酶量外,牛肉膏+酵母膏组合的菌体质量浓度和产酶水平均高于其他2种组合。综合考虑有机氮源和无机氮源实验数据和实验成本,最终确定本实验培养基仅需添加蛋白胨作为唯一氮源。
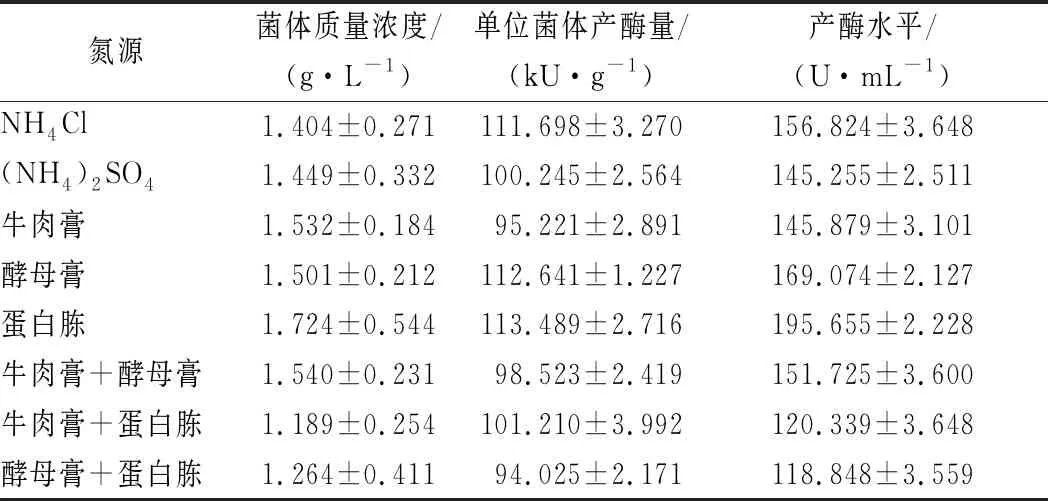
表3 不同氮源对重组大肠杆菌菌体生长及产酶的影响Table 3 Effects of different nitrogen sources on the growth and enzyme production of recombinant E. coli
在确认最佳氮源后,探讨不同质量浓度的蛋白胨对单位菌体产酶量及产酶水平的影响情况。结果显示,随着蛋白胨浓度的不断升高,大肠杆菌单位菌体产酶量及产酶水平先增加,后逐渐降低,即当蛋白胨质量浓度为10 g/L时,单位菌体产酶量及产酶水平均为最高(图2)。因此,确定蛋白胨10 g/L作为最佳蛋白胨添加量。
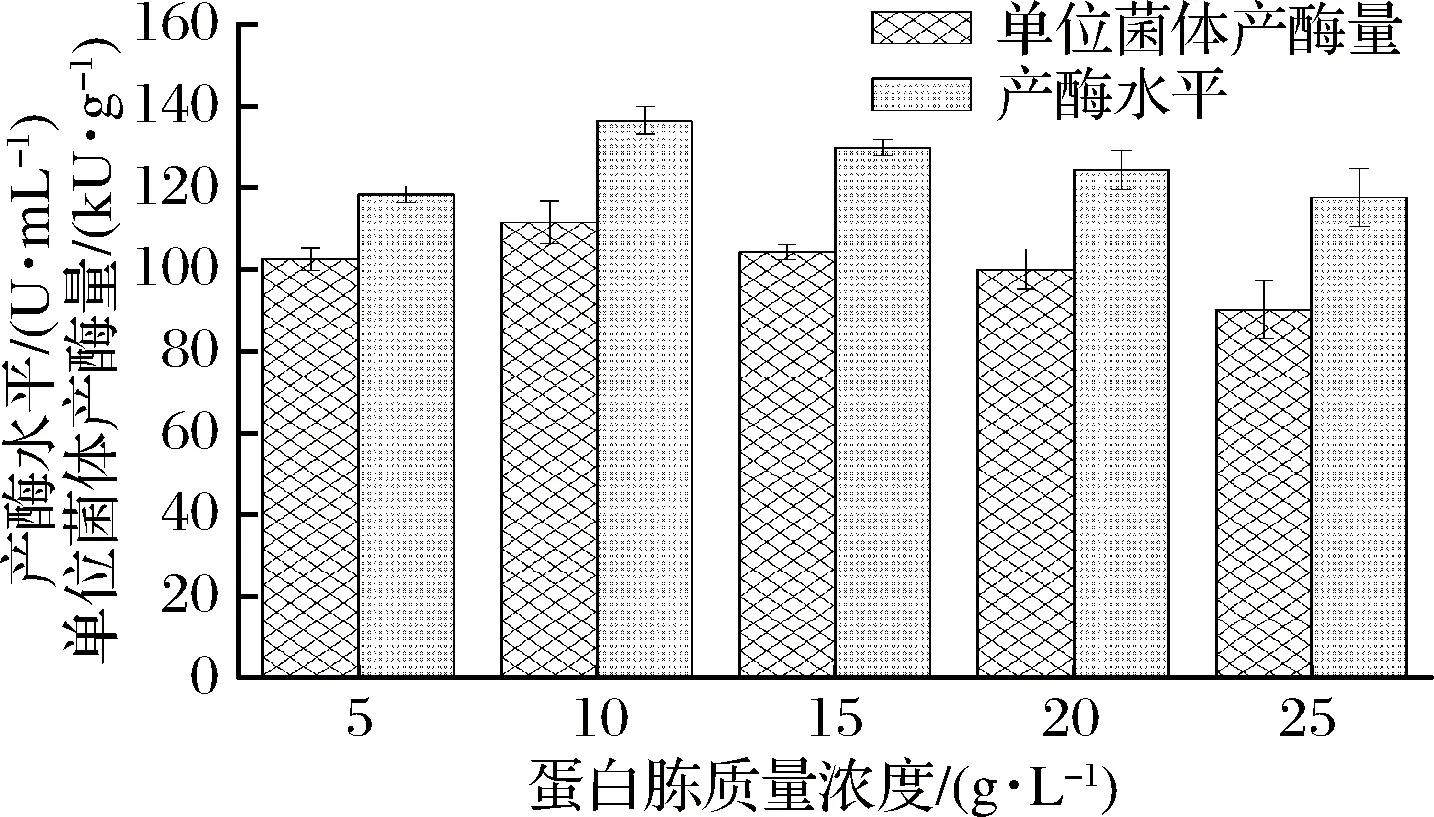
图2 不同蛋白胨浓度对乙酰乳酸合成酶活力的影响Fig.2 Effects of different glucose concentrations on acetolactate synthase activity
2.2.3 无机盐对菌体生长及产酶的影响
不同的无机盐离子对微生物的生长有不同的影响。由表4可知,柠檬酸钠对产酶的影响最显著(R值为50.3),其他无机盐依次为 NaCl(11.59),KH2PO4(11.16),MgSO4·7H2O(8.21),其中MgSO4·7H2O对产酶的影响最小。柠檬酸是三羟酸循环的关键物质,推测柠檬酸钠的添加可以为细胞生长提供能量,也可促进细胞的产酶。细胞干重随柠檬酸钠质量浓度的增大而增大,产酶水平及单位菌体产酶量也逐渐提高。根据不同无机盐离子的正交实验,最优组合为A3B2C1D3,即柠檬酸钠0.25 g/L, KH2PO40.1 g/L,MgSO4·7H2O 0.025 g/L,NaCl 0.1 g/L。

表4 无机盐优化正交实验与结果Table 4 Orthogonal experiments and results of inorganic salt optimization
2.3 诱导条件的优化
2.3.1 接种量、pH和培养转速的优化
由图3可知,随着接种量、培养基pH值和摇床转速的增加,重组大肠杆菌单位菌体产酶量和产酶水平均呈现先增加,后降低的趋势,即在接种量0.04%、pH=7和摇床转速180 r/min时,对应的单位菌体产酶量和产酶水平达到最高。
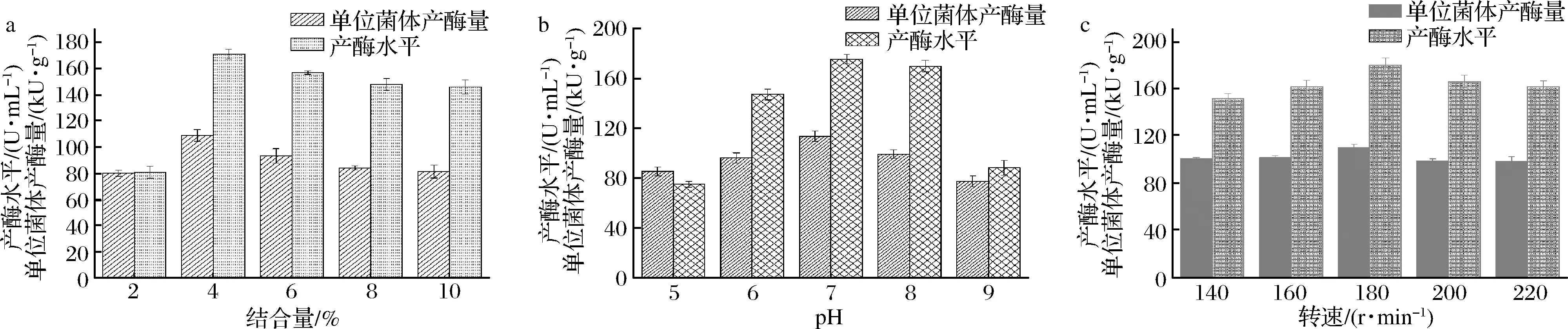
a-接种量;b-pH;c-培养转速图3 接种量、pH和培养转速对单位菌体产酶量和产酶水平的影响Fig.3 Effects of inoculation , pH and culture rotation speed on the enzyme production per unit and production level of recombinant E. coli
2.3.2 诱导温度的优化
根据实验用大肠杆菌的培养温度情况,选择18、25、30、37 ℃ 4个诱导温度进行优化实验,结果表明,随着温度的升高,单位菌体产酶量和产酶水平呈现先增加后降低的趋势,即当诱导温度为30 ℃时,单位菌体产酶量与产酶水平均最高(图4)。因此,最终选定30 ℃为最适诱导温度。
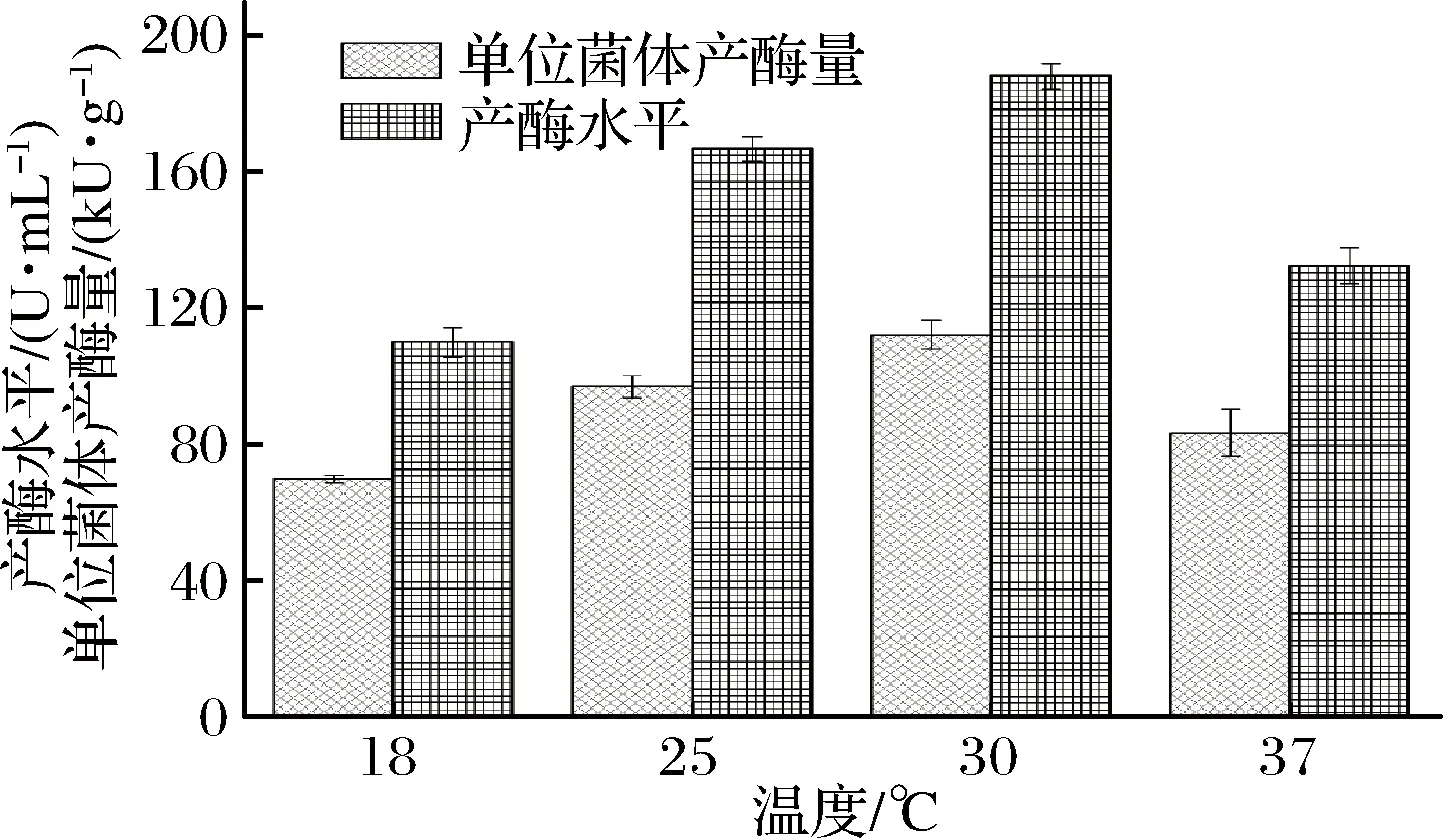
图4 诱导温度对单位菌体产酶量和产酶水平的影响Fig.4 Effects of induced temperature on the enzyme production per unit and production level of recombinant E. coli
2.3.3 诱导剂 IPTG 浓度的优化
在重组大肠杆菌菌株生长过程中,添加诱导剂IPTG促进菌体中基因表达。根据先前实验室重组菌株的实验,选择IPTG浓度分别为 0.2、0.4、0.6、0.8 mmol/L进行诱导实验,由图5可知,随着诱导剂IPTG浓度的增加,单位菌体产酶量和产酶水平呈先增加后减少的趋势;当IPTG浓度为 0.4 mmol/L时,产酶水平最高,达到314.724 U/mL。因此,最终确定诱导剂IPTG的最佳浓度为0.4 mmol/L。

图5 不同浓度的诱导剂IPTG对单位菌体产酶量和产酶水平的影响Fig.5 Effects of different IPTG concentration on the enzyme production per unit and production level of recombinant E. coli
2.3.4 诱导时间的优化
本次实验的重组大肠杆菌菌株的最佳诱导表达时间以9 h为诱导时间中间值,分别设置5个时间梯度,由图6可知,随着诱导时间的不断延长,单位菌体产酶量和产酶水平在诱导2~10 h均呈现增长趋势,10 h后均呈现下降趋势。因此以10 h诱导时间作为最佳诱导表达时间。

图6 不同诱导时间对单位菌体产酶量和产酶水平的影响Fig.6 Effects of induced time on the enzymic production per unit and production level of recombinant E. coli
2.4 响应面优化重组大肠杆菌产乙酰乳酸合成酶
2.4.1 回归模型的建立和方差分析

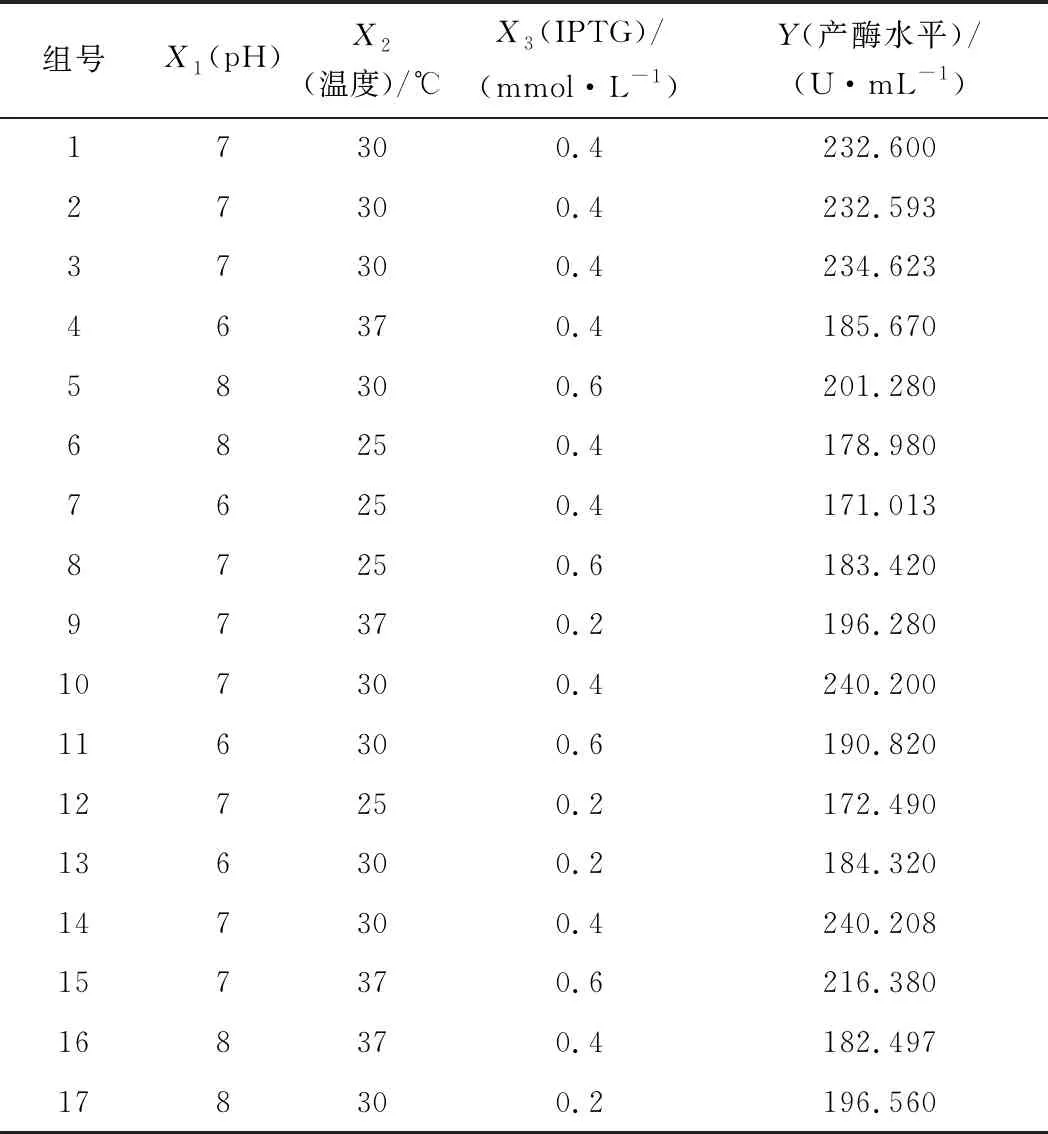
表5 响应面试验设计Table 5 Results of response surface design and corresponding analysis
从分析软件Box-Behnken 程序拟合获得的交互二次回归方程F检验和失拟检验(表6),模型P= 0.000 2 < 0.01(极显著),说明模型呈现极显著;失拟项P= 0.057 > 0.05(不显著),说明该模型与试验拟合程度好,误差较小,可以用此模型进行乙酰乳酸合成酶的产酶水平分析和预测。从各个因素显著性水平差异可知,对乙酰乳酸合成酶的产酶水平影响顺序依次为IPTG浓度>pH>温度,特别是IPTG浓度对乙酰乳酸合成酶的产酶水平影响达到了极显著水平(P<0.01),而pH和温度2个因素对产酶水平的影响不显著。

表6 响应面试验的回归方程方差分析Table 6 Results of response surface design based on the ANOVA of the regression equation
2.4.2 响应面分析
根据分析软件Box-Behnken 程序拟合获得的交互二次回归方程得出不同因素的响应面和等高线分析结果如图7所示。由各模型参数可知,X1、X2、X3的二次方项对重组大肠杆菌产乙酰乳酸合成酶有极显著的影响,而各因素之间的相互作用对乙酰乳酸合成酶量影响不显著。根据响应面图和等高线图趋势,经对比分析得出,在追求高水平产酶效率时,在因素pH(X1)保持稳定的情况下,应考虑温度(X2) 与IPTG浓度(X3)的交互作用。
2.4.3 验证试验
通过回归方程和响应面预测重组大肠杆菌产乙酰乳酸合成酶的发酵最优条件为pH 7.0、温度30.2 ℃,IPTG浓度为0.42 mmol/L,该优化条件下乙酰乳酸合成酶产酶水平为237.081 U/mL。经发酵实验验证,以预测条件做3次平行实验,得到最高的产酶水平为242.567 U/mL,与模型的预测值相近,无显著性差异,说明该模型能够准确地预测重组大肠杆菌产乙酰乳酸合成酶的发酵条件,也可以获得较高产酶水平。
2.4.4 最优诱导条件下不同培养基中菌体生长及产酶比较
前述实验内容的优化条件组合后,利用最佳优化条件确定了最优发酵培养基的组成成分如下:葡萄糖10 g/L,蛋白胨15 g/L,柠檬酸钠 0.25 g/L,KH2PO40.1 g/L,MgSO4·7H2O 0.025 g/L,NaCl 0.1 g/L。根据优化后的诱导条件进行发酵实验,对比重组菌在发酵优化培养基、LB培养基中菌体生长及产酶情况,结果显示优化后培养基的菌体质量浓度、单位菌体产酶量和产酶水平均优于LB培养基(表7),分别达到1.623 g/L、164.299 kU/g和266.657 U/mL,是原LB培养基的1.35、1.31和1.77倍。

a-pH与温度交互图;b-pH与温度平面图;c-pH与IPTG浓度交互图;d-pH与IPTG浓度平面图;e-温度与IPTG浓度交互图;f-温度与IPTG浓度平面图图7 各因素交互作用对产酶水平影响的响应面Fig.7 Response surface analysis for interactive effects of pH,induced temperature and IPTG concentration on enzymic production level of recombinant E. coli

表7 不同培养基中菌体生长与产酶水平Table 7 Bacterial growth and enzyme production in different media
3 结论
经过优化培养基各组分后,确定重组大肠杆菌产乙酰乳酸合成酶的最适发酵培养基组分为:葡萄糖12 g/L,蛋白胨10 g/L,柠檬酸钠0.25 g/L,KH2PO40.05,MgSO4·7H2O 0.025 g/L,NaCl 0.1 g/L;最佳条件为pH=7.0,诱导温度30.2 ℃,IPTG浓度0.42 mmol/L,诱导时间10 h。在此条件下进行摇瓶发酵,单位菌体产酶量(164.299 kU/g)和产酶水平(266.657 U/mL)分别是LB培养基的1.31和 1.77倍。本实验为提高具有活性的乙酰乳酸合成酶产量,及增强双乙酰的合成代谢流及低成本大量生产酶制剂增补一些数据和资料基础。
