冷浸渍开始阶段接种戴尔有孢圆酵母(Torulaspora delbrueckii)对葡萄酒中挥发性成分和生物胺含量的影响
2020-07-29张博钦尤雅成池芳段长青燕国梁
张博钦,尤雅,成池芳,段长青,燕国梁*
1(中国农业大学 食品科学与营养工程学院,葡萄与葡萄酒研发中心,北京,100083)2(农业农村部葡萄酒加工重点实验室,北京,100083)3(新疆中信国安葡萄酒业有限公司,新疆 昌吉,832200)
冷浸渍(cold maceration, CM)是红葡萄酒酿造中一种常用的工艺,它是指将葡萄除梗破碎后,置于发酵罐中进行一定时间的低温浸渍(5~15 ℃),然后再启动酒精发酵[1-2]。冷浸渍工艺可以有效浸提葡萄浆果中的香气化合物(包括香气前体物质)和多酚化合物,增加颜色稳定性,使葡萄酒的香气更加浓郁和复杂[3-4]。在冷浸渍过程中,低温抑制了大部分微生物的活动,但有研究发现,在该过程中仍有部分非酿酒酵母依旧能够生长代谢,并对最终葡萄酒的风味和品质产生积极贡献。HALL 等[5]在冷浸渍阶段分离出多种非酿酒酵母菌株,包括美极梅奇酵母(Metschnikowiapulcherrima)、葡萄汁有孢汉逊酵母(Hanseniasporauvarum)、耐热克鲁维酵母(Kluyveromycethermotolerans)等,进一步研究表明这些菌株的存在会显著改变酒精发酵后黑比诺(Pinotnoir)葡萄酒的香气品质,特别是能够增加一些酯类、高级醇和萜烯类化合物的含量。为了进一步提升非酿酒酵母在冷浸渍工艺中的作用,BENUCCI等[6]在桑娇维赛(Sangiovese)葡萄冷浸渍阶段接入美极梅奇酵母(MetschnikowiapulcherrimaMP346和MetschnikowiafructicolaMF98-3),发现萜烯类、酯类,乳酸异戊酯和琥珀酸异戊酯的含量升高,提高了葡萄酒的香气品质。
非酿酒酵母种类众多,主要包括假丝酵母(Candida)、毕赤酵母(Pichia)、汉逊酵母(Hanseniaspora)、有孢圆酵母(Torulaspora)、梅奇酵母(Metschnikowia)、克鲁维酵母(Kluyveromyces)等[7]。大量的研究表明,非酿酒酵母具有一些优良酿造特性,如高产香气化合物(酯类、苯乙醇等)、高产增香酶类(酯酶、β-糖苷酶、脂肪酶、蛋白酶等)、低产乙酸、改善葡萄酒颜色和口感等[7-10]。其中,戴尔有孢圆酵母(Torulasporadelbrueckii)是葡萄酒酿造中一种常用的非酿酒酵母,能够有效提高酯类香气成分和甘油的合成水平,同时降低乙酸含量[11-13]。需要指出的是目前非酿酒酵母与酿酒酵母的混合发酵中,非酿酒酵母主要是在酒精发酵阶段接入,对于冷浸渍阶段接入非酿酒酵母对葡萄酒品质影响的研究还非常少,而对于戴尔有孢圆酵母与冷浸渍工艺相结合的研究还未见报道。
本实验室从新疆产区筛选到1株酿造特性优良的野生戴尔有孢圆酵母CVE-Td3,该菌株高产脂肪酸酯类香气且能够在较低温度下生长。为了提升干红葡萄酒的品质,本研究将冷浸渍工艺与接种戴尔有孢圆酵母相结合,探究在赤霞珠葡萄冷浸渍阶段接种不同浓度的CVE-Td3酵母对红葡萄酒香气品质及生物胺含量的影响,为生产优质安全的葡萄酒提供实践指导。
1 材料与方法
1.1 实验材料
酿酒葡萄:赤霞珠葡萄采自河北廊坊,还原糖质量浓度为223 g/L,pH值为3.14,可滴定酸总量为5.22 g/L。
供试酵母:戴尔有孢圆酵母CVE-Td3(以下简称Td3酵母),筛选自新疆玛纳斯产区赤霞珠红葡萄酒自然发酵过程中,保存于中国农业大学葡萄与葡萄酒研究中心[14];酿酒酵母EC1118,购于法国Lallemand公司。
1.2 试剂
葡萄糖、果糖、硼酸、硼砂、无水乙酸钠、浓硫酸、甘油、无水乙醇,北京化学试剂公司;叠氮化钠,生工生物工程(上海)有限公司;生物胺标准品、乙氧亚甲基丙二酸二乙酯(diethyl ethoxymethylene malonate,DEEMM),美国 Singma-Aldrich 公司;蛋白胨、酵母浸粉和琼脂,北京奥博星生物技术有限责任公司;甲醇、正己烷(色谱级,99.9%),美国Tedia公司;WL固体培养基,青岛高科园海博生物技术有限公司;赖氨酸固体培养基,OXOID公司。
1.3 仪器与设备
DHP-9032电热恒温培养箱,上海-恒科学仪器有限公司;LDZX-50FBS立式压力蒸汽灭菌器,上海申安医疗器械厂;DL-CJ-2ND型超净工作台,北京东联哈尔仪器制造有限公司;Agilent 1200高效液相色谱仪、Agilent 6890气相色谱仪、Agilent 5975B质谱仪、PDMS/CAR/DVB聚二甲基硅氧烷/碳筛/二乙烯苯萃取头、ZORBAX SB-C18色谱柱,美国安捷伦科技有限公司;新世纪紫外-可见分光光度计(T6),北京普析通用仪器有限责任公司;HPX-87H色谱柱,美国Bio-Rad公司。
1.4 实验方法
1.4.1 发酵实验
本实验使用10 L玻璃发酵罐进行发酵,发酵罐使用前均用0.1 mol/L的NaOH稀溶液清洗干净。将赤霞珠葡萄除梗破碎后添加至发酵罐容量的80%,然后加入30 mg/L的果胶酶和30 mg/L的SO2。在冷浸渍开始阶段分别接种不同的浓度的Td3酵母,包括0 CFU/mL(NTd),1×106CFU/mL(LTd)和1×107CFU/mL(HTd),之后在10 ℃下冷浸渍4 d。冷浸渍结束后,接入1×106CFU/mL的酿酒酵母EC1118,在(23±2) ℃进行酒精发酵。每组实验设置2个重复,共6个发酵罐。
酒精发酵期间,每天压帽2~3次,保证皮渣充分浸渍,发酵过程中每天测定发酵汁的比重和温度。酒精发酵结束后(还原糖质量浓度<4 g/L),将皮渣过滤,静置2 d后转入10 L玻璃发酵罐中,接入商业乳酸菌(Viniflora®Oenos, 丹麦科汉森公司)进行苹乳发酵。当苹果酸消耗完毕时,结束苹乳发酵。在冷浸渍(NTd-CM、 LTd-CM、 HTd-CM),酒精发酵(NTd-AF、 LTd-AF、 HTd-AF)和苹乳发酵(NTd-MF、 LTd-MF、HTd-MF)后分别取样,并将样品放置于-20 ℃冷藏备用。
1.4.2 生长曲线测定
生长曲线的测定[15]:在冷浸渍及酒精发酵过程中,每隔24 h取样1次测定各酵母菌的生长情况。每次取样后,使用无菌水将样品进行梯度稀释,将稀释后的样品涂布于WL固体培养基和赖氨酸固体培养基上,于30 ℃培养2~3 d后进行菌落计数。根据时间和菌落数量绘制不同酵母菌的生长曲线。
1.4.3 理化指标的测定
主要代谢产物测定[3]:使用Agilent 1200高效液相色谱仪进行主发酵产物的测定,离子交换色谱柱为HPX-87H (300 mm×7.8 mm)。其中,葡萄糖、果糖、甘油、乙醇的测定使用示差折光检测器,进样量为20 μL,柱温45 ℃,分析时间30 min;有机酸(酒石酸、苹果酸、柠檬酸、琥珀酸、乳酸、乙酸)的测定采用紫外分光检测器,进样量为10 μL,柱温60 ℃,分析时间30 min。每个样品进行2次平行测定。
生物胺的测定[4]:使用Agilent 1200高效液相色谱仪进行生物胺的测定,色谱柱为ZORBOX SB-C18(50 mm×3.0 mm)。使用示差折光检测器,柱温16 ℃,进样量为2 μL,分析时间25 min。每个样品进行2次平行测定。
香气化合物的测定[16]:使用Agilent 6890气相色谱仪和Agilent 5975B质谱仪和进行香气物质的测定。载气为高纯氦气(纯度 99.999%),流速1 mL/min,自动进样。使用聚二甲基硅氧烷/碳筛/二乙烯苯(PDMS/CAR/DVB)萃取头和ZORBAX SB-C18色谱柱。柱温箱升温程序为50 ℃保持1 min,以3 ℃/min的速度升温至220 ℃,保持5 min。质谱接口温度为280 ℃,离子源温度为230 ℃,电离方式为电子轰击离子化(electron ionization,EI),离子源能量70 eV,质量扫描范围为29~350m/z。每个样品进行2次平行测定。
香气成分的气味活度值(odor activity value,OAV)的计算[17],如公式(1)所示:

(1)
1.5 数据分析
采用SPSS 23.0进行差异显著性分析(analysis of variance,ANOVA),最低显著性水平P<0.05。采用Origin 9.0和SIMCA14.1作图。
2 结果与分析
2.1 酵母生长及主发酵产物
处理组(LTd和HTd)在冷浸渍及酒精发酵过程中生长曲线如图1所示,为了方便比较,我们将对照组(NTd)中酵母的生长曲线同时列出。各实验组在第9天均能够顺利完成酒精发酵。在LTd实验组中(图1-A),Td3酵母在第4天达到最大的生物量(1.52×108CFU/mL),当接入EC1118酵母后,Td3酵母的生物量开始迅速下降,这是因为不断升高的乙醇浓度以及2种酵母间的相互作用所致[18]。在HTd实验组中(图1-B),Td3酵母的生物量在第1天便达到了2.31×108CFU/mL,之后略有升高,在第4天达到最大值(2.8×108CFU/mL)。随着EC1118酵母的加入,Td3酵母的生物量开始缓慢下降,这与LTd实验组有明显差异。在对照组NTd中,EC1118酵母的生长趋势与添加Td3酵母的实验组(LTd和HTd)相似,其生物量在第8天达到最大(1.72×108CFU/mL)。但在相同的发酵时间下,未添加Td3酵母的实验组(NTd)中EC1118酵母的生物量要明显高于接种Td3酵母的实验组(LTd和HTd),这可能是因为在发酵前期接种Td3酵母会消耗大量的营养物质(氨基酸和维生素),限制了酿酒酵母的生长[19]。
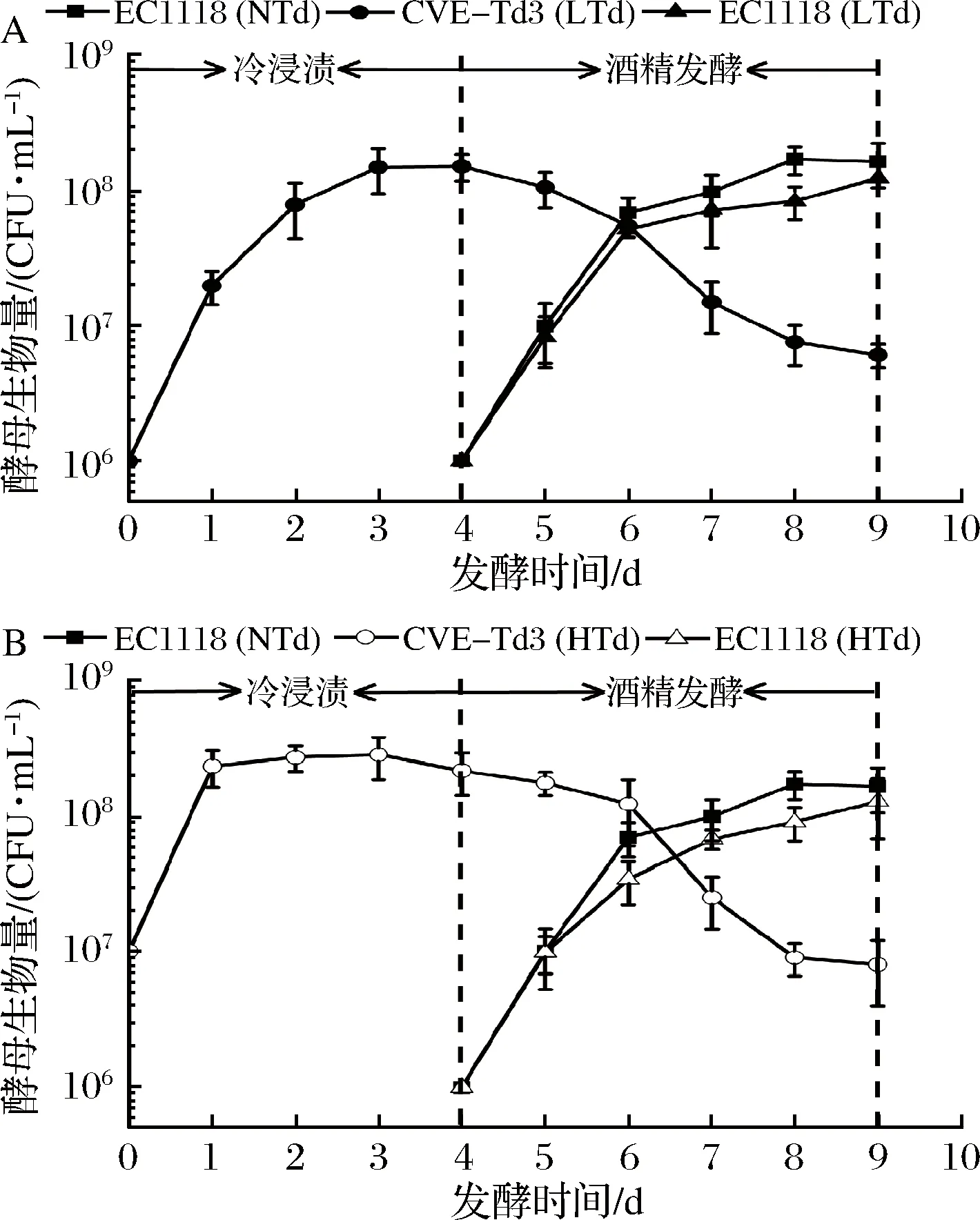
A-实验组NTd和LTd;B-实验组NTd和HTd图1 发酵过程中不同酵母菌浓度的变化趋势Fig.1 Yeasts proliferation during fermentation at different trails
各实验组中主发酵产物的含量如表1所示,酒精发酵后各实验组中葡萄糖和果糖含量差异不大。接种Td3酵母的实验组(LTd-AF和HTd-AF)中甘油和乙醇的含量要明显低于未添加Td3酵母的实验组(NTd-AF),其中HTd-AF中甘油和乙醇的含量最低(7.23 g/L和11.84%vol),与对照组NTd-AF相比分别降低了12.26%和5.20%。同样,添加Td3酵母的实验组(LTd-AF和HTd-AF)中柠檬酸、酒石酸、苹果酸和乙酸的含量也明显低于未添加Td3酵母的实验组(NTd-AF)。乙酸会为葡萄酒带来酸腐味,质量浓度过高对葡萄酒的感官品质会产生不良影响[13]。LTd-AF和HTd-AF实验组中乙酸的质量浓度与对照相比降低了30.51%~33.90%,这是戴尔有孢圆酵母区别于其他非酿酒酵母的明显特征[12],能够提升葡萄酒的感官品质。苹乳发酵后,HTd-MF实验组中甘油质量浓度和乙醇的含量依旧最低(7.59 g/L和12.40%vol),与NTd-MF差异依旧显著,分别降低了4.29%和8.08%。乳酸的含量显著提升,增幅为141.76%~293.90%,而接种Td3酵母的实验组(LTd-MF和HTd-MF)中乳酸的含量(质量浓度)明显高于未添加Td3酵母的实验组(NTd-MF),其中HTd-MF中乳酸含量(质量浓度)最高(3.23 g/L)。
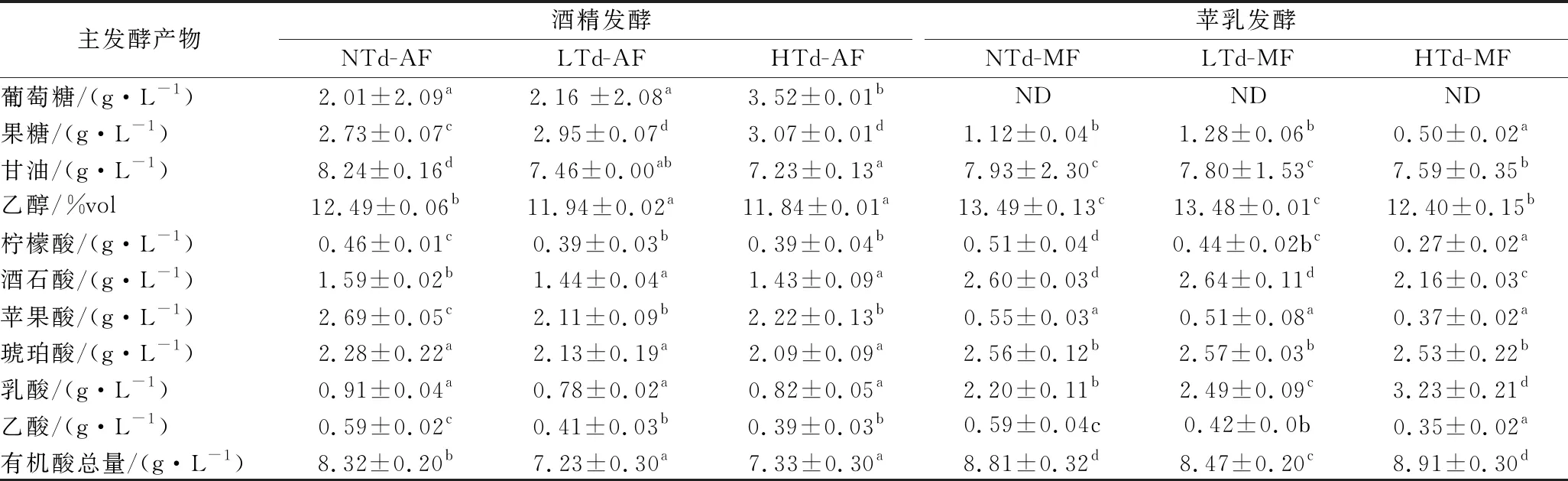
表1 酒精及苹乳发酵后各实验组中主发酵产物的含量Table 1 The concentrations of main products in trails after alcoholic and malolactic fermentation
2.2 挥发性香气物质
本研究采用顶空固相微萃取结合气相色谱-质谱联用(headspace solid phase microextration combined with gas chromatography-mass spectrometry,HS-SPME-GC-MS)法测定了冷浸渍、酒精发酵、苹乳发酵后各实验组中挥发性香气成分的含量,结果如表2所示。本实验样品中共检测到42种香气化合物,主要包括高级醇类物质、酯类物质、挥发酸类物质和萜烯类物质,各物质的香气阈值参考相关文献[3, 20]。
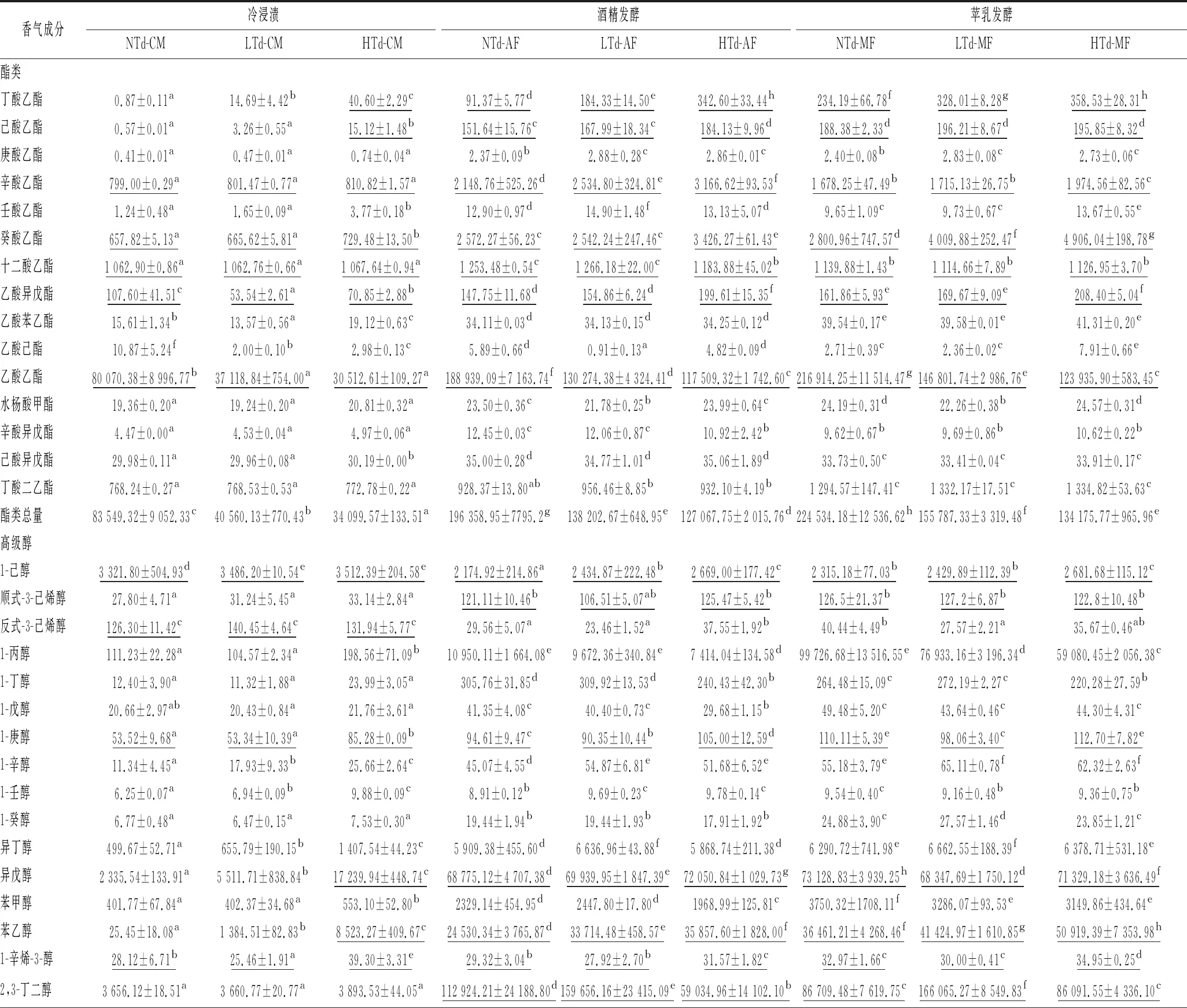
表2 冷浸渍,酒精发酵及苹乳发酵后香气成分的含量 单位:μg/L
2.2.1 酯类
酯类物质能为葡萄酒提供令人愉悦的花香和果香,是葡萄酒香气的重要组成部分[21]。冷浸渍结束后,酯类物质总量(质量浓度)由低到高分别为HTd-CM(34 099.57 μg/L)、LTd-CM(40 560.13 μg/L)、NTd-CM(83 549.32 μg/L)。其中,共有7种酯类化合物的OAV值超过0.1,分别为丁酸乙酯、己酸乙酯、辛酸乙酯、癸酸乙酯、十二酸乙酯、乙酸异戊酯和乙酸乙酯,这些物质能够为葡萄酒提供香蕉、草莓、苹果等水果的香气以及花香[22-23]。添加Td3酵母的实验组(LTd-CM和HTd-CM)中丁酸乙酯、己酸乙酯和癸酸乙酯的含量均高于未添加Td3酵母实验组NTd-CM,但只有丁酸乙酯的含量在各实验组中差异显著。
酒精发酵结束后,大部分酯类物质的质量浓度明显升高,酯类物质质量浓度由低到高分别为HTd-AF(127 067.75 μg/L)、LTd-AF(138 202.67 μg/L)、NTd-AF(196 358.95 μg/L)。前人结果表明,戴尔有孢圆酵母与酿酒酵母进行混合发酵能产生更多的酯类物质(如乙酸异戊酯、己酸乙酯和辛酸乙酯),给葡萄酒贡献新鲜的水果香气[24-25]。在本研究中,丁酸乙酯、己酸乙酯、辛酸乙酯、癸酸乙酯和乙酸异戊酯的含量在接种高浓度Td3实验组(HTd-AF)中最高,与NTd-AF差异显著,分别提升了274.96%、21.43%、47.37%、34.37%和35.10%。NTd-AF中则含有大量的乙酸乙酯,该香气物质是葡萄酒中重要的风味物质,但其质量浓度在高于150 mg/L时会增加葡萄酒中的溶剂味等不良味感,对葡萄酒的感官品质产生不利影响[10]。NTd-AF中乙酸乙酯质量浓度已达到188.94 mg/L,会对葡萄酒的品质带来一定的消极作用,而HTd-AF和LTd-AF中乙酸乙酯的质量浓度为30.51~37.12 mg/L,能够增加葡萄酒的果香和复杂性。
苹乳发酵结束后,各实验组中酯类物质的质量浓度发生进一步的变化。丁酸乙酯、己酸乙酯、癸酸乙酯、乙酸异戊酯和乙酸乙酯的质量浓度均升高,而辛酸乙酯的含量却有所下降,这与我们之前的研究结果一致[15]。其中,癸酸乙酯和辛酸乙酯的变化最为明显,癸酸乙酯经过苹乳发酵后提高了8.89%(NTd)、57.73%(LTd),而辛酸乙酯则降低了21.90%(NTd)、37.64%(HTd)。酯类物质质量浓度由低到高分别为HTd-MF(134 175.77 μg/L)、LTd-MF(155 787.33 μg/L)、NTd-MF(224 534.18 μg/L)。其中HTd-MF含有最高质量浓度的丁酸乙酯、辛酸乙酯、癸酸乙酯和乙酸异戊酯,与NTd-MF相比差异已经显著,分别提升了53.09%、17.66%、75.16%和28.75%。以上结果表明,在冷浸渍阶段添加Td3酵母后能够提升葡萄酒中丁酸乙酯、己酸乙酯、辛酸乙酯、癸酸乙酯和乙酸异戊酯的含量(质量浓度)。
2.2.2 高级醇
醇类主要是酵母代谢产生的次级产物,通常具有刺激性气味。当葡萄酒中的高级醇含量(质量浓度)低于300 mg/L时,对葡萄酒香气具有积极贡献,可增加葡萄酒香气的复杂性。但当其总量(质量浓度)超过400 mg/L时,会产生令人不愉快的气味,导致感官葡萄酒品质下降[26]。冷浸渍后,各实验组的高级醇含量由低到高分别为NTd-CM(10 644.74 μg/L)、LTd-CM(15 519.50 μg/L)、HTd-CM(20 186.21 μg/L),均低于300 mg/L。其中1-己醇、反式-3-己烯醇、1-庚醇、异戊醇、苯乙醇和1-辛烯-3-醇的OAV超过0.1,能够为葡萄酒提供植物味、油脂味、溶剂味及一定的花香和甜香[22-23,27-28]。
酒精发酵结束后,各实验组的高级醇总量由低到高分别为HTd-AF(185 508.97 μg/L)、NTd-AF(228 228.35 μg/L)、LTd-AF(285 185.13 μg/L),其中1-己醇、顺式-3-己烯醇、1-庚醇、异戊醇,苯乙醇,1-辛烯-3-醇和2, 3-丁二醇的OAV超过0.1。与NTd-AF相比,LTd-AF 和HTd-AF能够显著增加1-己醇、异戊醇、苯乙醇的含量。苯乙醇是葡萄酒中一种重要的醇类香气化合物,可为葡萄酒提供玫瑰、蜂蜜等令人愉悦的香气[17],其含量在HTd-AF中最高(35.86 mg/L),是NTd-AF的1.46倍。AZZOLINI等[24]使用戴尔有孢圆酵母发酵索阿维(Soave)和霞多丽(Chardonnay)葡萄汁能够使苯乙醇的含量大幅提升,增加葡萄酒中花香和甜香。2,3-丁二醇能够为葡萄酒带来一定的奶油味和果香,丰富葡萄酒的香气和口感[29]。LTd-AF具有最高质量浓度的2,3-丁二醇(159.66 mg/L),是NTd-AF的1.41倍。
苹乳发酵结束后,高级醇的含量进一步发生变化。其中,苯乙醇的含量变化最为明显,其含量增加了22.87%(LTd)~48.64%(NTd)。各实验组的高级醇总量由低到高分别为HTd-MF(280 297.05 μg/L)、NTd-MF(309 096.00 μg/L)、LTd-MF(365 850.10 μg/L)。其中HTd-MF中含有最多含量的1-己醇和苯乙醇,与NTd-MF差异显著,分别提升了15.83%和39.65%。
2.2.3 其他香气物质
挥发酸能够提高葡萄酒香气的复杂性,是葡萄酒中重要的一类香气物质[10]。本实验检测到4种挥发酸,分别为己酸、辛酸、癸酸和异丁酸,其OAV均超过0.1。冷浸渍结束后,HTd-CM中己酸、辛酸、癸酸和异丁酸的含量最高,其挥发酸总量达到2 268.47 μg/L。酒精发酵结束后,各挥发酸的含量均有所增加。其中,NTd-AF具有较高质量浓度的癸酸(499.31 μg/L);LTd-AF中己酸(893.92 μg/L)和辛酸(720.50 μg/L)的质量浓度最高;HTd-AF则具有较多的异丁酸(1 379.07 μg/L)。苹乳发酵结束后,己酸和辛酸的含量明显升高,增加量分别为24.10%(LTd)~54.73%(HTd)和16.65%(LTd-MF)~29.15%(HTd-MF)。HTd-MF中挥发酸质量浓度为最高(3 973.11 μg/L),为NTd-MF的1.07 倍。除此之外,本研究还检测到4种萜烯类化合物,包括伞花烃、萜烯醇、香茅醇和β-大马士酮。其中,香茅醇和β-大马士酮OAV超过0.1,能够为葡萄酒提供一定的玫瑰花香和甜香[17,29-30]。冷浸渍后,HTd-CM具有较高质量浓度的β-大马士酮,经过酒精及苹乳发酵后,其质量浓度有所下降,但HTd中β-大马士酮的质量浓度始终比其他2个实验组(NTd和LTd)高。
综上所述,对比冷浸渍、酒精发酵和苹乳发酵后各实验组的香气物质含量,在冷浸渍阶段添加Td3酵母能够增加葡萄酒中丁酸乙酯、己酸乙酯、辛酸乙酯、癸酸乙酯、乙酸异戊酯和苯乙醇的质量浓度,增加葡萄酒的果香和花香的浓郁程度,改善最终葡萄酒的香气品质,其中在冷浸渍阶段添加1×107CFU/mL Td3酵母(HTd)的效果更佳。

续表2
2.3 挥发性香气物质的主成分分析
为了直观展示各实验组之间的差异,我们将OAV>0.1的22种香气成分进行主成分分析(principle compounds analysis,PCA)。由图2可知,2个主成分(PC1和PC2)的总贡献率为88.1%,其中PC1的贡献率为76.9%,PC2的贡献率为11.2%。冷浸渍后,HTd-CM位于第2象限,与NTd-CM和LTd-CM差异明显。其中,HTd-CM与1-己醇、反式-3-己烯醇和β-大马士酮密切相关。酒精发酵后,HTd-AF位于第1象限,而NTd-CM和LTd-CM位于第4象限,之间的差异依旧明显。而苹乳发酵后,NTd-MF、LTd- MF和HTd- MF均位于第1象限,3个实验组之间的差异有所降低。通过对冷浸渍、酒精发酵后和苹乳发酵后各实验组的PCA分析,我们发现,HTd实验组与其他2个实验组(LTd和NTd)差异明显,这说明冷浸渍阶段接1×107CFU/mL的Td3酵母(HTd)能够改变葡萄酒香气轮廓,提升葡萄酒香气的复杂性和多样性。
2.4 生物胺
生物胺(biogenic amines)是一类具有生物活性的含氮低分子量有机化合物的总称[31]。长期食用含生物胺的食品,会引起很多不良反应,如头痛、呼吸紊乱、心悸等[32]。目前,已经有许多国家对葡萄酒中组胺的最大限量值作出了规定,如法国是8 mg/L,而瑞士、匈牙利和奥地利是10 mg/L[33],而我国葡萄酒中生物胺的限量值还没有明确规定。已有研究表明,通过非酿酒酵母能够降低葡萄酒中生物胺的含量,如MEDINA等[34]在霞多丽葡萄发酵中接入葡萄园有孢汉逊酵母 02/5A,能够降低组胺和酪胺的含量。为了明确在冷浸渍中接种戴尔有孢圆酵母Td3对干红葡萄酒中生物胺含量的影响,本文对冷浸渍、酒精发酵和苹乳发酵后各实验组中生物胺的含量进行了测定,结果如图3所示。
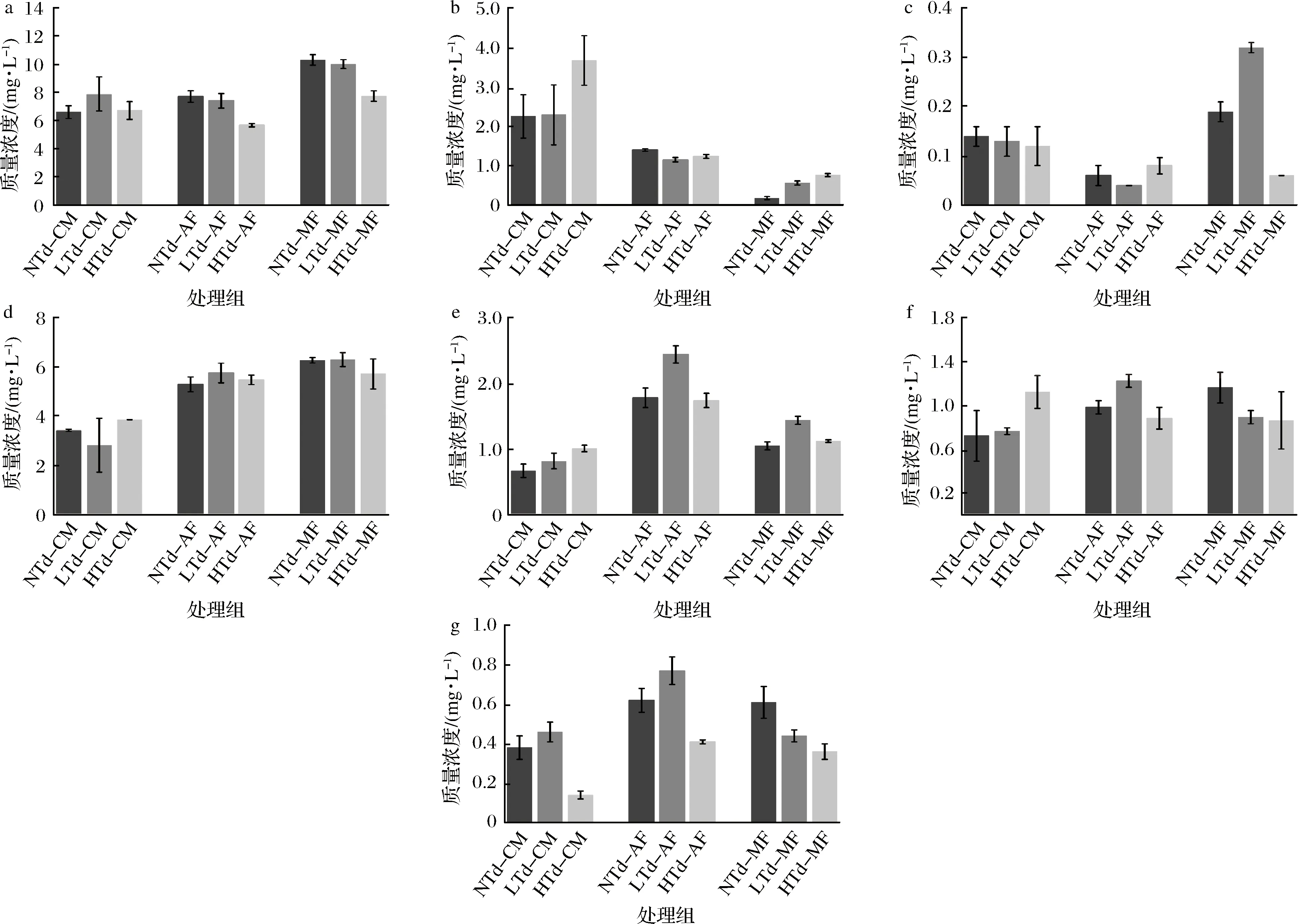
a-组胺;b-酪胺;c-尸胺;d-腐胺;e-亚精胺;f-精胺;g-苯乙胺图3 冷浸渍、酒精发酵和苹乳发酵后各实验组中生物胺的质量浓度Fig.3 The concentrations of biogenic amines in wines after cold maceration, alcoholic fermentation and malolactic fermentation
冷浸渍结束后,NTd-CM中组胺(6.59 mg/L)、酪胺(2.25 mg/L)、精胺(0.72 mg/L)和亚精胺(0.67 mg/L)的质量浓度最低;LTd-CM中腐胺(2.82 mg/L)质量浓度最低;而HTd-CM则尸胺(0.12 mg/L)和苯乙胺(0.14 mg/L)质量浓度最低。酒精发酵后,三个实验组中腐胺、亚精胺、苯乙胺的质量浓度均明显上升,而酪胺和尸胺则有所下降。添加Td3酵母的实验组(LTd-AF和HTd-AF)中组胺、酪胺的质量浓度均明显低于NTd-AF,并且HTd-AF中组胺(5.68 mg/L)、精胺(0.88 mg/L)、亚精胺(1.74 mg/L)和苯乙胺(0.41 mg/L)质量浓度最低,相比于NTd-AF,降幅分别为26.23%、10.20%、2.24%和33.87%。苹乳发酵后,组胺的质量浓度大幅增加,增加比例为33.77%~36.09%。HTd-MF中具有最低质量浓度的组胺、腐胺、尸胺、精胺和苯乙胺,与NTd-MF差异显著,分别下降了24.95%、68.42%、25.86%、40.98%和15.94%,而LTd-MF中这些生物胺的降幅却不明显。在冷浸渍阶段接种高浓度的Td3酵母(1×107CFU/mL)能够明显降低葡萄酒中生物胺的质量浓度,这可能是由于Td3酵母的大量生长抑制了其他微生物的代谢活动,进而导致最终葡萄酒中生物胺质量浓度的降低。
3 结论
本研究发现,在冷浸渍开始阶段接种戴尔有孢圆酵母Td3能够显著增加丁酸乙酯、辛酸乙酯、癸酸乙酯、乙酸异戊酯和苯乙醇的质量浓度,同时降低生物胺,尤其是组胺的质量浓度,有效提升干红葡萄酒香气和安全品质。并且,接种高浓度Td3酵母(1×107CFU/mL)对干红葡萄酒品质的提升效果最佳。上述结果表明,在冷浸渍开始阶段接种优良戴尔有孢圆酵母是提升干红葡萄酒品质的有效手段,为生产优质安全的干红葡萄酒提供了实践指导。
