枳实中酚类化合物的分离与鉴定
2020-07-23邓可众刘聪苌美燕宗琪熊英
邓可众 刘聪 苌美燕 宗琪 熊英
中图分类号 R284.1 文献标志码 A 文章编号 1001-0408(2020)09-1040-04
DOI 10.6039/j.issn.1001-0408.2020.09.04
摘 要 目的:分离鉴定枳实中的酚类化合物,为其药效物质基础研究提供参考。方法:采用硅胶柱色谱、HW-40F凝胶柱色谱、ODS反相柱色谱以及制备高效液相色谱(HPLC)等方法对枳实中酚类化合物进行分离纯化,并根据其理化性质和波谱数据进行结构鉴定。结果与结论:从枳实中分离鉴定了12个化合物,分别为6′-O-trans-cinnamoyl-3,5-dihydroxyphenyl β-D-glucopyranoside(化合物1)、3-(2′,4′-二羟基苯基)丙酸甲酯(化合物2)、间苯三酚(化合物3)、Aurantiside A(化合物4)、5,7,4′-三羟基-8,3′-二甲氧基黄酮-3-O-6″-(3-羟基-3-甲基戊二酸单酯)-β-D-葡萄糖苷(化合物5)、香橙素-7-O-β-D-葡萄糖苷(化合物6)、橙皮素-7-O-β-D-葡萄糖苷(化合物7)、柚皮苷(化合物8)、橙皮苷(化合物9)、芸香柚皮苷(化合物10)、新圣草苷(化合物11)、圣草次苷(化合物12)。其中,化合物1为新化合物,化合物2、3为首次从柑橘属植物中分离得到。
关键词 枳实;化学成分;酚类化合物;分离;鉴定
Isolation and Identification of Phenols Compounds in Aurantii Fructus Immaturus
DENG Kezhong,LIU Cong,CHANG Meiyan,ZONG Qi,XIONG Ying(College of Pharmacy, Jiangxi University of TCM, Nanchang 330004, China)
ABSTRACT OBJECTIVE: To separate and identify the phenols compounds in Aurantii Fructus Immaturus, and to provide reference for basic research of its effective substances. METHODS: The phenols compounds were isolated and separated by silica gel, HW-40F gel column, ODS reversed column and preparation HPLC. Their physicochemical properties and spectral data were used to identify the structures. RESULTS & CONCLUSIONS: Totally 12 compounds were isolated from Aurantii Fructus Immaturus, identified as 6′-O-trans- cinnamoyl-3,5-dihydroxyphenyl β-D-glucopyranoside (compound 1), methyl 3-(2′,4′- dihydroxy phenyl) propionate (compound 2), phloroglucinol (compound 3), aurantiside A (compound 4), 5,7,4′-trihydroxy-8,3′-dimethoxyflavone-3-O-6″-(3-hydroxyl-3-methylglutaroyl) β-D-glucopyranoside (compound 5), aromadendrin-7-O-β-D- glucopyranside (compound 6) , hesperidin-7-O-β-D-glucoside (compound 7), naringin (compound 8), hesperidin (compound 9), narirutin (compound 10), neoeriocitrin (compound 11), eriocitrin (compound 12). Among them, compound 1 is a new compound, and compounds 2 and 3 are isolated from Critus for the first time.
KEYWORDS Aurantii Fructus Immaturus; Chemical constituents; Phenols compounds; Isolation; Identification
枳實为芸香科柑橘属植物酸橙(Citrus aurantium L.)及其栽培变种或甜橙(C. sinesis Osbeck)的干燥幼果[1],主产于江西、湖南、重庆等地。枳实为常用理气类中药,具有破气消积、化痰散痞之效,常用于治疗胃肠积滞导致的痞满胀痛[2]。本课题组前期已报道枳实中的杂环类[3]、香豆素类[4]等化学成分,推测枳实中还含有较多的其他类化学成分,现采用硅胶柱色谱、HW-40F凝胶柱色谱、ODS柱色谱以及制备高效液相色谱(HPLC)等方法对枳实中酚类化合物进行分离纯化,并根据其理化性质和波谱数据进行结构鉴定,以期为枳实药效物质基础的阐明提供参考。
1 材料
1.1 仪器与色谱柱
Avance HD型600 MHz核磁共振仪(瑞士Bruker公司);VERIEX70型傅里叶变换红外光谱仪(日本岛津公司);BS 224S型电子分析天平(德国赛多利斯公司);ZF-1型三用紫外分析仪(上海宝山顾村电光仪器厂);1100 LC/MSD Trap SL型质谱仪(美国Agilent公司);2489 Alliance Separations Module型制备液相色谱仪、2695型HPLC仪(美国Waters公司);ODS-AQ色谱柱、Phenomenex C18色谱柱(日本YMC公司)。
1.2 药品与试剂
枳实药材于2013年购于江西省樟树市药材市场,经江西中医药大学药学院熊英教授鉴定为芸香科柑橘属植物酸橙(C. aurantium L.)的干燥幼果;柚皮苷对照品(中国食品药品检定研究院,批号:0722-200108,纯度:>98%);芸香柚皮苷对照品(上海源叶生物科技有限公司,批号:YY90132,纯度:>98%);HW-40F凝胶(日本TOSOH公司);大孔树脂HP-20(日本三菱化学公司);柱色谱硅胶(100~300目)、GF254薄层硅胶(青岛海洋化工厂);甲醇为色谱纯,石油醚、乙酸乙酯、正丁醇、二氯甲烷等试剂均为分析纯,水为纯净水。
2 方法与结果
2.1 枳实中酚类化合物的提取与分离
取50 kg枳实,粉碎,采用5倍量(L/kg,下同)体积的95%、70%乙醇依次渗漉提取20 d,提取液减压回收,得浸膏;将浸膏用水分散,依次用石油醚、乙酸乙酯、正丁醇(各约50 L)萃取,减压浓缩得3种不同萃取物浸膏(其中石油醚萃取部分亲脂性较强,故暂未进行分离)。
2.1.1 乙酸乙酯层浸膏的分离 取乙酸乙酯层浸膏1 kg,经硅胶柱色谱分离,以二氯甲烷-甲醇(1 ∶ 0、49 ∶ 1、 19 ∶ 1、8 ∶ 2、7 ∶ 3、5 ∶ 5、0 ∶ 1,V/V)梯度洗脱,流速约50 mL/min。依据薄层色谱检测结果,合并得146个流分。其中第133流分再经ODS反相柱色谱分离,以水-甲醇(1 ∶ 0、9 ∶ 1、8 ∶ 2、7 ∶ 3、6 ∶ 4、5 ∶ 5、4 ∶ 6、3 ∶ 7、2 ∶ 8、1 ∶ 9、0 ∶ 1, V/V)梯度洗脱,流速为10 mL/min,并根据薄层色谱主斑点合并得22个组分即Fr.1A~Fr.22A。Fr.15A组分经HW-40凝胶柱色谱分离,甲醇洗脱,制备液相色谱[流动相为甲醇-水(4 ∶ 6,V/V)]纯化,得化合物1(29.5 mg);Fr.3A析出结晶得化合物3(68 mg);Fr.11A和Fr.14A同样经HW-40凝胶柱色谱分离以及制备液相色谱[流动相分别为甲醇-水(3 ∶ 7,V/V)和甲醇-水(4 ∶ 6,V/V)]纯化,得到化合物 2(7 mg)和化合物7(60 mg)。第135流分同样经ODS反相柱色谱分离,以水-甲醇(1 ∶ 0、9 ∶ 1、8 ∶ 2、7 ∶ 3、6 ∶ 4、5 ∶ 5、4 ∶ 6、3 ∶ 7、2 ∶ 8、1 ∶ 9、0 ∶ 1,V/V)梯度洗脱,流速为10 mL/min,并根据薄层色谱主斑点合并得16个组分即Fr.1B~Fr.16B,其中Fr.1B组分经制备液相色谱[流动相为甲醇-水(3 ∶ 7,V/V)]分离纯化,得到化合物4(40.7 mg)和化合物6(42.3 mg)。
2.1.2 正丁醇层浸膏的分离 取正丁醇层浸膏1.5 kg,经过大孔树脂柱色譜分离,将30%乙醇洗脱部分经ODS反相柱色谱分离,以水-甲醇(1 ∶ 0、9 ∶ 1、8 ∶ 2、7 ∶ 3、6 ∶ 4、 5 ∶ 5、4 ∶ 6、3 ∶ 7、2 ∶ 8、1 ∶ 9、0 ∶ 1,V/V)梯度洗脱,流速为10 mL/min,得22个组分即Fr.1C~Fr.22C,其中Fr.3C、Fr.17C采用制备液相色谱[流动相分别为甲醇-水(4.5 ∶ 5.5,V/V)和甲醇-水(4 ∶ 6,V/V)]纯化,分别得化合物 5(77.1 mg)和化合物8(10 mg);Fr.2C经HW-40凝胶柱色谱分离,甲醇洗脱,得8个流分,再将洗脱的第2、5流分分别采用制备液相色谱[流动相分别为甲醇-水(4.5 ∶ 5.5,V/V)和甲醇-水(3.5 ∶ 6.5,V/V)]纯化,得化合物9(24.6 mg)、化合物10(12 mg)、化合物11(11.7 mg)、化合物12(11 mg)。
2.2 枳实中酚类化合物的结构鉴定
采用波谱数据和理化性质以及红外光谱、质谱等方法鉴定各化合物的结构。
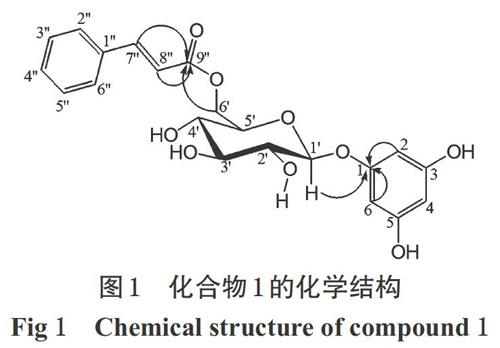
化合物1:黄色粉末。高分辨质谱显示其分子离子峰 [M+Na]+质荷比(m/z)为 441.116 2,推测分子式为C21H22O9 ;红外光谱中3 435、1 634、1 497、1 400、1 385、 1 165、1 078、 831 cm-1的吸收峰表明该化合物含有羟基、共轭酯基和苯环。薄层色谱(紫外光下观察,下同)中为暗斑点,10% 硫酸乙醇加热后显棕灰色。1H-NMR中δH 7.72(1H,d,J=16.2 Hz,H-7″)和6.62(1H,d,J=16.2 Hz,H-8″)为一对反式耦合双键上的2个H质子信号,δH 7.63(2H,m)、7.42(3H,m)结合13C-NMR中δc 118.7(C-8″)、129.4(C-3″,5″)、130.0(C-4″)、131.5(C-2″,6″)、135.8(C-1″)、146.6(C-7″)、168.6(C-9″),说明分子中含有1个肉桂酰基;δH 6.12(2H,d,J=2.4 Hz,H-2,6)、5.99(1H,t,J=1.8 Hz,H-4)和δc 96.8(C-2,6)、98.1(C-4)、160.2(C-3,5)、160.9(C-1),说明苯环上有间位3取代; δH 4.86(1H,d,J=7.2Hz,H-1′)为糖的端基H质子,δH 3.73~3.42(4H,m,H-2′,3′,4′,5′)、δH 4.60(1H,dd,J=2.4、12.0 Hz,H-6′a)、 4.32(1H,dd,J=7.2、12.0 Hz,H-6′b)结合δc 65.0(C-6′)、71.8(C-4′)、74.9(C-2′)、75.5(C-5′)、78.0(C-3′)、102.1(C-1′),说明该化合物为葡萄糖苷,该糖苷经酸水解后通过薄层色谱鉴定为D型葡萄糖,并根据耦合常数的大小推断该苷键构型为β-型。在碳氢远程相关(HMBC)谱中,根据 δc 168.6(C-9″)和δH 4.60(1H,dd,J=2.4、12.0 Hz,H-6′a)、4.32(1H,dd,J=7.2、12.0 Hz,H-6′b)有HMBC信号,并且δc 168.6(C-9″)还与反式双键的一对质子δH 7.72(1H,d,J=16.2 Hz,H-7″)、6.62(1H,d,J=16.2 Hz,H-8″)有远程相关,推测肉桂酰基的羰基碳与葡萄糖的6位相连;δc 160.9(C-1)与δH 4.86(1H,d,J=7.2Hz,H-1′)有远程相关,并且还与δH 6.12(2H,d,J=2.4 Hz,H-2,6)有远程相关,推测葡萄糖的端基连有1个3-取代苯环。因此,确定化合物1的结构为6′-O-trans-cinnamoyl-3,5-dihydroxyphenyl β-D- glucopyranoside,经查阅美国化学文摘数据库,发现其为新化合物。化合物1的化学结构见图1。
化合物2:黄色油状物。薄层色谱中为暗斑点,10%硫酸乙醇加热后显紫色。1H-NMR(CD3OD,600 MHz) δ:6.83(1H,d,J=8.4 Hz,H-6),6.26(1H,d,J=2.4 Hz,H-3),6.19(1H,dd,J=8.4、2.4 Hz,H-5),3.63(3H,s,O-CH3),2.77(2H,t,J=7.8 Hz),2.55(2H,t,J=7.8 Hz)。13C-NMR(CD3OD,150 MHz)δ:175.9(C-9),157.9(C-2),157.2(C-4),131.4(C-6),119.3(C-1),107.3(C-5),103.4(C-3),51.9(OCH3),35.4(C-8),26.5(C-7)。以上数据与文献报道[5]基本一致,故鉴定化合物2为3-(2′,4′-二羟基苯基)丙酸甲酯。
化合物3:白色块状晶体。薄层色谱中为暗斑点,10%硫酸乙醇加热后显橘黄色。1H-NMR(CD3OD,600 MHz) δ:5.79(3H,d,J=1.8 Hz,H-2,4,6)。13C-NMR(CD3OD,150 MHz) δ:159.8(C-1,3,5),95.6(C-2,4,6)。以上数据与文献报道[6]基本一致,故鉴定化合物3为间苯三酚。
化合物4:淡黄色粉末。薄层色谱中为暗斑点,10% 硫酸乙醇加热后显灰褐色。1H-NMR(CD3OD,600 MHz) δ:7.64(1H,d,J=15.6 Hz,H-7″),7.21(1H,d,J=1.8 Hz,H-2″),7.11(1H,dd,J=1.8、8.4 Hz,H-6″),6.81(1H,d,J=8.4 Hz,H-5″),6.44(1H,d,J=15.6 Hz,H-8″),6.20(1H,d,J=8.4 Hz,H-5″),6.11(2H,d,J=2.4 Hz,H-2,6),5.97(1H,t,J=2.4 Hz,H-4),4.85(1H,d,J=7.2 Hz,H-1′),4.56(1H,dd,J=2.4、12.0 Hz,H-6′a),4.30(1H,dd,J=6.6、12.0 Hz,H-6′b),3.92(3H,s,OCH3),3.72~3.37(4H,m,H-2′,3′,4′,5′)。13C-NMR(CD3OD,400 MHz)δ:56.5(OCH3),64.7(C-6′),71.8(C-4′),74.8(C-2′),75.5(C-5′),78.0(C-3′),96.8(C-2,6),98.1(C-4),102.1(C-1′),111.8(C-2″),115.2(C-8″),116.5(C-5″),124.2(C-6″),127.7(C-1″),147.1(C-7″),149.4(C-3″),150.8(C-4″),160.1(C-3,5),160.8(C-1),169.2(C-9″)。以上数据与文献报道[7]基本一致,故鉴定化合物4为Aurantiside A。
化合物5:黄色油状物。薄层色谱中为暗斑点,10%硫酸乙醇加热后显黄色。1H-NMR(CD3OD,600 MHz) δ:7.92(1H,s,H-2′),7.67(1H,d,J=8.4 Hz,H-6′),6.87(1H,d,J=8.4 Hz,H-5′),6.21(1H,s),5.30(1H,d,J=7.2 Hz,H-1″),4.20(1H,d,J=10.2 Hz,H-6″a),4.09(1H,m,H-6″b),3.92(3H,s,O-CH3),3.87(3H,s,O-CH3),3.59~3.45(4H,m,H-2″,3″,4″,5″),2.46(4H,m,H-2[′ ′ ′],4[′ ′ ′]),1.16(3H,s,H-6[′ ′ ′])。13C-NMR(CD3OD,150 MHz) δ:179.4(C-4),174.9(C-5[′ ′ ′]),172.2(C-1[′ ′ ′]),158.5(C-7),158.4(C-2),157.9(C-5),151.0(C-4′),150.2(C-9),148.3(C-3′),135.3(C-3),129.1(C-8),123.9(C-6′),122.9(C-1′),116.1(C-5′),114.1(C-2′),105.6 (C-10),104.0(C-1″),100.1(C-6),77.8(C-3″),75.6(C-3[′ ′ ′]),73.8(C-5″),71.5(C-2″),70.6(C-4″),64.4(C-6″),62.0(O-CH3),56.6(O-CH3),46.1(C-2[′ ′ ′]),45.8(C-4[′ ′ ′]),27.5(C-6[′ ′ ′])。以上数据与文献报道[8]基本一致,故鉴定化合物5为5,7,4′-三羟基-8,3′-二甲氧基黃酮-3-O-6-(3-羟基-3-甲基戊二酸单酯)-β-D-葡萄糖苷。
化合物6:黄色粉末。薄层色谱中为暗斑点,10%硫酸乙醇加热后显黄色。1H-NMR(600 MHz,CD3OD) δ:7.33(2H,d,J=8.4 Hz,H-2′,6′),6.82(2H,d,J=8.4 Hz,H-3′,5′),6.22(1H,J=1.8 Hz,H-8 ),6.21(1H,J=1.8 Hz,H-6),5.39(1H,d,J=2.4 Hz,H-2),4.98(1H,d,J=7.2 Hz,H-1″),3.90(1H,m,H-3)。13C-NMR(150 MHz,CD3OD) δ :197.2(C-4),167.0(C-5),166.9(C-7),163.2(C-9),159.3(C-4′),130.7(C-1′),129.1(C-2′,6′),116.4(C-3′,5′),105.0(C-10),101.2(C-1″),98.0(C-6),96.9(C-8),80.6(C-2),78.3(C-3″),77.8(C-5″),74.64(C-2″),71.14(C-4″),62.32(C-6″),77.2(C-3)。以上数据与文献报道[9]基本一致,故鉴定化合物6为香橙素-7-O-β-D-葡萄糖苷。
化合物7:黄色粉末。薄层色谱中为暗斑点,10%硫酸乙醇加热后显黄色。1H-NMR(DMSO-d6,600 MHz)δ :12.04(1H,s,5-OH),9.11(1H,s,3′-OH),6.94(1H,d,J=8.8 Hz,H-5′),6.93(1H,s,H-2′),6.88(1H,d,J=8.3 Hz,H-6′),6.15(1H,s,H-8),6.13(1H,s,H-6),5.50(1H,dd,J=2.4、12.0 Hz,H-2),4.96(1H,d,J=7.6 Hz),为糖的端基质子信号;δ:3.77(1H,s,O-CH3),3.20(1H,m,H-3a),2.77(1H,dd,J=17.0、2.4 Hz,H-3b)。13C-NMR(DMSO-d6,150 MHz) δ:197.1(C-4),165.3(C-7),162.9(C-5),162.6(C-9),148.0(C-4′),146.5(C-3′),130.9(C-1′),117.9(C-6′),114.2(C-2′),112.0(C-5′),103.3(C-10),99.6(C-1″),96.5(C-6),95.5(C-8),78.5(C-2),77.1(C-3″),76.3(C-5″),73.0(C-2″),69.5(C-4″),60.6(C-6″),55.7(OCH3),42.2(C-3)。以上数据与文献报道[10]基本一致,故鉴定化合物7为橙皮素-7-O-β-D-葡萄糖苷。
化合物8:黄色粉末。薄层色谱中为暗斑点,10% 硫酸乙醇加热后显黄色。采用HPLC法[11]分析,流动相为甲醇-水(3.5:6.5,V/V),检测波长为238 nm,以柚皮苷对照品为对照。结果,化合物8与柚皮苷对照品的保留时间一致,因此鉴定化合物8为柚皮苷。
化合物9:淡黄色粉末。薄层色谱中为暗斑点,10% 硫酸乙醇加热后显黄色。Molish反应呈阳性。1H-NMR(C5D5N,600 MHz) δ:7.48(1H,d,J=1.8 Hz,H-2′),7.05(1H,dd,J=1.8、7.8 Hz,H-6′),6.97(1H,d,J=7.8 Hz,H-5′),6.74(1H,d,J=1.8 Hz,H-8),6.71(1H,d,J=7.8 Hz,H-6),5.35(1H,dd,J=3.0、12.6 Hz,H-2),5.67(1H,d,J=7.2 Hz,H-1″),4.79(1H,br.s,H-1[′ ′ ′]),3.59(3H,s,OCH3),3.26(1H,dd,J=12.6、16.8 Hz,H-3a),2.89(1H,dd,J=3.0、16.8 Hz,H-3b),1.77(3H,d,J=6.0 Hz,rhamnosyl-CH3)。以上数据与文献报道[12]基本一致,故鉴定化合物9为橙皮苷。
化合物10:淡黄色粉末。薄层色谱中为暗斑点,10% 硫酸乙醇加热后显黄色。1H-NMR(CD3OD,600 MHz) δ:7.35(2H,d,J=8.4 Hz,H-2′,6′),6.45(2H,d,J=8.4 Hz,H-3′,5′),6.22(1H,br. s,H-8),6.19(1H,br. s,H-6),5.42(1H,m,H-2),4.97(1H,d,J=7.2 Hz,H-1″),4.72(1H,br. s,H-1[′ ′ ′]),3.33~3.99(10H,m,H-Glc和Rha),3.12(1H,m,H-3a),2.76(1H,m,H-3b),1.21(3H,d,J=6.0 Hz,CH3)。采用HPLC法[11]分析,流动相为甲醇-水(3.5 ∶ 6.5,V/V),检测波长为238 nm,以芸香柚皮苷对照品为对照。结果,化合物10与芸香柚皮苷对照品的保留时间一致,因此鉴定化合物10为芸香柚皮苷。
化合物11:黄色结晶(甲醇)。薄层色谱中为暗斑点,10% 硫酸乙醇加热后显红色。1H-NMR(DMSO-d6,600 MHz) δ:6.90(1H,dd,J=1.8、8.4 Hz,H-6′),6.76(2H,m,H-2′,5′),6.11(1H,d,J=2.4 Hz,H-8),6.09(1H,d,J=2.4 Hz,H-6),5.45(1H,dd,J=4.8、12.0 Hz,H-2),5.32(1H,br. s,H-1[′ ′ ′]),4.71(1H,dd,J=7.8、2.4 Hz,H-1″),1.16(3H,d,J=6.0 Hz,CH3)。13C-NMR(DMSO-d6,150 MHz) δ:197.8(C-4),165.3(C-7),163.4(C-5),163.2(C-9),146.4(C-4′),145.7(C-3′),129.7(C-1′),118.7(C-6′),115.8(C-5′),114.9(C-2′),103.8(C-10),101.0(C-1[′ ′ ′]),100.9(C-1″),96.7(C-6),95.6(C-8),79.4(C-2),79.1(C-3″),77.6(C-5″),77.4(C-2″),76.6(C-4[′ ′ ′]),72.3(C-3[′ ′ ′]),70.9(C-2[′ ′ ′]),70.0(C-4″),68.7(C-5[′ ′ ′]),60.9(C-6″),42.6(C-3),17.9(C-6[′ ′ ′])。以上数据与文献报道[13]基本一致,故鉴定化合物11为新圣草苷。
化合物12:黄色结晶(甲醇)。1H-NMR(DMSO-d6,600 MHz)δ:6.97(1H,d,J=8.4 Hz,H-6′),6.81(2H,br.s,H-2′,5′),6.21(1H,br. s,H-8),6.20(1H,br. s,H-6),5.36(1H,t,J=12.0 Hz,H-2),4.97(1H,d,J=7.2 Hz,H-1″),4.71(1H,d,J=2.4 Hz,H-1[′ ′ ′]),3.12(1H,t,J=15.6 Hz,H-3a),2.78(1H,t,J=15.6 Hz,H-3b),1.22(3H,d,J=6.0 Hz,rhamnosyl-CH3)。13C-NMR(DMSO-d6,150 MHz) δ:198.7(C-4),167.0(C-7),165.1(C-5),164.6(C-9),147.1(C-4′),146.7(C-3′),131.8(C-1′),119.4(C-6′),116.4(C-5′),115.0(C-2′),105.1(C-10),102.3(C-1[′ ′ ′]),101.3(C-1″),97.9(C-6),97.1(C-8),80.7(C-2),78.0(C-3″),77.2(C-5″),74.8(C-2″),74.2(C-4[′ ′ ′]),72.5(C- 3[′ ′ ′]),72.2(C-2[′ ′ ′]),71.4(C-4″),69.9(C-5[′ ′ ′]),67.6(C-6″),43.7(C-3),18.1(C-6[′ ′ ′])。以上數据与文献报道[13]基本一致,故鉴定化合物12为圣草次苷。
3 讨论
本研究从枳实中分离鉴定了12个酚类化合物,包括4个酚苷和8个黄酮类成分。其中,黄酮类成分如柚皮苷、橙皮苷、芸香柚皮苷在芸香科柑橘属植物中分布较为普遍,具有抗氧化、抗炎、抗肿瘤、促胃肠动力等多种药理活性[14],应用价值广泛。笔者查阅美国化学文摘、SCIE、中国知网、维普网等数据库,发现化合物1为新化合物,化合物2和化合物3(间苯三酚)是首次从柑橘属植物中分离得到的,其中间苯三酚是非阿托品非罂粟类的平滑肌解痉剂,也是消化系统痉挛性疼痛的首选药[15],化合物1和化合物4均为间苯三酚的衍生物,故笔者推测枳实中间苯三酚及其衍生物可能是其理气作用的有效成分,但具体作用机制仍需进一步深入研究。
参考文献
[ 1 ] 国家药典委员会.中华人民共和国药典:一部[S]. 2015年版.北京:中国医药科技出版社,2015:247.
[ 2 ] 姜峰.经方枳实应用规律浅析[J].中国中医基础医学杂志,2009,15(7):522-523.
[ 3 ] 邓可众,苌美燕,宗琪,等.枳实药材乙醇提取物的化学成分研究[J].中国药房,2018,29(4):458-460.
[ 4 ] XIONG Y,CHANG M,DENG K,et al. A new phenolic glycoside and two new monoterpenoid furocoumarins from Aurantii Fructus Immaturus[J]. Nat Prod Res,2016,30(14):1571-1576.
[ 5 ] 李良波,何翊,温秀萍,等.绵头雪莲的化学成分研究[J].时珍国医国药,2013,24(1):5-7.
[ 6 ] 韩丽平.鸡血藤的化学成分研究[J].中国药房,2006,17(20):1596-1598.
[ 7 ] 张永勇,倪丽,范春林,等.枳实中一个新的酚苷成分[J].中草药,2006,37(9):1295-1297.
[ 8 ] 丁邑强,熊英,周斌,等.枳壳中黄酮类成分的分离与鉴定[J].中国中药杂志,2015,40(12):2352-2356.
[ 9 ] 李藥兰,王辉,范兆永,等.水团花黄酮类成分及其体外抗病毒活性[J].天然产物研究与开发,2009,21(5):740- 743.
[10] 郑健,高慧媛,陈广通,等.留兰香的活性成分:Ⅰ[J].沈阳药科大学学报,2006,23(3):145-147.
[11] 王淳,吕署一,宋志前,等.高分离度快速液相色谱法测定不同产地枳实中主要黄酮类成分的含量[J].中国实验方剂学杂志,2009,15(6):1-3.
[12] 张庆华,蒋以号,龚千锋,等.枳壳樟帮炮制品黄酮类化学成分研究[J].时珍国医国药,2010,21(10):2536-2537.
[13] 闵鹏,赵庆春,高云佳,等.常山胡柚汁化学成分的研究[J].中国药物化学杂志,2010,20(2):129-132.
[14] 金元宝,刘萍,刘小根,等.柚皮苷的生物活性研究进展[J].中国现代医药杂志,2018,20(3):92-97.
[15] 李健和,易利丹,彭六保,等.间苯三酚的药理作用与临床应用[J].中国新药与临床杂志,2011,30(7):494-499.
(收稿日期:2020-01-30 修回日期:2020-03-26)
(编辑:唐晓莲)
