基于TLR4/NF-κB途径的白藜芦醇减轻LPS致小鼠急性肺损伤的机制研究
2020-07-23杨世勇何毅宋大强吴旭章卓
杨世勇 何毅 宋大强 吴旭 章卓
中圖分类号 R285;R967 文献标志码 A 文章编号 1001-0408(2020)09-1034-06
DOI 10.6039/j.issn.1001-0408.2020.09.03
摘 要 目的:观察白藜芦醇(Res)对脂多糖致急性肺损伤(ALI)小鼠的保护作用,并基于Toll样受体(TLR4)/核因子κB(NF-κB)途径探讨其可能机制。方法:将昆明种小鼠分为正常组、模型组、阳性对照组(地塞米松,0.5 mg/kg)以及Res低、中、高剂量组(50、100、200 mg/kg),每组10只。正常组和模型组小鼠均灌胃生理盐水,每日1次,连续7 d;阳性对照组小鼠腹腔注射地塞米松磷酸钠注射液,每日1次,连续3 d;Res各剂量组小鼠灌胃相应药物,每日1次,连续7 d。末次给药后,除正常组外的其余各组小鼠均于鼻内滴注LPS(5 mg/kg)以复制ALI模型。采用Hoechst 33242染色法观察各组小鼠肺泡灌洗液中的中性粒细胞凋亡情况,使用流式细胞术检测其凋亡率;采用酶联免疫吸附测定法检测血浆中白细胞介素6(IL-6)、肿瘤坏死因子α(TNF-α)含量;计算肺湿质量/干质量(W/D)比值;采用苏木精-伊红染色法观察肺组织的形态学特征;采用Western blotting法检测肺组织中TLR4、NF-κB的表达情况。结果:正常组小鼠肺泡灌洗液中凋亡中性粒细胞较少,肺组织结构完整,未见水肿、充血、渗出、炎症细胞浸润及其他炎症表现。模型组小鼠肺泡灌洗液中凋亡中性粒细胞明显增多,凋亡率显著升高(P<0.01);肺组织水肿、充血明显,并可见红色实变区;血浆IL-6和TNF-α含量、肺W/D比值、肺组织中TLR4和NF-κB的相对表达量均显著升高(P<0.01)。与模型组比较,各给药组小鼠肺泡灌洗液中凋亡中性粒细胞明显增多,凋亡率显著升高(P<0.05或P<0.01);肺组织上述症状均有不同程度的改善;血浆中IL-6和TNF-α含量、肺W/D比值以及肺组织中TLR4、NF-κB的相对表达量(除Res低剂量组外)均显著降低(P<0.05或P<0.01)。结论:Res对ALI模型小鼠具有一定的保护作用,其作用机制可能与抑制TLR4、NF-κB表达、从而减少炎症因子TNF-α、IL-6分泌有关。
关键词 白藜芦醇;急性肺损伤;Toll样受体4;核因子κB;炎症因子;机制;小鼠
Study on the Mechanism of Resveratrol Attenuating LPS-induced Acute Lung Injury in Mice Based on TLR4/NF-κB Pathway
YANG Shiyong1,2,HE Yi3,SONG Daqiang4,WU Xu1,ZHANG Zhuo1(1. Dept. of Pharmacology, School of Pharmacy, Southwest Medical University, Sichuan Luzhou 646000, China; 2. Dept. of Pharmacy, Deyang Peoples Hospital, Sichuan Deyang 618000, China; 3. Dept. of Urology, the Affiliated Hospital of Southwest Medical University, Sichuan Luzhou 646000, China; 4. Dept. of Pharmacy, the Affiliated Hospital of Southwest Medical University, Sichuan Luzhou 646000, China)
ABSTRACT OBJECTIVE: To observe the protective effects of resveratrol (Res) on LPS-induced acute lung injury (ALI) model mice, and to explore its possible mechanism based on TLR4/NF-κB pathway. METHODS: Kunming mice were divided into normal group, model group, positive control group (dexamethasone, 0.5 mg/kg), Res low-dose, medium-dose and high-dose groups (50, 100, 200 mg/kg), with 10 mice in each group. Normal group and model group were given normal saline intragastrically, once a day, for 7 days; positive control group were intraperitoneally injected with Dexamethasone sodium phosphate injection, once a day, for 3 days; Res groups were given relevant medicine intragastrically, once a day, for 7 days. After last administration, all the mice except the normal group were dripped LPS (5 mg/kg) into the nose to induce ALI model. The apoptosis of neutrophils in BALF was observed by Hoechst 33242 staining; the apoptosis rate of neutrophils were detected by flow cytometry. The contents of IL-6 and TNF-α in the plasma were detected by ELISA. After wet mass to dry mass (W/D) ratio of lung was calculated, the morphological characteristics of lung tissue were observed by HE staining. Western blotting assay was used to detect the expression of TLR4 and NF-κB in lung tissue. RESULTS: In normal group, there were few apoptotic neutrophils in the BALF, and the lung tissue structure was intact, without edema, hyperemia, exudation, inflammatory cell infiltration or other inflammatory manifestations. In model group, the number of apoptotic neutrophils in BALF increased, and the apoptotic rate of neutrophils were enhanced significantly(P<0.01); edema and hyperemia of lung tissue were significantly increased, and the red consolidation area was observed; the contents of IL-6 and TNF-α in plasma, the ratio of lung W/D, the relative expression of TLR4 and NF-κB in lung tissue were significantly increased (P<0.01). Compared with model group, the number of apoptotic neutrophils in BALF were increased, and the apoptotic rate of neutrophils were enhanced significantly (P<0.05 or P<0.01) above symptoms of lung tissue were improved to different extents; the contents of IL-6 and TNF-α in plasma, lung W/D ratio as well as relative expression of TLR4 and NF-κB in lung tissue (except for Res low-dose group) in administration groups were decreased significantly (P<0.05 or P<0.01). CONCLUSIONS: Res has a protective effect on ALI model mice, the mechanism of which may be related to reducing the generation of inflammatory cytokines TNF-α and IL-6 by inhibiting TLR4/NF-kB expression.
KEYWORDS Resveratrol; Acute lung injury; TLR4; NF-κB; Inflammatory cytokines; Mechanism; Mice
急性肺损伤(Acute lung injure,ALI)主要表现为严重的肺部炎症反应、急性呼吸窘迫综合征或肺功能衰竭,重症监护病房(ICU)患者的发病率为20%~40%,甚至可高达50%,病死率为30%~40%[1-2]。ALI的病因较为复杂,目前学者普遍认为该症的发生与炎症级联反应、中性粒细胞黏附以及肺水肿等有关[3]。Toll样受体4(TLR4)信号通路在炎症反应中具有重要作用,参与了ALI的发病过程[4]。有研究指出,髓样分化因子88(MyD88)依赖的TLR4信号通路被激活后,核因子κB(NF-κB)也被激活,后者可进一步促进肿瘤坏死因子α(TNF-α)、白细胞介素6(IL-6)等炎症因子的释放, 导致炎症级联反应的发生[5]。
白藜芦醇(Resveratrol,Res)是一种多酚类化合物,在虎杖属植物中含量丰富,具有抗炎、抗氧化、预防肿瘤发生、抑制细菌生长等作用[6]。鉴于Res的抗炎作用,本课题组推测其可能对脂多糖(LPS)诱导的ALI具有一定的减轻作用,并拟探索这一作用是否与TLR4/NF-κB关键因子的表达受到抑制有关。为此,本研究建立了ALI小鼠模型,通过检测炎症因子IL-6、TNF-α以及TLR4、NF-κB等指标的变化来探索Res对小鼠的保护作用及可能机制,以期为该化合物防治ALI提供理论依据,为该症治疗新靶点的挖掘提供参考。
1 材料
1.1 仪器
SpectraMax M3型酶标仪(美国MDS公司);SBK-YLQX-003552型流式细胞仪(美国BD公司);PAC300型电泳槽和转膜仪、ChemiDoc XRS+System/Image Lab Software型凝胶成像系统(美国Bio-Rad公司);TCS SP5型激光共聚焦扫描显微镜(德国Leica公司);CX23型生物显微镜(日本Olympus公司);DHG-9147A型恒温干燥箱(上海精宏实验设备有限公司);THM 75005289型离心机(美国Thermo Fisher Scientific公司);DSH2-300型恒温振荡仪(太仓市实验设备厂);Milli-Q Synthesis型超纯水系统(美国Millipore公司)。
1.2 药品与试剂
白藜芦醇对照品(成都普斯生物科技股份有限公司,批号:20180207,纯度:99%);地塞米松磷酸钠注射液(阳性对照,后文简称“地塞米松”,辰欣药业股份有限公司,批号:20180311,规格:1 mL ∶ 5 mg);牛血清白蛋白(BSA)、LPS(美国Sigma公司);兔源β-肌动蛋白(β-actin)、NF-κB、TLR4抗体(美国Abcam公司,批号分别为F1218、M1018、A0712);辣根过氧化物酶(HRP)标记的山羊抗兔IgG二抗、CCK-8试剂盒、ECL化学发光显色液、Hoechst 33242染色液、膜联蛋白Ⅴ-异硫氰酸荧光素/碘化丙啶(Annexin Ⅴ-FITC/PI)染色试剂盒、蛋白提取试剂盒(碧云天生物技术研究所,批号分别为A0208、20180711、20180621、C1027、C1062L、P0013B);IL-6、TNF-α酶联免疫吸附测定(ELISA)试剂盒(武汉优尔生科技股份有限公司,批号分别为20180313、20180411);苏木精-伊红(HE)试剂盒、BCA蛋白定量试剂盒(北京索莱宝科技有限公司,批号分别为20180612、20180521);氯化钠注射液(回音必集团江西东亚制药有限公司,批号:2018021822,规格:250 mL ∶ 2.25 g,作生理盐水用);其余试剂均为分析纯,水为超纯水。
1.3 动物
SPF级昆明种小鼠,雌雄各半,体质量18~22 g,由西南医科大学实验动物中心提供,动物生产许可证号:SCXK(川)2018-17。
2 方法
2.1 分组、造模与给药
取小鼠60只,适应性喂养7 d后,随机分为正常组、模型组、阳性对照组(地塞米松,0.5 mg/kg,以生理盐水为溶剂,剂量设置参考文献[7])以及Res低、中、高剂量组(50、100、200 mg/kg,以生理盐水为溶剂制成混悬液,使用前摇匀,剂量设置参考文献[7]),每组10只。造模前,Res各剂量组小鼠按1 mL/100 g灌胃相应药物,每日1次,连续7 d;阳性对照组小鼠按0.1 mL/100 g腹腔注射相应药物,每日1次,连续3 d[8];正常组和模型组小鼠按1 mL/100 g灌胃生理盐水,每日1次,连续7 d。第7天给药后,除正常组外,其余各组小鼠均于鼻内单次滴注LPS 5 mg/kg(滴注时间5 min)以建立ALI模型[9]。
2.2 肺泡灌洗液中的中性粒细胞凋亡情况考察
ALI模型复制24 h后,麻醉小鼠,分离其气管,将导管插入支气管,注入0.5 mL生理盐水灌洗,并反复抽吸灌洗液,重复灌洗5次;收集灌洗液,以250×g离心10 min,弃去上清液,沉淀加磷酸盐缓冲液(PBS,pH 7.2~7.4)1 mL,輕柔吹打、重悬,吸取上述细胞悬液(细胞计数约为1×105个/L)20 μL至载玻片上,以固定液(甲醇-冰乙酸,体积比3 ∶ 1)处理15 min后,用Hoechst 33242染色液于室温避光条件下染色15 min,置于激光共聚焦扫描显微镜下观察。每个样本选择500个细胞进行观察,记录中性粒细胞的凋亡情况(凋亡细胞细胞核呈亮蓝色,正常细胞细胞核呈淡蓝色)。另取上述细胞悬液100 μL,加入Annexin Ⅴ-FITC和PI染色试剂各5 μL,于室温避光条件下染色20 min,使用流式细胞仪检测中性粒细胞的凋亡率(FITC荧光波长设为530 nm,PI波长设为560 nm;FL1通道检测绿色荧光,FL3检测红色荧光)。以上试验重复3次。
2.3 血浆中IL-6、TNF-α含量检测
在灌洗前,于小鼠腹主动脉取血1 mL,置于肝素抗凝采血管中,摇匀,以1 000×g离心3 min,分离血浆。采用ELISA法以酶标仪检测各组小鼠血浆中IL-6、TNF-α的含量,严格按照相应试剂盒说明书操作。
2.4 肺湿质量/干质量比值检测
取血后,采用颈椎脱臼法处死各组小鼠,取其右肺上叶,称定湿质量(W);于80 ℃恒温干燥箱中烘烤约48 h至恒定质量,记为干质量(D);计算各组小鼠肺湿质量/干质量(W/D)比值。
2.5 肺组织形态学观察
采用HE染色法观察。称定肺质量后,取小鼠肺组织适量,置于4%多聚甲醛溶液中固定24 h,经常规石蜡包埋、切片(厚度约1~2 μm)后,以HE染色,并置于光学显微镜下观察肺组织的形态学特征。
2.6 肺组织中TLR4、NF-κB蛋白相对表达量检测
采用Western blotting法检测。取小鼠肺组织适量,用蛋白提取试剂盒提取肺组织蛋白,使用BCA法测定蛋白含量。煮沸10 min使蛋白变性,于4 ℃以12 000×g离心3 min,取沉淀进行十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)[恒流(10 mA)至分离胶后改为恒压(100 V)]。电泳结束后,转膜,加入相应一抗(稀释度均为1 ∶ 1 000),加BSA 2 mL,于4 ℃孵育过夜,用三羟甲基氨基甲烷盐酸盐(TBST)溶液清洗10 min×5次;加入相应二抗(稀释度均为1 ∶ 1 000),室温孵育1 h,用TBST溶液洗涤10 min×5次。经ECL化学发光显色液显色后,置于凝胶成像系统中成像,使用Image Pro-plus 6.0软件分析。以相应蛋白与内参(β-actin)的灰度值比值表示该蛋白的相对表达量。以上试验重复3次。
2.7 统计学方法
采用SPSS 19.0软件对数据进行统计分析。计量资料以x±s表示,多组间比较采用单因素方差分析,组间两两比较采用SNK法。P<0.05为差异有统计学意义。
3 结果
3.1 Res对ALI模型小鼠肺泡灌洗液中的中性粒细胞凋亡的影响
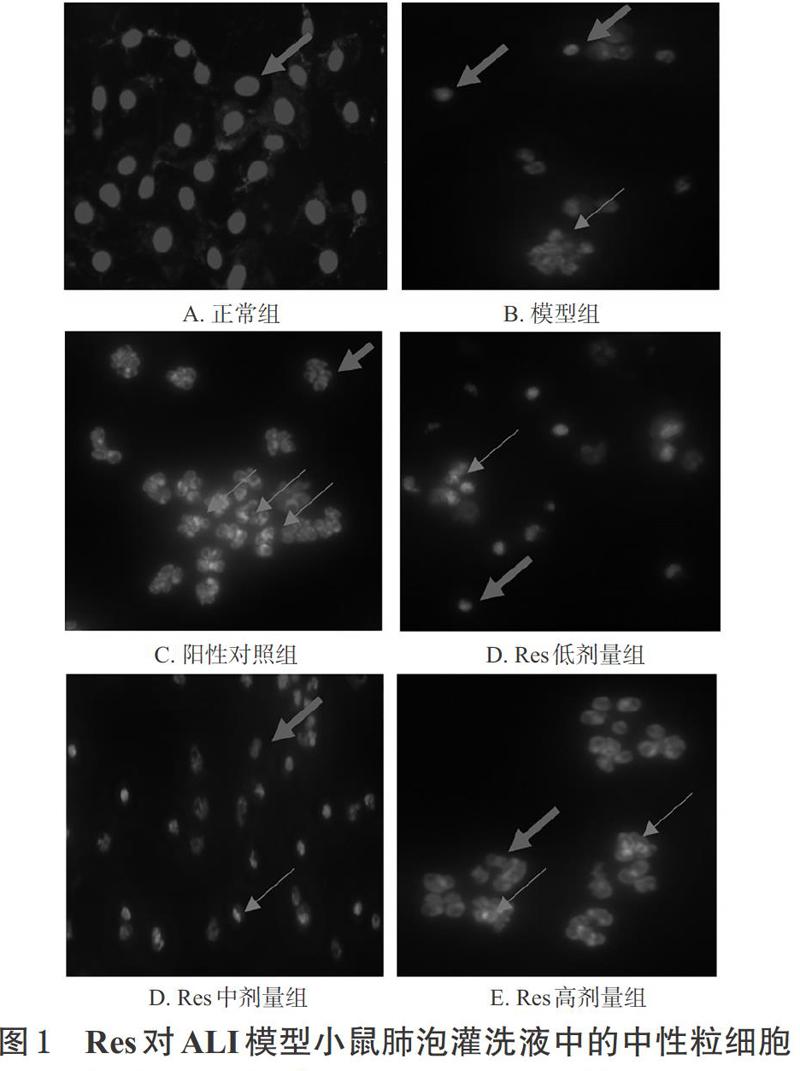
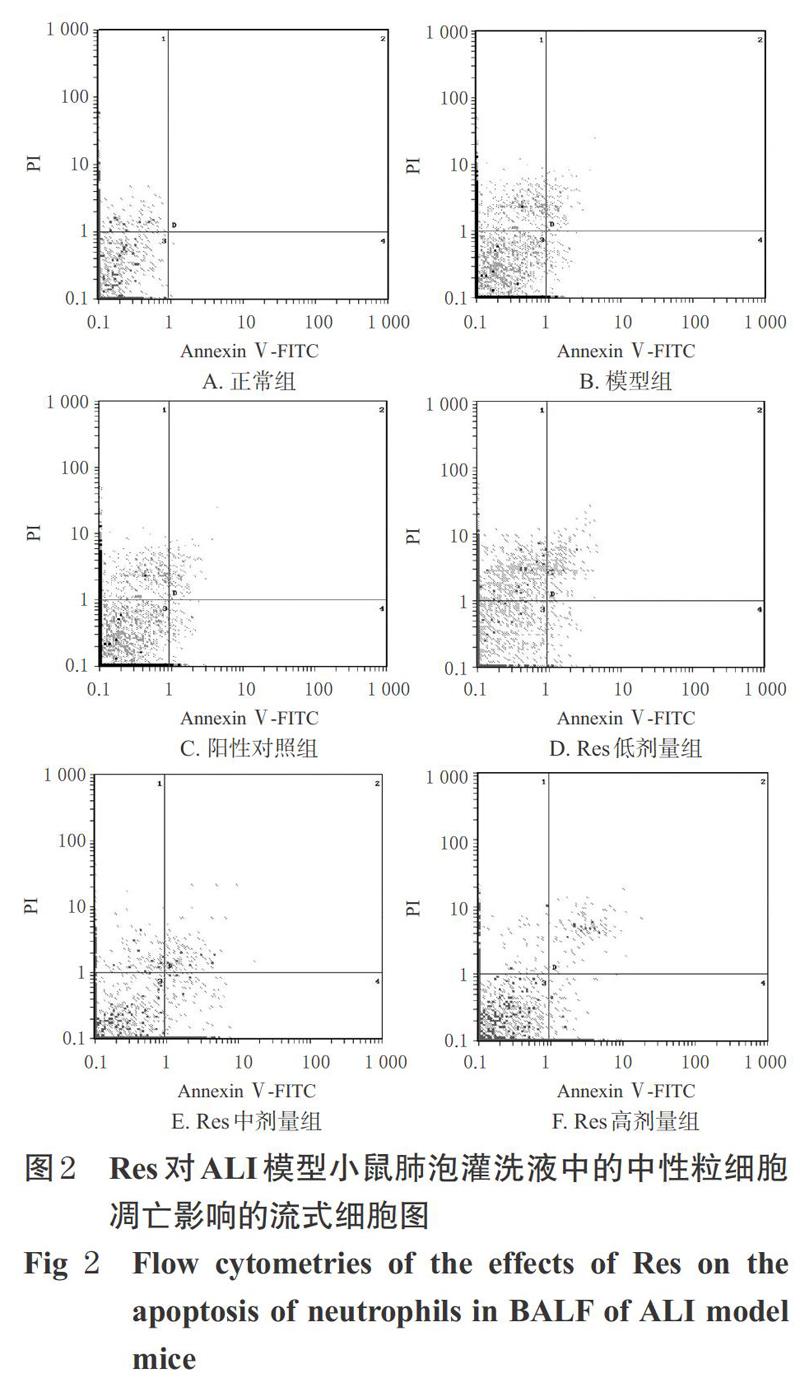
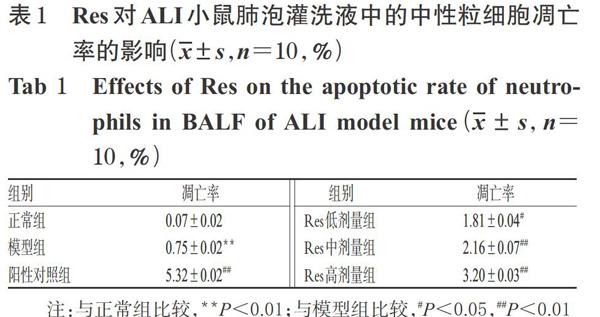
正常组小鼠肺泡灌洗液中的中性粒细胞呈浅蓝色,凋亡细胞较少;模型组小鼠肺泡灌洗液中可见明显亮蓝色凋亡中性粒细胞,并可见细胞核固缩、碎裂等现象,且其凋亡率较正常组显著升高(P<0.01);各给药组小鼠肺泡灌洗液中凋亡中性粒细胞明显增多,且凋亡率均较模型组显著升高(P<0.05或P<0.01),详见图1(图中,粗箭头表示正常细胞,细箭头表示凋亡细胞)、图2、表1。
3.2 Res对ALI模型小鼠血浆中IL-6、TNF-α含量的影响
与正常组比较,模型组小鼠血浆中IL-6、TNF-α含量均显著升高(P<0.01);与模型组比较,各给药组上述指标含量均显著降低(P<0.05或P<0.01),详见表2。
3.3 Res对ALI模型小鼠肺W/D比值的影响
与正常组比较,模型组小鼠肺W/D比值显著升高(P<0.01);与模型组比较,各给药组小鼠肺W/D比值均显著降低(P<0.05或P<0.01),详见表3。
3.4 Res对ALI模型小鼠肺组织形态学特征的影响
正常组小鼠肺组织结构完整,肺泡腔干净,肺泡壁无增厚、水肿、充血、液体渗出及其他炎症表现,也未见炎症细胞浸润。模型组小鼠肺组织呈暗红色,水肿、充血明显,且有片状出血和少许液体渗出,部分肺叶甚至可见红色实变区。Res低剂量组小鼠肺组织可见有斑片状出血点,范围和程度均较模型组小或轻;阳性对照组和Res中、高剂量组小鼠肺组织出血点较少,水肿现象不明显,渗出程度均较模型组轻,详见图3。
3.5 Res对ALI模型小鼠肺组织TLR4、NF-κB蛋白表达的影响
与正常组比较,模型组小鼠肺组织中TLR4、NF-κB蛋白的相对表达量均显著升高(P<0.01);与模型组比较,阳性对照组和Res中、高剂量组小鼠肺组织中TLR4、NF-κB蛋白的相对表达量均显著降低(P<0.05或P<0.01),详见图4、表4。
4 讨论
有研究指出,Res能减轻LPS诱导的牙周膜细胞损伤并抑制TLR4/NF-κB活化,也可通过TLR4/NF-κB通路减轻缺氧复氧诱导的肝细胞损伤,其干预小鼠的剂量以30、100、400 mg/kg不等,给药方式包括腹腔注射、股静脉注射、灌胃等[10]。结合现有研究的数据[7,11-12]和本课题组前期预实验结果,本研究采用Res 50、100、200 mg/kg以灌胃的方式进行干预;同时,为确保小鼠体内Res达到稳态浓度,本研究采用了造模前连续灌胃方式。地塞米松为经典激素类抗炎药物,故本研究以该药作为Res抗炎作用阳性对照药物。由于腹腔注射药物吸收快,因此地塞米松选择腹腔注射,每日1次,连续3 d;Res的半衰期为9.2 h,达稳态浓度时间需要4~5个半衰期,且口服吸收较慢,因此本研究选择Res的持续灌胃时间为7 d[8,13]。尽管阳性对照组和Res组小鼠的给药方式和持续时间有所不同,但最后药物在体内发挥的效应相似(考察指标数据结果相近),加之本研究以比較Res抗炎作用是否与地塞米松相近为重点,故设定了“2.1”项下的给药方式。
目前,ALI模型可分为肺内型和肺外型两大类[13-14],主要包括盲肠结扎穿孔、生理盐水肺灌注、鼻内滴注LPS等,以肺W/D比值以及肺组织病理改变等为指标对肺部病变情况进行判定[15-16]。本研究的主要目的在于观察ALI形成后,Res是否能通过影响炎症因子表达而发挥作用,对氧合指数以及是否发展为急性呼吸窘迫综合征等不作研究,因此综合各方法的优缺点最终选择鼻内滴注LPS造模。本研究结果显示,模型组小鼠肺W/D比值显著升高,提示肺部水肿严重;病理切片显示小鼠肺组织充血明显,肺泡腔内可见出血和渗出,甚至可见红色突变区,提示肺组织呈现急性炎症表现,证实ALI炎症模型建立成功。
中性粒细胞凋亡在ALI的发生发展过程中起着重要作用。ALI患者肺部急性炎症症状明显,出现大量聚集的中性粒细胞[17]。中性粒细胞在正常生理条件下寿命极短,在外周血循环中半衰期为2~8 h;在ALI发生24 h后,肺泡灌注液中的中性粒细胞凋亡率明显上升[18]。然而,尽管中性粒细胞凋亡率明显上升,但其聚集数量仍明显多于正常时期,从而导致了肺部严重炎症反应的发生。由此可见,若能采用恰当的手段减少肺组织中的中性粒细胞,就能够有效减少致炎因子和炎症介质的释放,从而有效改善肺部炎症症状[19]。Hoechst 33342染色结果和流式细胞结果显示,模型组小鼠由于LPS的刺激,肺泡灌洗液中凋亡中性粒细胞明显增多,且凋亡率较正常组显著升高;经Res预处理后,小鼠肺泡灌洗液中的中性粒细胞凋亡率均较模型组显著上升。这提示在抗炎过程中,Res能较模型组进一步促进中性粒细胞的凋亡,从而减少中性粒细胞的聚集。
TLR4信号通路参与了机体炎症反应,MyD88依赖的TLR4途径可促炎症因子的产生,从而激活NF-κB,后者可进一步释放炎症因子,从而引发“瀑布效应”导致全身炎症反应的发生[5]。其中,IL-6是IL家族的核心成员,在B细胞分化、T细胞增殖、急性期反应蛋白诱导等方面发挥着重要的作用,是反映机体炎症和疾病严重程度的指标之一[20];TNF-α不僅对损伤细胞具有直接毒性,还能通过结合多种细胞和活性物质间接对组织造成进一步损伤[21]。有研究指出,在ALI发生初期(2 h),肺组织中即可产生TNF-α,且随着时间的推移,最快6 h、最慢24 h后TNF-α含量即可达到最大值[22-23]。由此可见,IL-6和TNF-α参与了ALI早期严重炎症的发生。TLR4作为LPS的特异性配体,参与了LPS致ALI的发病过程,TLR4通路下游的NF-κB被激活后,导致炎症因子分泌进一步增多,提示TLR4与NF-κB参与了ALI的发展过程[24]。本研究结果显示,由于LPS的刺激,模型组小鼠血浆中IL-6、TNF-α含量均显著升高,肺组织中TLR4、NF-κB蛋白的相对表达量均显著升高,提示模型组小鼠的炎症反应可能与TLR4信号通路的激活有关。经Res预处理后,小鼠血浆中IL-6、TNF-α含量以及肺组织中TLR4、NF-κB蛋白的相对表达量均显著降低,提示Res能够抑制TLR4的表达,并进一步抑制NF-κB的激活,从而减少炎症因子的表达,最终减轻ALI程度。
综上所述,Res对ALI模型小鼠具有一定的保护作用,其作用机制可能与抑制TLR4、NF-κB表达、从而减少炎症因子TNF-α、IL-6分泌有关,但具体的分子机制还有待后续深入研究。
参考文献
[ 1 ] MIDDLETON EA,WEYRICH AS,ZIMMERMAN GA. Platelets in pulmonary immune responses and inflammatory lung diseases[J]. Physiol Rev,2016,96(4):1211-1259.
[ 2 ] SPECK NE,SCHUURMANS MM,MURER C,et al. Diagnostic value of plasma and bronchoalveolar lavage samples in acute lung allograft rejection:differential cytology[J]. Respir Res,2016. DOI:10.1186/s12931-016-0391-y.
[ 3 ] JIA H,SODHI CP,YAMAGUCHI Y,et al. Pulmonary epithelial TLR4 activation leads to lung injury in neonatal necrotizing enterocolitis[J]. J Immunol,2016,197(3):859- 871.
[ 4 ] ZHAO D,ZHANG J,XU G,et al. Artesunate protects LPS- induced acute lung injury by inhibiting TLR4 expression and inducing Nrf2 activation[J]. Inflammation,2017,40(3):798-805.
[ 5 ] SCHEIERMANN J,KLINMAN DM. Suppressive oligonucleotides inhibit inflammation in a murine model of mechanical ventilator induced lung injury[J]. J Thorac Dis,2016,8(9):2434-2443.
[ 6 ] 王红,贾明,侯晓彤.白藜芦醇的抗氧化抗炎作用和抗动脉粥样硬化研究进展[J].中国医药,2016,11(6):932- 935.
[ 7 ] 余天会,李永,甘波,等.白藜芦醇干预变应性哮喘小鼠对血红素加氧酶-1表达、炎性因子及氧化应激的影响[J].疑难病杂志,2018,17(12):1375-1379.
[ 8 ] 刘利本,平家奇,李佳佳,等.蒲公英提取物对急性肺损伤小鼠炎症介质及SOD含量的影响[J].安徽农业科学,2010,38(17):9007、9056.
[ 9 ] 曹志敏,唐明美,文强,等.内毒素所致急性肺损伤动物模型的研究进展[J].实验动物学,2017,34(1):62-65、70.
[10] 呼海燕,刘彩宏.白藜芦醇减轻LPS诱导的牙周膜细胞损伤并抑制TLR4/NF-κB活化[J].实用口腔医学杂志,2017,33(1):88-91.
[11] HU J,HAN H,CAO P,et al. Resveratrol improves neuron protection and functional recovery through enhancement of autophagy after spinal cord injury in mice[J]. Am J Transl Res,2017,9(10):4607-4616.
[12] HONG YA,BAE SY,AHN SY,et al. Resveratrol ameliorates contrast induced nephropathy through the activation of SIRT1-PGC-1α-Foxo1 signaling in mice[J]. Kidney Blood Press Res,2017,42(4):641-653.
[13] 安梅,周瑾,陈晓宇.白藜芦醇药理学作用研究进展[J].肿瘤药学,2014,4(4):242-246.
[14] 李竹英,王雪慧,刘建秋.急性肺损伤动物模型研究进展[J].中国中医急症,2011,20(11): 1817-1818.
[15] 焦光宇,聂志伟,刘春利,等.小剂量脂多糖气管内滴注制备急性肺损伤动物模型的探究[J].中国实验动物学报,2007,15(4):135-138.
[16] 张涛,熊旭东,赵敏.通腑泻肺方对脓毒症急性肺损伤大鼠NLRP3调控作用的实验研究[J].中国中医急症,2014,23(8):1406-1408、1440.
[17] 夏长江,孟格,赵建,等.中性粒细胞在急性肺损伤中的作用机制研究进展[J].国际药学研究杂志,2009,36(6):418-422.
[18] 朱珊珊,刘功俭.内毒素急性肺损伤与中性粒细胞凋亡研究现状[J].中国医药导报,2012,9(4):11-13.
[19] LAKSHMI SP,REDDY AT,NAIK MU,et al. Effects of JAM-A deficiency or blocking antibodies on neutrophil migration and lung injury in a murine model of ALI[J]. Am J Physiol Lung Cell Mol Physiol,2012,303(9):L758-L766.
[20] WANG HT,FANG YQ,BAO XC,et al. Expression changes of TNF-α,IL-1β and IL-6 in the rat lung of decompression sickness induced by fast buoyancy ascent escape[J]. Undersea Hyperb Med,2015,42(1):23-31.
[21] TANG M,TIAN Y,LI D,et al. TNF-α mediated increase of HIF-1α inhibits VASP expression,which reduces alveolar-capillary barrier function during acute lung injury(ALI)[J]. PLoS One,2014. DOI:10.1371/journal.pone. 0102967.
[22] TSANTES A,TSANGARIS I,KOPTERIDES P,et al. The role of procalcitonin and IL-6 in discriminating between septic and non-septic causes of ALI/ARDS:a prospective observational study[J]. Clin Chem Lab,2013,51(7):1535-1542.
[23] YANG Z,ZHANG XR,ZHAO Q,et al. Knockdown of TNF-α alleviates acute lung injury in rats with intestinal ischemia and reperfusion injury by upregulating IL-10 expression[J]. Int J Mol Med,2018,42(2):926-934.
[24] VOIRIOT G,RAZAZI K,AMSELLEM V,et al. Interleukin-6 displays lung anti-inflammatory properties and exerts protective hemodynamic effects in a double-hit murine acute lung injury[J]. Respir Res,2017,18(1):64-70.
(收稿日期:2019-08-11 修回日期:2020-02-06)
(編辑:张元媛)
