白屈菜红碱固体分散体的制备及其理化性质和抗氧化活性研究
2020-07-23王云李平平高振珅张晓萍王振周宏
王云 李平平 高振珅 张晓萍 王振 周宏


中圖分类号 R944.2+4 文献标志码 A 文章编号 1001-0408(2020)09-1054-08
DOI 10.6039/j.issn.1001-0408.2020.09.07
摘 要 目的:制备白屈菜红碱(CHE)固体分散体(SD),优化其处方工艺,并对所制产品进行表征和体外抗氧化活性考察。方法:采用紫外分光光度法测定SD中CHE的含量;在单因素试验的基础上,以产品收率为指标,以制备方法、载体材料种类、载体比例(药物-载体材料质量比)为考察因素,采用L9(34)正交试验优化SD的处方工艺并进行验证。在检测溶解度和累积溶出度的基础上,采用热分析法、X-射线衍射法和扫描电子显微镜等技术对产品进行物相表征;以抗坏血酸为阳性对照,采用1,1-二苯基-2-三硝基苯肼法(DPPH)测定产品的体外抗氧化活性。结果:CHE检测质量浓度的线性范围为2.4~5.6 μg/mL,定量限、检测限分别为0.066 9、0.022 1 μg/mL;精密度、稳定性、重复性试验的RSD均小于2%,加样回收率为97.50%~99.25%(RSD<1%,n=3)。最优制备工艺是以聚乙二醇6000(PEG 6000)为载体、载体比例为1 ∶ 3,采用溶剂法制备。按最优工艺制得3批CHE-PEG-SD,验证试验结果显示,其在15 min时的累积溶出度为(61.72±0.67)%,收率为(99.04±0.83)%。表征结果显示,制成CHE-PEG-SD后,其溶解度(3.725 mg/mL)和累积溶出度(61.72%,15 min)均高于CHE原料药[0.098 mg/mL,6.24%(180 min)];其吸热峰、晶体吸收峰均较原料药和载体有所移动甚至消失,CHE以非晶态均匀分散于载体中。体外抗氧化试验结果显示,不同质量浓度的CHE-PEG-SD均具有一定的DPPH自由基清除能力,半数抑制浓度为0.124 mg/mL,但高于抗坏血酸的0.041 mg/mL。结论:所建含量测定方法简便、准确;优化的SD处方工艺稳定、可行;所制CHE-PEG-SD的溶解度增大,体外溶出增多,且具有一定的体外抗氧化活性。
关键词 白屈菜红碱;固体分散体;工艺优化;体外溶出;表征;抗氧化活性
Preparation of Chelerythrine Solid Dispersion and Study on Its Physicochemical Properties and Antioxidant Activity
WANG Yun1,2,3,LI Pingping1,3,4,GAO Zhenshen1,ZHANG Xiaoping1,3,WANG Zhen1,ZHOU Hong3,5,6(1. College of Pharmacy, Linyi University, Shandong Linyi 276005, China; 2. College of Life Science and Biopharmaceutics, Shenyang Pharmaceutical University, Liaoning Benxi 117004, China; 3. Shandong Fuyang Energy Conservation Technology Co., Ltd., Shandong Linyi 276005, China; 4. Dept. of Pharmaceutical Engineering, College of Chemistry and Pharmacy, Guangxi Normal University, Guangxi Guilin 541004, China; 5. College of Chemistry and Molecular Engineering, Qingdao University of Science and Technology, Shandong Qingdao 266042, China; 6. Key Laboratory of Optic-electric Sensing and Analytical Chemistry for Life Science, Ministry of Education, Shandong Qingdao 266042, China)
ABSTRACT OBJECTIVE: To prepare Chelerythrine (CHE) solid dispersion (SD), optimize the formulation technology, characterize its preparation and investigate its in vitro antioxidant activity. METHODS: The content of CHE in SD was determined by UV spectrophotometry. Based on single factor tests, using the product yield as index, using preparation method, carrier material type, carrier material proportion (drug-carrier material mass ratio) as factors, the formulation technology of SD was optimized by L9(34) orthogonal test and validated. Based on solubility and accumulative dissolution determination, the product was characterized with thermal analyssis, X-ray diffraction and scanning electron microscope. Using ascorbic acid as positive control, in vitro antioxidant activity of the product was determined by DPPH method. RESULTS: The linear range of CHE was 2.4-5.6 μg/mL; quantitation limit and detection limit were 0.066 9, 0.022 1 μg/mL; RSDs of precision, stability and reproducibility tests were all lower than 2%; recoveries were 97.50%-99.25%(RSD<1%,n=3). The optimal preparation technology included using PEG 6000 as carrier material, carrier material ratio of 1 ∶ 3, prepared by solvent method. Three batches of CHE-PEG-SD were prepared. Verification test results showed that the accumulative dissolution of CHE-PEG-SD was (61.72±0.67)% at 15 min, and the yield was (99.04±0.83)%. The results of characterization showed that after CHE-PEG-SD prepared, its solubility (3.725 mg/mL) and accumulative dissolution (61.25%, 15 min) were higher than CHE raw material [0.098 mg/mL, 6.24% (180 min)]. The endothermic peak and crystal absorption peak moved or even disappeared compared with raw material and the carrier material, and CHE was uniformly dispersed in the carrier material as an amorphous state. Results of in vitro antioxidation test showed that different concentration of CHE-PEG-SD showed certain ability of DPPH free radical scavenging, and the IC50 was 0.124 mg/mL, higher than 0.041 mg/mL of ascorbic acid. CONCLUSIONS: Established content determination method is simple and accurate. The optimal SD formulation technology is stable and feasible. The solubility of prepared CHE-PEG-SD increases, and the dissolution in vitro increases, showing certain in vitro oxidation resistance.
KEYWORDS Chelerythrine; Solid dispersion; Technology optimization; Dissolution in vitro; Characterization; Antioxidant activity
白屈菜红碱(Chelerythrine,CHE)是一种苯并菲啶型生物碱,主要存在于白屈菜、博落回、飞龙掌血、血水草等药用植物中[1]。研究表明,CHE具有抑菌[2-4]、抗乙型肝炎病毒[5]、抗炎[6-7]、抑制肿瘤[1,8-12]等多种生物活性。但由于该化合物溶解度极低,使得其应用受到了一定限制[13]。由此可见,改善CHE的理化性质、提高药物溶解度和溶出速率并研发相关制剂对CHE的进一步应用具有积极的意义。
目前,有关CHE剂型的报道涉及明胶微球[14]、磁性纳米壳聚糖微球[15]、口服脂质体[16]、脂质体温敏凝胶[17]、聚氰基丙烯酸丁酯纳米粒[18]、复合磁性温敏凝胶[19]等。固体分散体(Solid dispersion,SD)是利用制剂技术使药物以固体溶液、微晶或无定型状态高度分散在载体中所形成的分散体系。与其他剂型相比,SD制备方法简单,且药物粒径更小、表面自由能更大,故可更显著地提高难溶性药物的溶解度、溶出度和生物利用度[20];此外,SD既可作为药物最终制剂产品,也可作为制剂中间体,在制药工业中应用广泛[21-22]。基于此,本研究以聚乙二醇(PEG)、聚乙烯吡咯烷酮(PVP)、泊洛沙姆为载体材料,将CHE制备成固体分散体(CHE-SD),并筛选其处方和制备方法;在考察其溶解度、体外溶出度的基础上,采用热分析法、X射线衍射法(XRD)和扫描电子显微镜(SEM)等方法对所得CHE-SD进行表征,并初步评价其体外抗氧化活性,旨在为CHE新制剂的进一步研发提供参考。
1 材料
1.1 仪器
TU-1810型紫外-可见分光光度计(北京普析通用仪器有限责任公司);DF-1型集热式磁力搅拌器(江苏金坛金城国胜实验仪器厂);AUY 220型电子分析天平(昆山规矩仪器科技有限公司);KQ-500B型超声波清洗器(昆山市超声仪器有限公司);DZF-6021型真空干燥箱(上海一恒科技有限公司);TGA 2型热分析仪(瑞士Mettler Toledo公司);NovaTM Nano型SEM(美国FEI公司);D8 Advance型全自动SEM(德国Bruker公司)。
1.2 药品与试剂
CHE原料药(长沙上禾生物科技有限公司,批号:STA-161103003,纯度:85%);CHE对照品(上海融禾医药科技发展有限公司,批号:B20052,纯度:>98%);PEG 6000、PVP K30(国药集团化学试剂有限公司);泊洛沙姆127、188(德國BASF公司);1,1-二苯基-2-三硝基苯肼(DPPH,美国Sigma公司,纯度:>97%);抗坏血酸(天津市科密欧化学试剂有限公司,纯度:>99.7%);无水乙醇等其余试剂均为分析纯,水为蒸馏水。
2 方法与结果
2.1 CHE-SD的制备
采用不同方法制备CHE-SD。
2.1.1 溶剂法
将CHE原料药与载体材料按处方比例混匀,加入适量无水乙醇使其溶解,置于60 ℃水浴中,充分搅拌,混匀后蒸发除去溶剂。将残渣置于普通干燥器中干燥过夜,取出,即得。
2.1.2 熔融法
将适量载体材料置于80 ℃水浴中,完全熔化后,按处方比例加入CHE原料药适量,充分搅拌至完全熔融。将上述混合物倒入预冷的烧杯中,于冰浴中剧烈搅拌至完全固化,置于普通干燥器中干燥过夜,取出,即得。
2.1.3 研磨法
按处方比例精密称取CHE原料药与载体材料,置于研钵中,均匀研磨,混合充分后,置于普通干燥器中干燥过夜,取出,即得。
2.1.4 溶剂熔融法
取CHE原料药和适量无水甲醇,于60 ℃下超声(功率:250 W,频率:40 kHz,下同),待药物溶解后,按处方比例加入熔融的载体材料,混匀,于80 ℃下蒸干溶剂。将残渣冷却、固化,置于普通干燥器中干燥过夜,取出,即得。
2.2 CHE定量分析
采用紫外分光光度法检测CHE的质量浓度。
2.2.1 溶液的制备
精密称取CHE对照品40 mg,置于100 mL量瓶中,加无水乙醇溶解并定容,得质量浓度为400 μg/mL的对照品贮备液;取上述贮备液1 mL,置100 mL量瓶中,用无水乙醇稀释并定容,即得4 μg/mL的CHE对照品溶液。另取“2.1”项下所得CHE-SD适量(约相当于CHE 40 mg),置于100 mL量瓶中,加无水乙醇约70 mL,超声处理15 min使其充分溶解,冷却至室温后用无水乙醇定容,摇匀,用干燥滤纸滤过;精密量取续滤液1 mL,置于100 mL量瓶中,用无水乙醇稀释并定容,即得供试品溶液。
2.2.2 测定波长的选择
取对照品溶液适量,在200~400 nm波长范围内扫描。结果,CHE在282 nm波长处有最大吸收,故将其作为定量分析的检测波长,详见图1。
2.2.3 方法学考察
(1)专属性:按处方比例精密称取载体材料、CHE对照品、CHE原料药各适量,先后按“2.1.1”(以该法为例,下同)、“2.2.1”项下方法制得不含CHE的空白载体溶液、CHE对照品+空白载体溶液(CHE质量浓度为5.4 μg/mL)、CHE-SD供试品溶液,并同法制得不含载体和CHE的空白对照溶液。取上述溶液各适量,于282 nm波长处扫描。结果,空白载体溶液和空白对照溶液在282 nm波长处均无吸收,而CHE+空白载体溶液和CHE-SD供试品溶液在此波长处均有最大吸收,且不受辅料和空白对照的干扰,提示本方法专属性良好,详见图2。
(2)线性关系:精密量取“2.2.1”项下CHE对照品贮备液60、80、100、120、140 μL,分别置于10 mL量瓶中,用无水乙醇稀释至刻度,得CHE质量浓度分别为2.4、3.2、4.0、4.8、5.6 μg/mL的标曲溶液,于282 nm波长处测定吸光度。以待测物吸光度(A)为纵坐标、质量浓度(c)为横坐标进行线性回归,得回归方程为A=0.143 2c+0.010 7(R 2=0.994 9),CHE检测质量浓度的线性范围为2.4~5.6 μg/mL。
(3)检测限与定量限:取“2.2.1”项下CHE对照品贮备液适量,以无水乙醇倍比稀释,分别按信噪比3 ∶ 1、10 ∶ 1计算检测限和定量限。结果,CHE的检测限、定量限分别为0.022 1、0.066 9 μg/mL。
(4)精密度试验:取“2.2.1”项下CHE对照品贮备液适量,以无水乙醇分别配制成低、中、高质量浓度(2.4、3.0、3.6 μg/mL)的对照品溶液,各溶液均连续测定6次,记录吸光度值,考察日内精密度;连续测定3 d,考察日间精密度。结果,低、中、高质量浓度溶液吸光度的日内、日间RSD分别为0.37%、0.39%、0.38%(n=6)和0.57%、0.59%、0.55%(n=18),均小于2%,表明仪器精密度良好。
(5)重复性试验:按“2.1.1”项下方法制备CHE-SD,并按“2.2.1”项下方法制备供试品溶液,取同一份上述供试品溶液于282 nm波长处重复测定6次,按外标法计算其质量浓度(cx):cx=(AX/AR)×cR(式中,cx、cR分别为供试品溶液、对照品溶液质量浓度,AX、AR分别为供试品溶液、对照品溶液的吸光度)。以质量浓度换算成含量(X,%):X=(cx×10/m)×100%(式中,X为CHE-SD含量,m为CHE-SD质量,10为稀释倍数)。结果,CHE平均含量为33.27%,RSD为0.55%(n=6),表明方法重复性好。
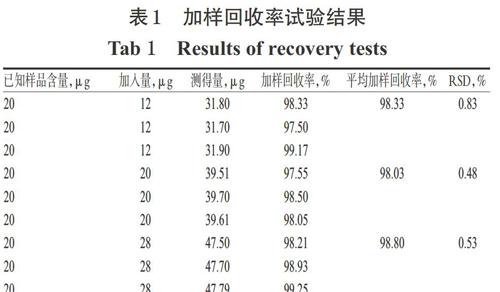
(6)加样回收率试验:按“2.1.1”项下方法制备CHE- SD,并按“2.2.1”项下方法制备供试品溶液。取上述供试品溶液各5 mL,共9份,分别置于10 mL量瓶中,分别精密加入“2.2.1”项下对照品贮备液30、50、70 μL(每种体积各3份),以无水乙醇定容,得低、中、高质量浓度溶液,于282 nm波长处检测各溶液吸光度并计算加样回收率。结果,低、中、高质量浓度溶液的平均加样回收率分别为98.33%、98.03%、98.80%,RSD分别为0.83%、0.48%、0.53%(n=3),详见表1。
(7)稳定性试验:按“2.1.1”项下方法制备CHE-SD,并按“2.2.1”项下方法制备供试品溶液,分别于室温放置0、1、2、4、8、12、24 h时测定其吸光度。结果,其吸光度的RSD<2%(n=7),表明供试品溶液在室温放置24 h内稳定性良好。
(8)样品含量测定:按“2.1”项下不同方法制备CHE-SD,并按“2.2.1”项下方法制备供试品溶液。取供试品溶液和“2.2.1”项下CHE对照品溶液(5.4 μg/mL)适量,于282 nm波长处检测其吸光度,按“2.2.3(5)”项下外标法计算CHE的质量浓度,并换算成含量。
2.3 体外溶出度的测定
采用2015年版《中国药典》(四部)通则“特征检查法”中的溶出度与释放度测定法——浆法[23]检测。设定转速为(100±1)r/min,水浴温度为(37.0±0.5)℃,以150 mL水为溶出介质。精密称取各待测样品,置于溶出杯中(实际量取的体积与规定体积的偏差应在±1%范围之内)。自待测样品接触溶出介质时开始计时,分别于2.5、5、10、15、30、60、90、120、180 min时取样,每次5 mL,并及时补加等温等体积溶出介质。取样液经0.25 μm微孔滤膜滤过后,精密吸取续滤液适量,按“2.2.1”项下方法制备供试品溶液,然后于282 nm波长处测定其吸光度。按“2.2.3(5)”项下外标法计算各时间点CHE的质量浓度,计算累积溶出度。各时间点校正后的累积溶出度(Re,%):Re=[cnV0+Vi[∑][i=1][n-1]ci
m] ×100%(式中,cn为第n次取样后溶出介质中药物的质量浓度;V0为溶出介质的体积;Vi为每次取样的体积;ci为第i次补液后取样前溶出介质中药物的质量浓度;m为CHE投料量)。
2.4 CHE-SD处方和制备工艺的优化
2.4.1 单因素试验
(1)CHE-SD的制备方法:以PEG 6000为载体材料,以载体比例(即药物-载体材料质量比)为1 ∶ 3,按“2.1”项下不同方法制备CHE-SD,再按“2.3”项下方法测定各SD制剂15 min时的累积溶出度,并计算产品收率(%):收率=(CHE-SD的质量/原料和辅料的总质量)×100%。以CHE累积溶出度和收率为指标,对制备方法进行筛选。结果,制备方法对CHE的累积溶出度有不同程度的影響,除研磨法所制样品累积溶出度较低外,其他方法所制CHE-SD的累积溶出度均超过50%,其中以溶剂法制得的CHE-SD药物溶出最多;此外,各方法所制CHE-SD的收率由低到高依次为研磨法、溶剂熔融法、溶剂法、熔融法,详见图3A、表2。
(2)CHE-SD的载体材料种类:分别以PEG 6000、PVP K30和泊洛沙姆127、188为载体材料,以载体比例为1 ∶ 3,按“2.1.1”项下方法制备不同载体材料的CHE-SD,再按“2.3”项下方法测定各SD制剂的累积溶出度,并按“2.4.1”项下方法计算其收率。以CHE累积溶出度和收率为指标,对载体材料进行筛选。结果,在由不同载体材料制得的CHE-SD中,药物累积溶出度各有不同,其中以PVP K30所制样品的溶出较少,泊洛沙姆127、188所制样品的溶出较多;此外,各载体所制CHE-SD的收率由低到高依次为PVP K30、PEG 6000、泊洛沙姆127、泊洛沙姆188,详见图3B、表2。
(3)CHE-SD的载体比例:以泊洛沙姆188为载体材料,以载体比例分别为1 ∶ 1、1 ∶ 3、1 ∶ 5、1 ∶ 7,按“2.1.1”项下方法制备CHE-SD,再按“2.3”项下方法测定各SD制剂的累积溶出度,并按“2.4.1”项下方法计算其收率。以CHE累积溶出度和收率为指标,对载体比例进行筛选。结果,在由不同载体比例制得的CHE-SD中,药物累积溶出度总体均有随载体用量增加而逐渐升高的趋势;此外,各比例载体所制CHE-SD的收率由低到高依次为 1 ∶ 3、1 ∶ 5、1 ∶ 1、1 ∶ 7,详见图3C、表2。
2.4.2 正交试验设计与结果
根据“2.4.1”项下单因素试验结果,采用正交试验法对CHE-SD处方和制备工艺进行优选,选取制备方法(A)、载体材料种类(B)、载体比例(C)3个因素,每个因素设置3个水平,根据L9(34)正交表安排试验,以收率(%)为考察指标。正交试验因素与水平见表3(本研究拟主要考察不同种类的载体材料,故选择了泊洛沙姆中收率更高的泊洛沙姆188),试验设计与结果见表4,方差分析结果见表5。
由表4可见,各因素对收率影响程度的排序为B>A>C,各因素水平最优组合为A1B1C2。由表5可见,因素A、B对产品收率的影响有统计学意义(P<0.05)。
2.4.3 验证试验
按“2.4.2”项下最优工艺制备3批SD(以下称为“CHE-PEG-SD”),按“2.2”“2.3”项下方法分别测定含量、溶出度,并按“2.4.1”项下方法计算收率。结果,3批CHE-PEG-SD在15 min时的累积溶出度为(61.72±0.67)%(RSD=1.08%,n=3),收率为(99.04±0.83)%(RSD=0.84%,n=3)。
2.5 CHE-PEG-SD的表征
2.5.1 溶解度
分别取过量的CHE原料药、CHE与PEG的物理混合物(各组成比例同CHE-PEG-SD,下同)、按“2.4”项下最优工艺制得的CHE-PEG-SD(下同)各3份,分别置于刻度试管中,加水1 mL,剧烈振荡,经0.25 μm微孔滤膜滤过。取续滤液,以无水乙醇适当稀释,混匀,于282 nm波长处测定其吸光度,计算溶解度:溶解度(mg/mL)=溶剂中CHE的质量/溶剂体积。结果,CHE原料药、物理混合物、CHE-PEG-SD在水中的溶解度分别为0.098、0.112、3.725 mg/mL。
2.5.2 体外溶出度
按“2.3”项下方法分别考察CHE原料药、CHE与PEG的物理混合物、CHE-PEG-SD的累积溶出度。结果,CHE原料药、CHE与PEG的物理混合物在180 min时的累积溶出度分别为6.24%、7.19%,而CHE-PEG-SD在15 min时的累积溶出度就已达最高值61.72%。
2.5.3 热分析
取CHE原料药、PEG 6000、CHE与PEG的物理混合物、CHE-PEG-SD各适量,进行热分析。热分析条件:氛围气为氮气,升温速度为10 ℃/min,终点温度为600 ℃,热重分析(TGA)、差示扫描量热分析(DSC)、微商热重分析(DTG)结果见图4。由图4可见,CHE原料药在185.17 ℃有1个特征吸热峰,相当于药物的熔点。PEG 6000在63.83 ℃左右有1个较大的吸热峰,为其熔融峰;在388.50 ℃有1个较为钝圆的吸热峰,为其失重峰。PEG的上述特征吸热峰较之于CHE与PEG的物理混合物和CHE-PEG-SD的相应图谱中相应峰均有一定程度移动,且CHE的吸热峰消失。这表明形成物理混合物和固体分散体后,CHE以非晶态分散于载体PEG中。此外,物理混合物与CHE-PEG-SD相比,样品失重率达5%时的温度(即分解温度)提高了,提示CHE-PEG-SD中CHE与PEG之间的相互作用力比物理混合物更强。
2.5.4 XRD分析
取CHE原料药、PEG 6000、CHE与PEG的物理混合物、CHE-PEG-SD各适量,进行XRD分析。XRD条件:铜(Cu)靶,高压强度为40 kV,管流为30 mA,扫描范围为4~90°,扫描速度为2 °/min,结果见图5。由图5可见,CHE原料药具有明显的晶体吸收峰;PEG 6000仅在19.3、24.4°处有强吸收峰;上述CHE的晶体吸收峰在CHE与PEG的物理混合物及CHE-PEG-SD中有一定程度的减弱或消失,提示CHE在SD制剂中以非晶态存在。
2.5.5 SEM分析
取CHE原料药、PEG 6000、CHE与PEG的物理混合物和CHE-PEG-SD各适量,采用SEM直接观察其表面形貌,结果见图6。由图6可见,CHE原料药为斜棱柱状或片状结晶,PEG 6000以非晶态存在,两者物理混合物为晶体和非晶体的混合物,而CHE-PEG-SD中未見晶体存在,提示药物CHE以非晶态均匀分散在载体中。
2.5.6 抗氧化活性的研究
(1)DPPH溶液的配制:称取DPPH 19.8 mg,用95%乙醇溶解并定容于50 mL量瓶中,摇匀;取上述溶液1 mL,用95%乙醇定容至10 mL容量瓶中,即得质量浓度为39.6 μg/mL的DPPH溶液,备用。
(2)抗坏血酸溶液的配制:精密称取抗坏血酸0.1 g,置于烧杯中,加水溶解后转移至25 mL量瓶中,用水定容,配制成质量浓度为4 mg/mL的抗坏血酸溶液,备用。
(3)CHE-PEG-SD待测液的配制:精密称取按“2.4”项下最优工艺制得的CHE-PEG-SD适量,用适量95%乙醇溶解,定容于10 mL量瓶中,依次量取1、2、3、4、5 mL(取样量参考本课题组前期预试验结果),以95%乙醇分别定容于10 mL量瓶中,摇匀,即得,备用。
(4)抗氧化活性的测定:精密吸取上述CHE-PEG-SD待测液和抗坏血酸溶液各2 mL,分别与DPPH溶液2 mL混合,摇匀后放置30 min,以95%乙醇为空白对照,于517 nm波长处检测两者的吸光度值(A1);精密吸取上述CHE-PEG-SD待测液和抗坏血酸溶液各2 mL,分别与95%乙醇2 mL混合后,以95%乙醇为空白对照,于517 nm波长处检测两者的吸光度值(A2);将DPPH溶液2 mL与95%乙醇2 mL混合后,以95%乙醇为空白对照,于517 nm波长处测其吸光度值(A3)。计算CHE-PEG-SD对DPPH自由基的清除率:清除率(%)=[1-(A1-A2)/A3]×100%,并计算其半数抑制浓度(IC50),结果见图7。由图7可见,不同质量浓度CHE-PEG-SD和抗坏血酸对DPPH自由基均有一定的清除能力;但与抗坏血酸相比,CHE-PEG-SD对DPPH自由基的清除率更低,IC50更高(抗坏血酸、CHE-PEG-SD的IC50分别为0.041、0.124 mg/mL)。
3 讨论
CHE具有多種生物活性,但因溶解度较低,使得其应用受到了一定的限制[13]。近年来,国内外有关CHE的药剂学研究不多,常见剂型主要包括明胶微球、磁性纳米壳聚糖微球、口服脂质体、脂质体温敏凝胶、聚氰基丙烯酸丁酯纳米粒、复合磁性温敏凝胶等[14-19]。在涉及CHE原料药药动学及相应微粒分散型制剂的相关研究[13-19,24]中,仅有1篇[13]关于CHE-聚乙烯醇-SD及其抗炎活性的研究。CHE是一种难溶性化合物,制成的普通制剂溶出度低、生物利用度差,而明胶微球制剂、磁性纳米壳聚糖微球等制剂工艺较为复杂,故改善其溶解度、开发制剂工艺简单的剂型成为CHE剂型研发的热点之一。目前,SD技术已广泛应用于增加难溶性药物溶解度和溶出速率的制剂研究中,是改善难溶性药物生物利用度的有效措施之一[20],加之其工艺较为简单、相关研究较少,故本研究对CHE-SD的制备进行了初步探讨。
本研究建立了检测制剂中CHE含量的紫外分光光度法,并进行了专属性、精密度、重复性、稳定性、加样回收率等方法学考察。结果显示,CHE在282 nm波长处有最大吸收,各载体成分不干扰CHE的定量分析,方法学考察结果显示本法可用于CHE-SD中药物含量的检测。
本研究采用溶剂法、熔融法、研磨法、溶剂熔融法等不同方法制备CHE-SD,并考察了多种载体材料如PEG 6000、PVP K300、泊洛沙姆127/188以及其比例等对CHE-SD药物溶出度和收率的影响。单因素与正交试验结果表明,上述因素对CHE-SD的药物溶出度和收率均有一定的影响,尤其是制备方法和载体材料种类的影响更为明显。所得最优工艺是以PEG 6000为载体材料,CHE原料药与载体质量比为1 ∶ 3,采用溶剂法制备。以最优工艺所得CHE-PEG-SD在15 min时的累积溶出度为(61.72±0.67)%,收率为(99.04±0.83)%,RSD均小于2%,提示工艺可行、稳定。
本研究以原料药、PEG 6000及两者物理混合物为对照,在检测溶解度、累积溶出度的基础上,利用热分析、XRD、SEM技术对所制备的CHE-PEG-SD进行了物相表征。结果显示,CHE-PEG-SD的溶解度为3.725 mg/mL,显著高于物理混合物(0.112 mg/mL)和原料药(0.098 mg/mL);15 min时累积溶出度已达峰值61.72%,显著高于物理混合物(6.24%,180 min)和原料药(7.19%,180 min)。CHE原料药主要为斜棱柱状及片状结晶;制成SD后,CHE吸热峰、晶体吸收峰均较原料药和载体有所移动或消失,药物主要以非晶态均匀分散在载体中,物相特征发生明显变化。这可能是因为药物分子与载体之间存在氢键等相互作用力,导致在固化时形成了具有较高能量的非结晶无定形物[25],而这种作用力及非晶态可能也是CHE-PEG-SD溶解度增大的原因之一。
本研究以抗坏血酸为阳性对照,采用DPPH法对CHE-PEG-SD的体外抗氧化活性进行了评价。结果显示,不同质量浓度的CHE-PEG-SD均具有一定的DPPH自由基清除能力(IC50=0.124 mg/mL),但弱于抗坏血酸(IC50=0.041 mg/mL),其具体作用机制有待后续研究。
综上所述,本研究所建含量测定方法简便、准确;优化的制备工艺合理、可行;所得CHE-PEG-SD溶解度显著增大,体外溶出明显增多,且具有一定的体外抗氧化活性。但本研究所制得的CHE-PEG-SD的稳定性、药动学特征、药理活性及作用机制等尚有待进一步研究,且制剂的速释和控释功能亦有待完善。
参考文献
[ 1 ] 王培卿,尹震花,康文艺.白屈菜红碱药理活性研究进展[J].中国中药杂志,2013,38(17):2745-2749.
[ 2 ] 康伟松,程辟,曾建国.血根碱、白屈菜红碱离子对化合物的体外抗菌活性研究[J].中南药学,2014,12(5):406- 411.
[ 3 ] 邱东旭.白屈菜红碱的抑菌活性及其抑菌机理研究[D].哈尔滨:东北林业大学,2018.
[ 4 ] WIANOWASKA D,GARBACZEWSKA S,CIENIECKA- ROSLONKIEWICZ,et al. Chemical composition and antifungal activity of Chelidonium majus extracts:antagonistic action of chelerythrine and sanguinarine against Botr- ytis cinerea[J]. Chemistry Ecology,2018,34(6):582-594.
[ 5 ] 刘薇,程辟,卿志星,等.血根碱、白屈菜红碱衍生物的合成与体外抗HBV活性研究[J].中南药学,2014,12(6):524-528.
[ 6 ] 徐香琴,黄松,杜先华,等.白屈菜红碱对小鼠溃疡性结肠炎的治疗作用[J].中国实验方剂学杂志,2014,20(21):171-174.
[ 7 ] 李晓明,欧阳婷庭,董妙先,等.白屈菜红碱对肝纤维化小鼠TGF-β/Smads信号通路的影响[J].中国病理生理杂志,2018,34(7):1323-1328.
[ 8 ] 陈志宝,李欣然,朱淼,等.白屈菜红碱抗肿瘤机制研究进展[J].江苏农业科学,2013,41(1):9-12.
[ 9 ] 刘帆,张正付,魏雄辉.白屈菜红碱对宫颈癌细胞的抑制作用研究[J].现代生物医学进展,2009,9(3):514-516.
[10] 韩聪,朱国福.白屈菜红碱诱导人肝癌细胞HepG2凋亡及机制探讨[J].中国实验方剂学杂志,2016,22(11):127-130.
[11] WU S,YANG Y,LI F,et al. Chelerythrine induced cell death through ROS-dependent ER stress in human prostate cancer cells[J]. Onco Targets Ther,2018. DOI:10. 2147/OTT.S157707.
[12] 程金玉,趙乐中,李伟,等.白屈菜红碱对人高转移性肝癌细胞系MHCC97-H生长侵袭和迁移能力的调节作用[J].中西医结合肝病杂志,2019,29(2):149-151、166.
[13] LI W,QING S,ZHI W,et al. The pharmacokinetics and anti-inflammatory effects of chelerythrine solid dispersions in vivo[J]. J Drug Deliv Sci Technol,2017. DOI:10.1016/j.jddst.2017.05.023.
[14] 张德柱,许洪波,王富民,等.白屈菜红碱明胶微球的制备及体外释放研究[J].西北药学杂志,2013,28(2):191- 194.
[15] YANG F,XIAO W,MA X,et al. Optimization of a novel chelerythrine-loaded magnetic Fe3O4/chitosan alpha-ketoglutaric acid system and evaluation of its anti-tumour activities[J]. J Pharm Pharmacol,2016,68(8):1030-1040.
[16] LI W,XING W,NIU X,et al. The pharmacokinetics of chelerythrine solution and chelerythrine liposomes after oral administration to rats[J]. Planta Med,2013,79(8):654-660.
[17] 柳阳,朱艳华,贾婉莹,等.白屈菜红碱脂质体-温敏凝胶的制备及体外释放研究[J].化学工程师,2019,33(3):83-86.
[18] 曹旭,赵雷,孙晨.白屈菜红碱聚氰基丙烯酸丁酯纳米粒的制备研究[J].化工与医药工程,2018,39(4):41-44.
[19] WANG Y,ZHONG M,LU WANG,et al. Chelerythrine loaded composite magnetic thermosensitive hydrogels as a novel anticancer drug-delivery system[J]. J Drug Deliv Sci Technol,2019. DOI:10.106/j.jddst.2019.101293.
[20] 游国叶,樊轻亚,杜晶,等.辣椒素固体分散体的处方工艺优化及表征[J]. 中国药房,2019,30(11):1464-1469.
[21] 王汝兴,于海龙,薛禾菲,等.黄芩苷单层渗透泵片的制备工艺及体外释药行为研究[J].中国药房,2017,28(1):107-110.
[22] 王学霞,刘庆娜,庞淑慧.西尼地平缓释片的处方优化及释药机制研究[J].中国药房,2017,28(25):3565-3568.
[23] 国家药典委员会.中华人民共和国药典:四部[S]. 2015年版.北京:中国医药科技出版社,2015:121-124.
[24] HU N,CHEN M,LIU Y,et al. Pharmacokinetics of sanguinarine,chelerythrine,and their metabolites in broiler chickens following oral and intravenous administration[J]. J Vet Pharmacol Therap,2019. DOI:10.1111/jvp.12729.
[25] 王悦,吴刚.氢键在晶体工程及难溶性药物开发中的应用[J].滁州学院学报,2018,20(2):52-56.
(收稿日期:2019-09-03 修回日期:2020-03-01)
(编辑:张元媛)
